2.2 炔烃 课件(共17张PPT)人教版 选择性必修3
文档属性
| 名称 | 2.2 炔烃 课件(共17张PPT)人教版 选择性必修3 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-11 09:10:06 | ||
图片预览



文档简介
(共17张PPT)
1.通过拼插并对比乙烯、乙炔分子模型,加深对乙炔结构特点的认识,为分析和预测乙炔的性质奠定基础。
2.通过实验探究乙炔的主要化学性质,初步形成基于官能团、化学键特点和反应规律分析预测有机物性质的认知模型。
3.通过对乙炔结构、性质和用途的认识以及对炔烃化学性质的分析,强化“结构决定性质、性质决定用途”的化学观念。
4.通过对“工业上脱除乙烯中的乙炔”问题的分析和解决,让学生感受化学科技进步给社会生产和生活带来的重要贡献,建立正确的化学价值观念。
【教学目标】
化学走进生活
工业乙烯的原料主要来源于石油产品裂解,但这样获得的乙烯中含有质量分数0.5%~2.0%的乙炔杂质,乙炔杂质会导致乙烯聚合反应催化剂中毒,为了防止这种现象出现,提高乙烯聚合产品质量,需要除去乙烯中少量的乙炔。
如何除去乙烯中的少量乙炔气体?
微观探析
主题一:炔烃的结构
以小组为单位,拼插乙烯、乙炔的分子结构模型,观察结构特点并展开讨论。
动手做一做
微观探析
主题一:炔烃的结构
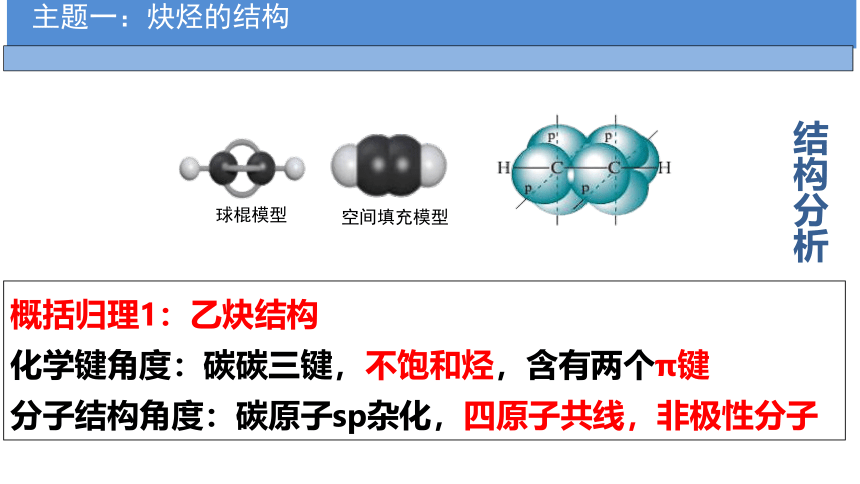
概括归理1:乙炔结构
化学键角度:碳碳三键,不饱和烃,含有两个π键
分子结构角度:碳原子sp杂化,四原子共线,非极性分子
球棍模型
空间填充模型
结构分析
主题二:炔烃的性质
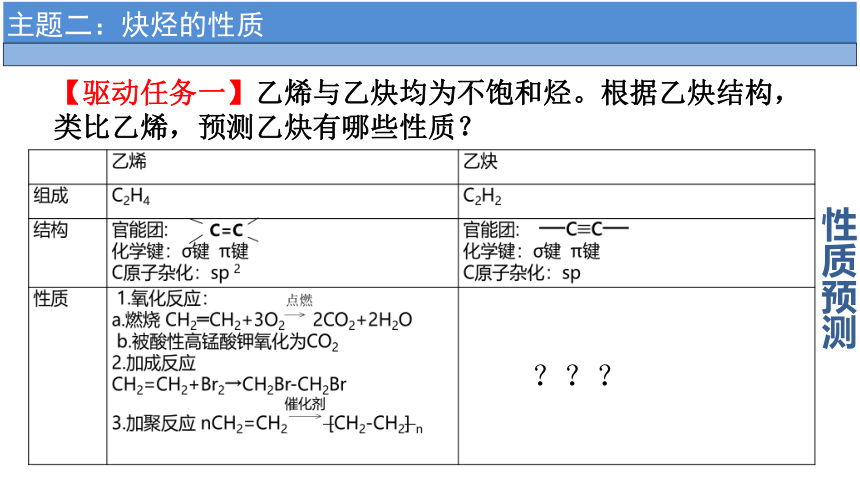
【驱动任务一】乙烯与乙炔均为不饱和烃。根据乙炔结构,类比乙烯,预测乙炔有哪些性质?
性质预测
???
主题二:炔烃的性质
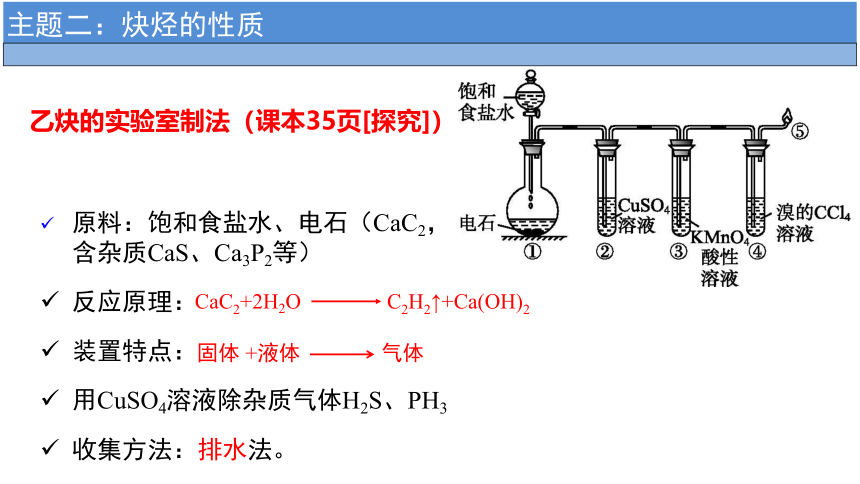
CaC2+2H2O C2H2↑+Ca(OH)2
反应原理:
原料:饱和食盐水、电石(CaC2,含杂质CaS、Ca3P2等)
装置特点:
固体 +液体 气体
用CuSO4溶液除杂质气体H2S、PH3
收集方法:排水法。
乙炔的实验室制法(课本35页[探究])
主题二:炔烃的性质
【驱动任务二】实验探究
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
火焰明亮,有浓烟
主题二:炔烃的性质
【驱动任务三】深入探究
1.实验现象与你的预想是否相同?
2.如何解释这一现象?
浓度相同,气流速度相同
发现问题—解决问题
时间进行了快进处理
课本图片
现有认知水平: 乙炔中的--C≡C-键长比乙烯中的 C=C 的键长短,键能大,反应中不易断裂,速度慢。
结构决定性质
主题二:炔烃的性质
【学以致用】乙炔在催化剂,加热下可以与H2,HCl,H2O等发生反应,写出方程式。
【练习】丙炔(CH3—C CH )是乙炔的同系物,在催化剂、加热条件下与HCl发生加成反应,写出按物质的量1:1反应的方程式。
模型认知
炔烃:含有一个碳碳三键的烃。
乙炔: CH CH
类比归纳
主题二:炔烃的性质
【问题探究】丙炔与HCl按物质的量1:1的产物中以 为主,
请从化学键的极性的角度进行解释。
C—CH
CH3—
推电子基
H-Cl
δ+
δ-
δ+
δ-
|
H
δ+
|
Cl
δ-
CH3—C=CH2
|
Cl
CH3—C CH
模型认知
主题二:炔烃的性质
C—CH
CH3—
推电子基
H-Cl
δ+
δ-
δ+
δ-
|
H
δ+
|
Cl
δ-
异性相吸,正负结合
概括归理2:
炔烃类物质具有相同的官能团,性质相似。
炔类同系物的性质也因其具有不同烷基而具有一定的差异。
模型认知
【问题探究】丙炔与氯化氢的按物质的量1:1的产物中以 为主,
请从化学键的极性的角度进行解释。
CH3—C CH
CH3—C=CH2
|
Cl
主题二:炔烃的性质
【知识梳理】
名称 烯烃 炔烃
组成 通式 CnH2n(n≥2) CnH2n-2(n≥2)
不饱和度 1 2
官能团 碳碳双键 碳碳三键
结构 C原子杂化类型 sp2 sp
空间结构特点 6原子共面 4原子共线
性质 燃烧现象 火焰明亮,伴有黑烟 火焰明亮,伴有浓烟
与酸性高锰酸钾反应 褪色 褪色
含溴的四氯化碳溶液 褪色 褪色
是否与H2、HCl加成 是 是
是否发生加聚反应 是 是
主题三:炔烃的应用
乙炔的主要用途
(1)乙炔在氧气中燃烧时产生的氧炔焰(可达3000摄氏度)可用来切割或焊接金属。
(2)乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
nCH ≡ CH [ CH=CH ]n
催化剂
导电塑料——聚乙炔
(制导电高分子材料)
(3)
主题三:炔烃的应用
工业生产中如何除去乙烯中少量的乙炔?
3、据科技部官网2021年8月报道,中科院理化技术研究所研发团队提出了一种新型电催化乙炔还原反应策略,研究人员采用一种新的纳米催化材料,以水取代氢气,在室温下实现了乙烯气体中低浓度乙炔的选择性还原,各项指标均达到或超过了热催化乙炔加氢报道的最优值,这一研究成果发表在《自然·催化》杂志上。
2、使用特殊的催化剂可使乙炔与氢气的加成反应停留在第一步产物阶段,目前工业上脱除乙烯中的乙炔普遍采用的方法也正是这种热催化加氢技术。
C2H2 C2H4 C2H6
H2
1、物理方法:深冷法、溶剂吸收法、吸附法、……
主题三:炔烃的应用
阴极:C2H2→C2H4 阳极:H2O → O2
优点:1、乙炔还原和O2析出分别发生在两极,产物中不会混进O2;
2、省去了额外的氢气分离操作,降低了成本;
3、避免乙烯过度加氢生成乙烷;
4、原子利用率更高,能量利用率更高,符合绿色化学的指导思想;
5、…………
该成果是化学工作者的自豪,也是中华民族的自豪!
电催化乙炔还原反应
碳中和
双电极电化学乙炔还原流通池示意图
热催化:
C2H2 + H2 → C2H4
电催化:
C2H2 + H2O → C2H4 + O2
乙炔结构
乙炔性质
类别观
炔烃性质
烯炔对比
用途
官能团
化学键
反应规律
结构分析
性质预测
实验验证
发现问题
解决问题
类比归纳
决定
比较
决定
个别到一般
证据推理与模型认知
科学探究与创新意识
科学态度与社会责任
小结:
工业实际问题
宏观辨识与微观探析
1.通过拼插并对比乙烯、乙炔分子模型,加深对乙炔结构特点的认识,为分析和预测乙炔的性质奠定基础。
2.通过实验探究乙炔的主要化学性质,初步形成基于官能团、化学键特点和反应规律分析预测有机物性质的认知模型。
3.通过对乙炔结构、性质和用途的认识以及对炔烃化学性质的分析,强化“结构决定性质、性质决定用途”的化学观念。
4.通过对“工业上脱除乙烯中的乙炔”问题的分析和解决,让学生感受化学科技进步给社会生产和生活带来的重要贡献,建立正确的化学价值观念。
【教学目标】
化学走进生活
工业乙烯的原料主要来源于石油产品裂解,但这样获得的乙烯中含有质量分数0.5%~2.0%的乙炔杂质,乙炔杂质会导致乙烯聚合反应催化剂中毒,为了防止这种现象出现,提高乙烯聚合产品质量,需要除去乙烯中少量的乙炔。
如何除去乙烯中的少量乙炔气体?
微观探析
主题一:炔烃的结构
以小组为单位,拼插乙烯、乙炔的分子结构模型,观察结构特点并展开讨论。
动手做一做
微观探析
主题一:炔烃的结构
概括归理1:乙炔结构
化学键角度:碳碳三键,不饱和烃,含有两个π键
分子结构角度:碳原子sp杂化,四原子共线,非极性分子
球棍模型
空间填充模型
结构分析
主题二:炔烃的性质
【驱动任务一】乙烯与乙炔均为不饱和烃。根据乙炔结构,类比乙烯,预测乙炔有哪些性质?
性质预测
???
主题二:炔烃的性质
CaC2+2H2O C2H2↑+Ca(OH)2
反应原理:
原料:饱和食盐水、电石(CaC2,含杂质CaS、Ca3P2等)
装置特点:
固体 +液体 气体
用CuSO4溶液除杂质气体H2S、PH3
收集方法:排水法。
乙炔的实验室制法(课本35页[探究])
主题二:炔烃的性质
【驱动任务二】实验探究
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
火焰明亮,有浓烟
主题二:炔烃的性质
【驱动任务三】深入探究
1.实验现象与你的预想是否相同?
2.如何解释这一现象?
浓度相同,气流速度相同
发现问题—解决问题
时间进行了快进处理
课本图片
现有认知水平: 乙炔中的--C≡C-键长比乙烯中的 C=C 的键长短,键能大,反应中不易断裂,速度慢。
结构决定性质
主题二:炔烃的性质
【学以致用】乙炔在催化剂,加热下可以与H2,HCl,H2O等发生反应,写出方程式。
【练习】丙炔(CH3—C CH )是乙炔的同系物,在催化剂、加热条件下与HCl发生加成反应,写出按物质的量1:1反应的方程式。
模型认知
炔烃:含有一个碳碳三键的烃。
乙炔: CH CH
类比归纳
主题二:炔烃的性质
【问题探究】丙炔与HCl按物质的量1:1的产物中以 为主,
请从化学键的极性的角度进行解释。
C—CH
CH3—
推电子基
H-Cl
δ+
δ-
δ+
δ-
|
H
δ+
|
Cl
δ-
CH3—C=CH2
|
Cl
CH3—C CH
模型认知
主题二:炔烃的性质
C—CH
CH3—
推电子基
H-Cl
δ+
δ-
δ+
δ-
|
H
δ+
|
Cl
δ-
异性相吸,正负结合
概括归理2:
炔烃类物质具有相同的官能团,性质相似。
炔类同系物的性质也因其具有不同烷基而具有一定的差异。
模型认知
【问题探究】丙炔与氯化氢的按物质的量1:1的产物中以 为主,
请从化学键的极性的角度进行解释。
CH3—C CH
CH3—C=CH2
|
Cl
主题二:炔烃的性质
【知识梳理】
名称 烯烃 炔烃
组成 通式 CnH2n(n≥2) CnH2n-2(n≥2)
不饱和度 1 2
官能团 碳碳双键 碳碳三键
结构 C原子杂化类型 sp2 sp
空间结构特点 6原子共面 4原子共线
性质 燃烧现象 火焰明亮,伴有黑烟 火焰明亮,伴有浓烟
与酸性高锰酸钾反应 褪色 褪色
含溴的四氯化碳溶液 褪色 褪色
是否与H2、HCl加成 是 是
是否发生加聚反应 是 是
主题三:炔烃的应用
乙炔的主要用途
(1)乙炔在氧气中燃烧时产生的氧炔焰(可达3000摄氏度)可用来切割或焊接金属。
(2)乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
nCH ≡ CH [ CH=CH ]n
催化剂
导电塑料——聚乙炔
(制导电高分子材料)
(3)
主题三:炔烃的应用
工业生产中如何除去乙烯中少量的乙炔?
3、据科技部官网2021年8月报道,中科院理化技术研究所研发团队提出了一种新型电催化乙炔还原反应策略,研究人员采用一种新的纳米催化材料,以水取代氢气,在室温下实现了乙烯气体中低浓度乙炔的选择性还原,各项指标均达到或超过了热催化乙炔加氢报道的最优值,这一研究成果发表在《自然·催化》杂志上。
2、使用特殊的催化剂可使乙炔与氢气的加成反应停留在第一步产物阶段,目前工业上脱除乙烯中的乙炔普遍采用的方法也正是这种热催化加氢技术。
C2H2 C2H4 C2H6
H2
1、物理方法:深冷法、溶剂吸收法、吸附法、……
主题三:炔烃的应用
阴极:C2H2→C2H4 阳极:H2O → O2
优点:1、乙炔还原和O2析出分别发生在两极,产物中不会混进O2;
2、省去了额外的氢气分离操作,降低了成本;
3、避免乙烯过度加氢生成乙烷;
4、原子利用率更高,能量利用率更高,符合绿色化学的指导思想;
5、…………
该成果是化学工作者的自豪,也是中华民族的自豪!
电催化乙炔还原反应
碳中和
双电极电化学乙炔还原流通池示意图
热催化:
C2H2 + H2 → C2H4
电催化:
C2H2 + H2O → C2H4 + O2
乙炔结构
乙炔性质
类别观
炔烃性质
烯炔对比
用途
官能团
化学键
反应规律
结构分析
性质预测
实验验证
发现问题
解决问题
类比归纳
决定
比较
决定
个别到一般
证据推理与模型认知
科学探究与创新意识
科学态度与社会责任
小结:
工业实际问题
宏观辨识与微观探析
