3.2硫的转化 课件(共19张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.2硫的转化 课件(共19张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-11 23:37:45 | ||
图片预览



文档简介
(共19张PPT)
第3章 第2节 硫的转化
第3课时 浓硫酸
鲁科版必修1
用毛笔蘸取某无色液体在白纸上写字,大家能看出我写的什么吗?这种液体是什么?
趣味实验
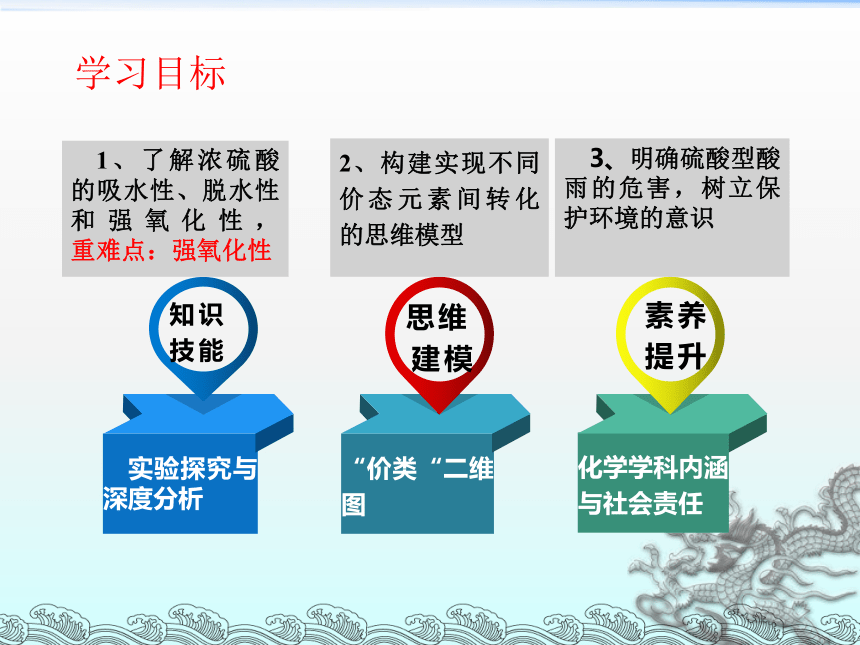
1、了解浓硫酸的吸水性、脱水性和强氧化性, 重难点:强氧化性
知识技能
2、构建实现不同价态元素间转化的思维模型
3、明确硫酸型酸雨的危害,树立保护环境的意识
思维
建模
素养提升
学习目标
浓硫酸为质量分数为98%的硫酸,无色无味、粘稠油状液体、与水任意比混合,密度1.84ɡ/cm3,难挥发
浓硫酸物理性质-宏观辨识
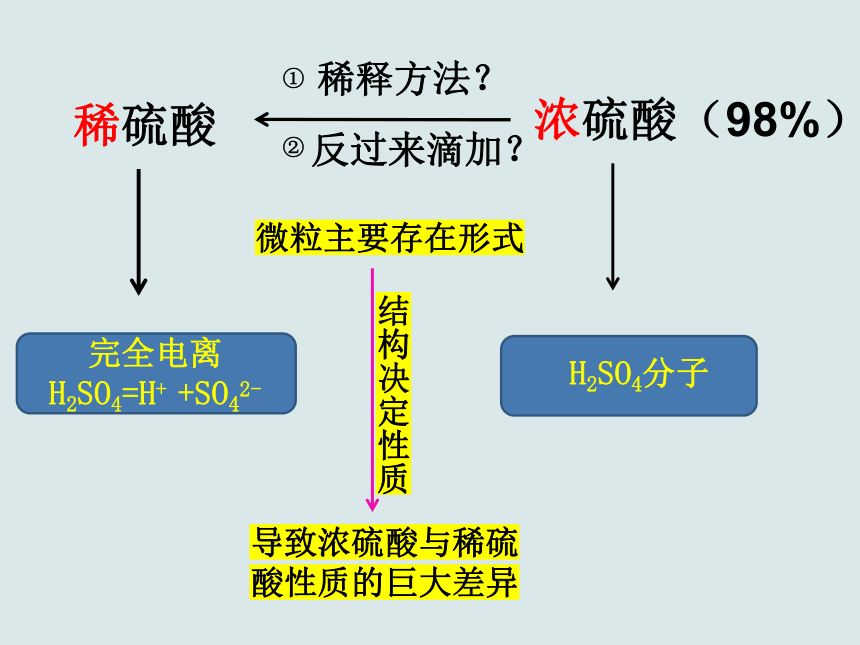
H2SO4分子
完全电离
H2SO4=H+ +SO42-
浓硫酸(98%)
稀释方法?
稀硫酸
①
②
反过来滴加?
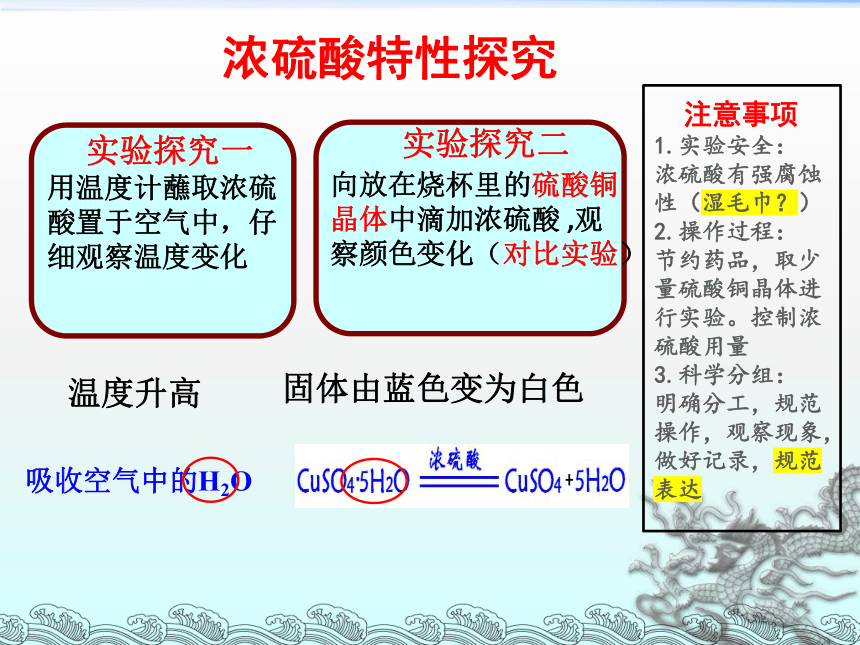
实验探究一
用温度计蘸取浓硫酸置于空气中,仔细观察温度变化
实验探究二
向放在烧杯里的硫酸铜晶体中滴加浓硫酸 ,观察颜色变化(对比实验)
固体由蓝色变为白色
温度升高
吸收空气中的H2O
浓硫酸特性探究
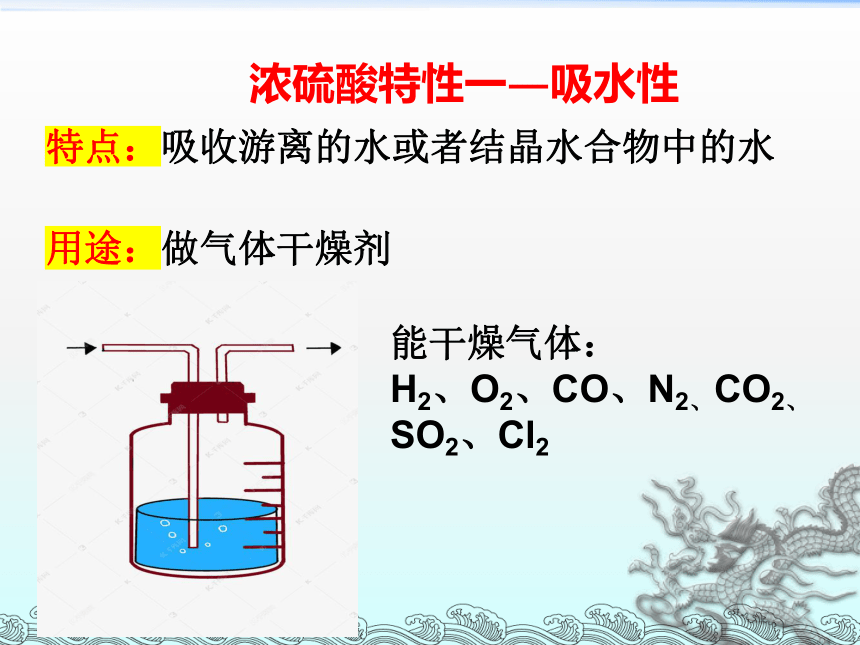
浓硫酸特性一—吸水性
能干燥气体:
H2、O2、CO、N2、CO2、SO2、Cl2
思考:
1.为什么无色的浓硫酸在白色的纸上写出了黑色的字?如果用稀硫酸写你能看到吗?
2.这体现了浓硫酸的什么特性?
浓硫酸
有机物
(含C、H、O 等)
将H、O按H2O组成比脱去
脱水
炭化
浓硫酸特性二—脱水性
浓硫酸不仅能碳化纸屑还能将蔗糖、棉花等有机化合物脱水碳化
浓硫酸具有强腐蚀性,不小心弄到皮肤上先用抹布拭去,
再用大量水冲洗,然后再涂3%-5%的碳酸氢钠溶液
吸水性与脱水性的区别
脱水性—浓硫酸将有机物中的氢、氧元素按水的比例脱去。
吸水性——吸水性是指物质中本身就存有H2O的组成,
浓硫酸直接与水分子结合
H2SO4 + nH2O → H2SO4 nH2O
小结
1、取一定量蔗糖置于200mL的烧杯。
2、加入少量蒸馏水,搅拌均匀。
3、再加入适量的浓硫酸,用玻璃棒搅拌。静置观察。
趣味实验
制作“黑面包”
【实验总结与反思1】
脱水性
吸水性
现象
性质
???
???
C12H22O11 12C+11H2O
浓H2SO4
原因
产生了气体
浓硫酸吸水放热
产生SO2
浓硫酸特性三——强氧化性
还原剂和氧化剂物质的量之比是多少?
0
+4
+6
还原剂
氧化剂
失4e-
×1
得2e-
×2
2
2
2
+4
CO2 ↑
H2O
(1)与非金属单质反应
+6
+4
+6
0
+2
还原剂
氧化剂
失2e-
×1
得2e-
×1
还原剂和氧化剂物质的量之比是多少?
钝 化
浓硫酸的特性:
我的收获
如:空气中的水分、物质中的湿存水、结晶水合物中的结晶水等,形成硫酸的水合物。
能将有机物中的氢、氧元素按水的组成脱去的性质。
加热
C+2H2SO4(浓)== CO2↑+2SO2 ↑+2H2O
加热
常温条件下,浓硫酸可使铁、铝钝化,可用铁制或铝制容器盛放冷浓硫酸
Cu+2H2SO4(浓)== SO2↑+CuSO4 +2H2O
(1)吸水性:
(3)强氧化性:
(2)脱水性
巩固练习
1. 下列关于浓硫酸的叙述正确的是( )
A. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
B. 浓硫酸具有吸水性,因而能使蔗糖炭化
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
D
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出
D.pH试纸变红
2.在如图实验装置中,从实验开始到过一段时间,对看到的现象叙述不正确的是( )
D
设计一套实验装置,验证碳和浓硫酸反应的产物。
第3章 第2节 硫的转化
第3课时 浓硫酸
鲁科版必修1
用毛笔蘸取某无色液体在白纸上写字,大家能看出我写的什么吗?这种液体是什么?
趣味实验
1、了解浓硫酸的吸水性、脱水性和强氧化性, 重难点:强氧化性
知识技能
2、构建实现不同价态元素间转化的思维模型
3、明确硫酸型酸雨的危害,树立保护环境的意识
思维
建模
素养提升
学习目标
浓硫酸为质量分数为98%的硫酸,无色无味、粘稠油状液体、与水任意比混合,密度1.84ɡ/cm3,难挥发
浓硫酸物理性质-宏观辨识
H2SO4分子
完全电离
H2SO4=H+ +SO42-
浓硫酸(98%)
稀释方法?
稀硫酸
①
②
反过来滴加?
实验探究一
用温度计蘸取浓硫酸置于空气中,仔细观察温度变化
实验探究二
向放在烧杯里的硫酸铜晶体中滴加浓硫酸 ,观察颜色变化(对比实验)
固体由蓝色变为白色
温度升高
吸收空气中的H2O
浓硫酸特性探究
浓硫酸特性一—吸水性
能干燥气体:
H2、O2、CO、N2、CO2、SO2、Cl2
思考:
1.为什么无色的浓硫酸在白色的纸上写出了黑色的字?如果用稀硫酸写你能看到吗?
2.这体现了浓硫酸的什么特性?
浓硫酸
有机物
(含C、H、O 等)
将H、O按H2O组成比脱去
脱水
炭化
浓硫酸特性二—脱水性
浓硫酸不仅能碳化纸屑还能将蔗糖、棉花等有机化合物脱水碳化
浓硫酸具有强腐蚀性,不小心弄到皮肤上先用抹布拭去,
再用大量水冲洗,然后再涂3%-5%的碳酸氢钠溶液
吸水性与脱水性的区别
脱水性—浓硫酸将有机物中的氢、氧元素按水的比例脱去。
吸水性——吸水性是指物质中本身就存有H2O的组成,
浓硫酸直接与水分子结合
H2SO4 + nH2O → H2SO4 nH2O
小结
1、取一定量蔗糖置于200mL的烧杯。
2、加入少量蒸馏水,搅拌均匀。
3、再加入适量的浓硫酸,用玻璃棒搅拌。静置观察。
趣味实验
制作“黑面包”
【实验总结与反思1】
脱水性
吸水性
现象
性质
???
???
C12H22O11 12C+11H2O
浓H2SO4
原因
产生了气体
浓硫酸吸水放热
产生SO2
浓硫酸特性三——强氧化性
还原剂和氧化剂物质的量之比是多少?
0
+4
+6
还原剂
氧化剂
失4e-
×1
得2e-
×2
2
2
2
+4
CO2 ↑
H2O
(1)与非金属单质反应
+6
+4
+6
0
+2
还原剂
氧化剂
失2e-
×1
得2e-
×1
还原剂和氧化剂物质的量之比是多少?
钝 化
浓硫酸的特性:
我的收获
如:空气中的水分、物质中的湿存水、结晶水合物中的结晶水等,形成硫酸的水合物。
能将有机物中的氢、氧元素按水的组成脱去的性质。
加热
C+2H2SO4(浓)== CO2↑+2SO2 ↑+2H2O
加热
常温条件下,浓硫酸可使铁、铝钝化,可用铁制或铝制容器盛放冷浓硫酸
Cu+2H2SO4(浓)== SO2↑+CuSO4 +2H2O
(1)吸水性:
(3)强氧化性:
(2)脱水性
巩固练习
1. 下列关于浓硫酸的叙述正确的是( )
A. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
B. 浓硫酸具有吸水性,因而能使蔗糖炭化
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
D
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出
D.pH试纸变红
2.在如图实验装置中,从实验开始到过一段时间,对看到的现象叙述不正确的是( )
D
设计一套实验装置,验证碳和浓硫酸反应的产物。
