1.1.1 反应热与焓变 课件(共56张PPT) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1 反应热与焓变 课件(共56张PPT) 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-12 13:38:01 | ||
图片预览










文档简介
(共56张PPT)
反应热
反应热与焓变
01
热化学方程式
02
燃烧热
03
一、反应热与焓变
庆典时的烟火
钢铁的炼制
火苗
一、反应热与焓变
1、反应热
等温条件下,化学反应体系向环境释放或从环境吸收的热量称为该反应在此温度下的热效应,简称反应热,用Q表示。
单位:J·mol-1或kJ·mol-1
3、焓
(1)定义:描述物质所具有的能量的物理量,符号H
(1)定义:反应产物的总焓与反应物的总焓之差,
符号:ΔH
(2)单位:kJ·mol-1
(2)意义:相同物质的量的不同物质所具有的能量不同,
其焓也不同
4、焓变
H = H(产物)- H(反应物)
5、反应热 与焓变的关系
反应热 — Q 焓变 — H
含义
相互 关系 化学反应过程中,当反应物和生成物具有相同的温度时,所吸收或放出的热量
化学反应中生成物所具有的焓与反应物所具有的焓之差
等压条件下,如果反应物中物质的能量全部转化为热能
则焓变等于该反应的反应热,即ΔH = Qp
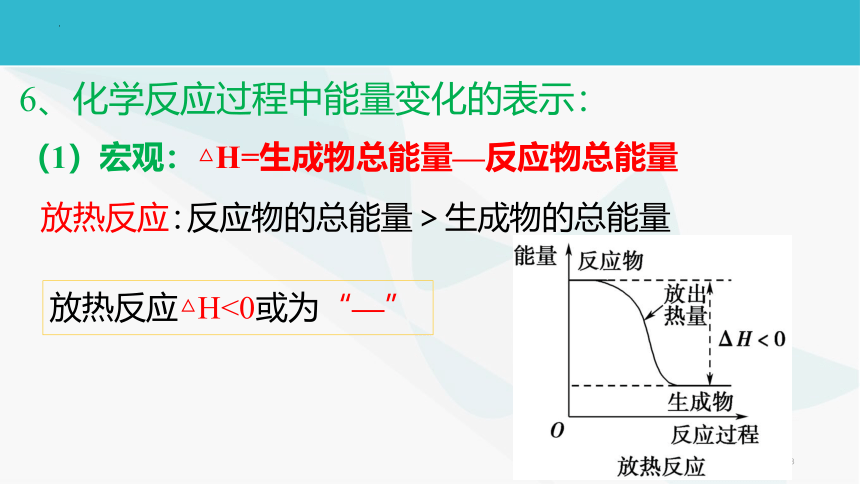
6、化学反应过程中能量变化的表示:(1)宏观:△H=生成物总能量—反应物总能量反应物的总能量>生成物的总能量放热反应:放热反应△H<0或为“—”补充:常见的放热反应
中和反应
燃烧反应
活泼金属与酸反应
大多数化合反应
铝热反应
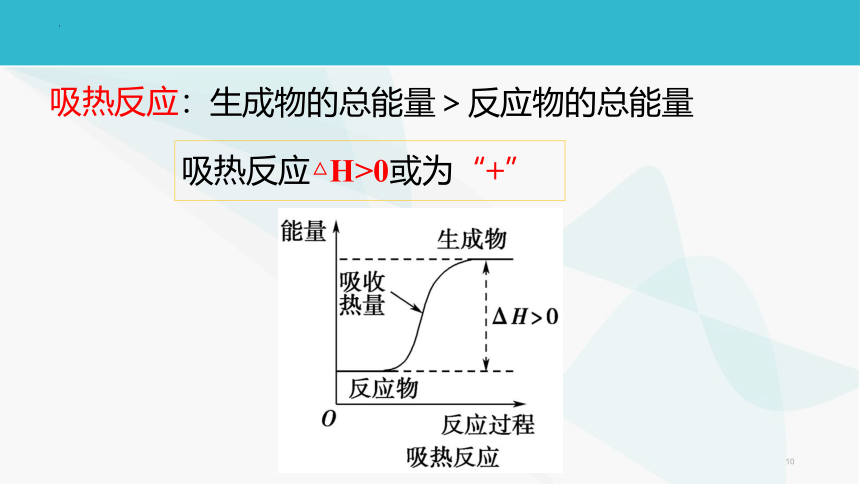
生成物的总能量>反应物的总能量吸热反应:吸热反应△H>0或为“+”补充:常见的吸热反应
大多数分解反应
某些金属氧化物的还原反应
C+CO2 C+H2O
Ba(OH)2·8H2O+NH4Cl
(2)微观:从化学键的角度理解反应与能量变化的关系以1 mol H2(g)和1 mol Cl2(g)反应生成2 mol HCl(g)的能量转化为例△H=(键能)反应物-(键能)生成物△H=-183kJ/mol1、1molC与1mol水蒸气反应生成1mol CO和1mol H2,需要吸收131.5kJ的热量,其反应热如何表示?
ΔH = +131.5kJ/mol
2、拆开 lmol H—H键、lmol N—H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为___________,1mol H2生成NH3的反应热为 。
-92kJ/mol
-30.7kJ/mol
练习
7、△H与Q的比较区分
△H的符号、数值、单位是一个整体,比较大小时要带正负号比较。
Q表示的是吸收或放出的热量,比大小时要取绝对值,即去掉正负号比较。
2H2(g)+O2(g)=2H2O(g),△H1=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(l),△H2=-Q2kJ/mol
Q2 > Q1
△H1 > △H2
比较下列两个反应的焓变与能量变化大小。
练习
小 结
反应热、焓变
从物质能量角度看:
ΔH=生成物总能量-反应物总能量
从键能角度看:
ΔH=反应物总键能-生成物总键能
放热反应:
吸热反应:
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
物质稳定性的判断:能量越低、键能越大越稳定
1、下列变化过程中会放出热量的是( )
①硝酸铵溶于水 ②物质的燃烧 ③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③ C.仅②④ D.②③④
D
练习
2、下列变化中,属于放热反应的是 ( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化钠溶于水
B
3、下列叙述正确的是( )
A. 化学反应一定伴随热量的变化
B. 凡是吸热或放热过程中热量的变化均称为反应热
C. 若△H<0,则反应物的能量高于生成物的能量
D. △H>0,则反应物的能量高于生成物的能量
C
AD
4、已知:H + H ═ H2;△H=-436KJ/mol,则下列叙述正确的是( )双选
A.2个H原子的能量高于1个H2的能量
B.2个H原子的能量低于1个H2的能量
C. H原子比H2分子稳定
D.H2分子比H原子稳定
1、定义:酸和碱的稀溶液发生中和反应,生成1mol水时的反应热叫做中和热。
2、中和热的表示:
二、中和热
H+(aq) + OH-(aq) = H2O (l) △H = -57.3kJ/mol
例:当1L 1mol/L的稀盐酸跟1L 1 mol/L的NaOH溶液起中和反应时中和热。
NaOH(aq)+HCI(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子
Ⅱ、反应物: 酸与碱。中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热之内。
Ⅳ、强酸强碱放出的热量:57.3kJ/mol
3、注意:
1、下列关于中和热的说法正确的是( )
A.10 L 0.05 mol L-1Ba(OH)2溶液与20 L 0.05 mol L-1 HNO3反应时的反应热是中和热
B.1 mol HCl气体通入1 L 0.01 mol L-1 NaOH溶液中反应时的反应热是中和热
C.1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热
D.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
练习
A
2、强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l),△H = -57.3kJ/mol
①HCl(aq)+NH3 H2O(aq)= NH4Cl(aq)+H2O(l)△H=-akJ/mol
②HCl(aq)+NaOH(s)= NaCl(aq)+H2O(l),△H=-bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l),△H=-c kJ/mol
则a,b,c三者的大小关系判断错误的是( )
A.c>114.6 B.a<57.3 C.b>57.3 D.2a=2b=c
D
2、数值:稀溶液中,强酸和强碱中和时
△H= -57.3kJ/mol
1、计算原理: △H = -mc△t/n
m:反应溶液的质量
c:比热容
三、实验:中和热测定
3、实验装置
(4)把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确量取混合溶液的最高温度,记为终止温度,记录。
(1)先连好实验装置;
(2)取50mL 0.5mol/L盐酸, 倒入 小烧杯中,并用温度计测量盐酸的温度,记录。 把温度计上的酸用水冲洗干净。
(3)另一个量筒量取50mL 0.55mol/L氢氧化钠,并用温度计测量氢氧化钠的温度,记录。
(5)重复实验步骤2-3次
4、实验步骤
(1)氢氧化钠浓度要稍大于盐酸浓度;
(2)操作动作要快,隔热及保温效果要良好;
(3)温度计完全浸入溶液中,且稳定后读数;
(4)要用强酸、强碱稀溶液;
(5)多次测量、取平均值;
5、实验注意事项
1、下列关于中和热测定实验中的叙述不正确的是( )
A.应用环形玻璃搅拌棒轻轻搅动混合液
B.实验中应使用相同浓度和体积的氢氧化钠溶液和盐酸溶液
C.实验中两个大小不同的烧杯间要填满碎纸条,目的是减少实验过程中热量的损失
D.用相同体积的浓硫酸代替盐酸溶液进行实验,测得中和热的数值比理论值偏高
B
练习
3、关于中和热测定实验的下列说法不正确的是( )
A.使用环形玻璃棒既可以搅拌又避免损坏温度计
B.测了酸后的温度计要用水清洗后再测碱的温度
C.向盛装酸的烧杯中加碱时要小心缓慢以免洒出
D.改变酸碱的用量,所求中和热数值不变
C
二、热化学方程式的书写
热化学方程式的书写
1、概念:表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
H2(g)+I2(g) 2HI(g) △H= -14.9kJ/mol
200℃
101kPa
(1)化学方程的右边必须写上△H,并用“空格”隔开,
△H:吸“+”,放“-”;单位是kJ/mol或J/mol
(2)热化学方程式需注明反应时的温度和压强。
对于 25℃,101kPa时进行的反应可不注明。
2、书写热化学方程式的注意事项
(3)热化学方程式需注明各物质的状态(s、l、g、aq)
(4)热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。
H2(g)+ O2(g) = H2O(g) △H=-241.8kJ/mol
1
2
H2(g)+I2(g) 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
2H2(g)+2I2(g) 4HI(g) △H=-29.8kJ/mol
200℃
101kPa
(5)根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变。
H2(g)+ O2(g) = H2O(g) △H=-241.8kJ/mol
1
2
H2O(g) = H2(g)+ O2(g) △H= + 241.8kJ/mol
1
2
※ 注意: /mol的含义:表示每mol反应
(6)可逆反应的反应热是反应物完全反应后放出或吸收的热量,不是达到平衡时的
2SO2 (g)+ O2 2SO3(g)△H=-197kJ/mol
可逆反应中反应物不能完全反应,反应物反应后实际放出或吸收的热量小于理论值
1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。
练习
H2(g)+Cl2(g)=2HCl(g) H =-184.6kJ/mol
2、写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol
(2)0.5molCu(固态) 与适量O2(气态) 反应,生成CuO(固态),放出78.5 kJ的热量
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ/mol
3、已知在1×101Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O (l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g)ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1
A
三、焓变(△H)比较的方法
1、△H比较说明:
(1)符号:比较△H的大小需要考虑正负号。
(2)物质的三态能量关系:
(3)完全燃烧与不完全燃烧比较:
g l s
对放热反应,放热越多,△H越小;
对吸热反应,吸热越多,△H越大;
完全燃烧放出热量的数值大于不完全燃烧
(1)列公式,作差值
(2)找不同,比大小
3、“公式法”比较焓变
1、下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g) = CO2(g) △H1 C(s)+O2(g) = CO(g) △H2
②S(s)+O2(g) = SO2(g) △H3 S(g)+O2(g) = SO2(g) △H4
③H2(g)+ 1/2O2(g) = H2O(l) △H5 2H2(g)+O2(g) = 2H2O(l) △H6
④CaCO3(s) = CaO(s)+CO2(g) △H7 CaO(s)+H2O(l) = Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
练习
C
2、金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)等量金刚石和石墨完全燃烧______(填“金刚石”和“石墨”)放出热量更多.
(2)在通常状况下,金刚石和石墨______(填“金刚石”和“石墨”)更稳定.
(3)12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为___________.
金刚石
石墨
252kJ
3、已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量.其他相关数据如下表:
O=O(g) H—H(g) H—O(g)
1 mol化学键断裂时需要吸收的能量/kJ 496 x 463
则表中x为( )
A.920 B.557 C.436 D.188
C
三、燃烧热
燃烧热
1、定义:
在101kPa时,1mol纯物质在氧气中完全燃烧生成指定的化合物时所放出的热量。
“指定压强”
“1mol”
限定燃料的物质的量
“指定的化合物”
C → CO2 (g)
S → SO2 (g)
H → H2O(l)
“完全燃烧”
生成物不能继续燃烧
101kPa
注意:
N → N2 (g)
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036 kJ/mol
①C8H18的燃烧热是多少
△H=-5518 kJ/mol
②1mol C8H18燃烧时放出了多少热量
5518 kJ
思考:
2、表示的意义:
如: CH4的燃烧热为890.3kJ/mol。
含义:在101kPa时,1molCH4完全燃烧时,放出890.3kJ的热量
3、表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数
(常出现分数)
4、一定量可燃物完全燃烧时放出的热量
Q放 = n(可燃物) ×|△H|
名称 化学式 ΔH/kJ·mol-1 名称 化学式 ΔH/kJ·mol-1
石墨 C(s) -393.5 乙烷 C2H6(g) -1559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3267.5
5、一些物质燃烧热
练习
1、在 101 kPa时,2mol CH4 完全燃烧生成CO2和液态H2O,放出 1780 kJ的热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1 = 44.6mol
44.6 molCH4 完全燃烧放出的热量为:
44.6 mol×890 kJ/mol=3.97×104kJ
2、1.5g乙醇完全燃烧生成CO2和液态H2O,放出热量44.5kJ,则乙醇的燃烧热为( )
A.44.5kJ/mol B.1364.7kJ/mol
C.2729.3kJ/mol D.89.0kJ/mol
B
★总结:燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化 放热反应 ΔH ΔH<0 ,单位 kJ/mol 不 同 点 反应物的量 1mol可燃物 可能是1mol也可以是0.5mol(不限)
生成物的量 不限量 1mol H2O
反应热 的含义 1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同 酸碱中和生成1molH2O时放出的热量,强酸强碱反应的中和热大致相同,均约为57.3kJ/mol
谢谢
反应热
反应热与焓变
01
热化学方程式
02
燃烧热
03
一、反应热与焓变
庆典时的烟火
钢铁的炼制
火苗
一、反应热与焓变
1、反应热
等温条件下,化学反应体系向环境释放或从环境吸收的热量称为该反应在此温度下的热效应,简称反应热,用Q表示。
单位:J·mol-1或kJ·mol-1
3、焓
(1)定义:描述物质所具有的能量的物理量,符号H
(1)定义:反应产物的总焓与反应物的总焓之差,
符号:ΔH
(2)单位:kJ·mol-1
(2)意义:相同物质的量的不同物质所具有的能量不同,
其焓也不同
4、焓变
H = H(产物)- H(反应物)
5、反应热 与焓变的关系
反应热 — Q 焓变 — H
含义
相互 关系 化学反应过程中,当反应物和生成物具有相同的温度时,所吸收或放出的热量
化学反应中生成物所具有的焓与反应物所具有的焓之差
等压条件下,如果反应物中物质的能量全部转化为热能
则焓变等于该反应的反应热,即ΔH = Qp
6、化学反应过程中能量变化的表示:(1)宏观:△H=生成物总能量—反应物总能量反应物的总能量>生成物的总能量放热反应:放热反应△H<0或为“—”补充:常见的放热反应
中和反应
燃烧反应
活泼金属与酸反应
大多数化合反应
铝热反应
生成物的总能量>反应物的总能量吸热反应:吸热反应△H>0或为“+”补充:常见的吸热反应
大多数分解反应
某些金属氧化物的还原反应
C+CO2 C+H2O
Ba(OH)2·8H2O+NH4Cl
(2)微观:从化学键的角度理解反应与能量变化的关系以1 mol H2(g)和1 mol Cl2(g)反应生成2 mol HCl(g)的能量转化为例△H=(键能)反应物-(键能)生成物△H=-183kJ/mol1、1molC与1mol水蒸气反应生成1mol CO和1mol H2,需要吸收131.5kJ的热量,其反应热如何表示?
ΔH = +131.5kJ/mol
2、拆开 lmol H—H键、lmol N—H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1mol N2生成NH3的反应热为___________,1mol H2生成NH3的反应热为 。
-92kJ/mol
-30.7kJ/mol
练习
7、△H与Q的比较区分
△H的符号、数值、单位是一个整体,比较大小时要带正负号比较。
Q表示的是吸收或放出的热量,比大小时要取绝对值,即去掉正负号比较。
2H2(g)+O2(g)=2H2O(g),△H1=-Q1kJ/mol
2H2(g)+O2(g)=2H2O(l),△H2=-Q2kJ/mol
Q2 > Q1
△H1 > △H2
比较下列两个反应的焓变与能量变化大小。
练习
小 结
反应热、焓变
从物质能量角度看:
ΔH=生成物总能量-反应物总能量
从键能角度看:
ΔH=反应物总键能-生成物总键能
放热反应:
吸热反应:
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
物质稳定性的判断:能量越低、键能越大越稳定
1、下列变化过程中会放出热量的是( )
①硝酸铵溶于水 ②物质的燃烧 ③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③ C.仅②④ D.②③④
D
练习
2、下列变化中,属于放热反应的是 ( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化钠溶于水
B
3、下列叙述正确的是( )
A. 化学反应一定伴随热量的变化
B. 凡是吸热或放热过程中热量的变化均称为反应热
C. 若△H<0,则反应物的能量高于生成物的能量
D. △H>0,则反应物的能量高于生成物的能量
C
AD
4、已知:H + H ═ H2;△H=-436KJ/mol,则下列叙述正确的是( )双选
A.2个H原子的能量高于1个H2的能量
B.2个H原子的能量低于1个H2的能量
C. H原子比H2分子稳定
D.H2分子比H原子稳定
1、定义:酸和碱的稀溶液发生中和反应,生成1mol水时的反应热叫做中和热。
2、中和热的表示:
二、中和热
H+(aq) + OH-(aq) = H2O (l) △H = -57.3kJ/mol
例:当1L 1mol/L的稀盐酸跟1L 1 mol/L的NaOH溶液起中和反应时中和热。
NaOH(aq)+HCI(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol
Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子
Ⅱ、反应物: 酸与碱。中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热之内。
Ⅳ、强酸强碱放出的热量:57.3kJ/mol
3、注意:
1、下列关于中和热的说法正确的是( )
A.10 L 0.05 mol L-1Ba(OH)2溶液与20 L 0.05 mol L-1 HNO3反应时的反应热是中和热
B.1 mol HCl气体通入1 L 0.01 mol L-1 NaOH溶液中反应时的反应热是中和热
C.1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热
D.只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
练习
A
2、强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l),△H = -57.3kJ/mol
①HCl(aq)+NH3 H2O(aq)= NH4Cl(aq)+H2O(l)△H=-akJ/mol
②HCl(aq)+NaOH(s)= NaCl(aq)+H2O(l),△H=-bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l),△H=-c kJ/mol
则a,b,c三者的大小关系判断错误的是( )
A.c>114.6 B.a<57.3 C.b>57.3 D.2a=2b=c
D
2、数值:稀溶液中,强酸和强碱中和时
△H= -57.3kJ/mol
1、计算原理: △H = -mc△t/n
m:反应溶液的质量
c:比热容
三、实验:中和热测定
3、实验装置
(4)把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒在外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确量取混合溶液的最高温度,记为终止温度,记录。
(1)先连好实验装置;
(2)取50mL 0.5mol/L盐酸, 倒入 小烧杯中,并用温度计测量盐酸的温度,记录。 把温度计上的酸用水冲洗干净。
(3)另一个量筒量取50mL 0.55mol/L氢氧化钠,并用温度计测量氢氧化钠的温度,记录。
(5)重复实验步骤2-3次
4、实验步骤
(1)氢氧化钠浓度要稍大于盐酸浓度;
(2)操作动作要快,隔热及保温效果要良好;
(3)温度计完全浸入溶液中,且稳定后读数;
(4)要用强酸、强碱稀溶液;
(5)多次测量、取平均值;
5、实验注意事项
1、下列关于中和热测定实验中的叙述不正确的是( )
A.应用环形玻璃搅拌棒轻轻搅动混合液
B.实验中应使用相同浓度和体积的氢氧化钠溶液和盐酸溶液
C.实验中两个大小不同的烧杯间要填满碎纸条,目的是减少实验过程中热量的损失
D.用相同体积的浓硫酸代替盐酸溶液进行实验,测得中和热的数值比理论值偏高
B
练习
3、关于中和热测定实验的下列说法不正确的是( )
A.使用环形玻璃棒既可以搅拌又避免损坏温度计
B.测了酸后的温度计要用水清洗后再测碱的温度
C.向盛装酸的烧杯中加碱时要小心缓慢以免洒出
D.改变酸碱的用量,所求中和热数值不变
C
二、热化学方程式的书写
热化学方程式的书写
1、概念:表示参加反应物质的量和反应热的关系的化学方程式,叫做热化学方程式。
H2(g)+I2(g) 2HI(g) △H= -14.9kJ/mol
200℃
101kPa
(1)化学方程的右边必须写上△H,并用“空格”隔开,
△H:吸“+”,放“-”;单位是kJ/mol或J/mol
(2)热化学方程式需注明反应时的温度和压强。
对于 25℃,101kPa时进行的反应可不注明。
2、书写热化学方程式的注意事项
(3)热化学方程式需注明各物质的状态(s、l、g、aq)
(4)热化学方程式中化学计量数表示参加反应的各物质的物质的量,可为整数或分数。
H2(g)+ O2(g) = H2O(g) △H=-241.8kJ/mol
1
2
H2(g)+I2(g) 2HI(g) △H=-14.9kJ/mol
200℃
101kPa
2H2(g)+2I2(g) 4HI(g) △H=-29.8kJ/mol
200℃
101kPa
(5)根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变。
H2(g)+ O2(g) = H2O(g) △H=-241.8kJ/mol
1
2
H2O(g) = H2(g)+ O2(g) △H= + 241.8kJ/mol
1
2
※ 注意: /mol的含义:表示每mol反应
(6)可逆反应的反应热是反应物完全反应后放出或吸收的热量,不是达到平衡时的
2SO2 (g)+ O2 2SO3(g)△H=-197kJ/mol
可逆反应中反应物不能完全反应,反应物反应后实际放出或吸收的热量小于理论值
1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。
练习
H2(g)+Cl2(g)=2HCl(g) H =-184.6kJ/mol
2、写出下列反应的热化学方程式
(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3kJ的热量
C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol
(2)0.5molCu(固态) 与适量O2(气态) 反应,生成CuO(固态),放出78.5 kJ的热量
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ/mol
3、已知在1×101Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O (l) ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g)ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g)ΔH=+484kJ·mol-1
A
三、焓变(△H)比较的方法
1、△H比较说明:
(1)符号:比较△H的大小需要考虑正负号。
(2)物质的三态能量关系:
(3)完全燃烧与不完全燃烧比较:
g l s
对放热反应,放热越多,△H越小;
对吸热反应,吸热越多,△H越大;
完全燃烧放出热量的数值大于不完全燃烧
(1)列公式,作差值
(2)找不同,比大小
3、“公式法”比较焓变
1、下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g) = CO2(g) △H1 C(s)+O2(g) = CO(g) △H2
②S(s)+O2(g) = SO2(g) △H3 S(g)+O2(g) = SO2(g) △H4
③H2(g)+ 1/2O2(g) = H2O(l) △H5 2H2(g)+O2(g) = 2H2O(l) △H6
④CaCO3(s) = CaO(s)+CO2(g) △H7 CaO(s)+H2O(l) = Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
练习
C
2、金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.
(1)等量金刚石和石墨完全燃烧______(填“金刚石”和“石墨”)放出热量更多.
(2)在通常状况下,金刚石和石墨______(填“金刚石”和“石墨”)更稳定.
(3)12g石墨在一定量空气中燃烧,生成气体36g,该过程放出的热量为___________.
金刚石
石墨
252kJ
3、已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44 kJ的热量.其他相关数据如下表:
O=O(g) H—H(g) H—O(g)
1 mol化学键断裂时需要吸收的能量/kJ 496 x 463
则表中x为( )
A.920 B.557 C.436 D.188
C
三、燃烧热
燃烧热
1、定义:
在101kPa时,1mol纯物质在氧气中完全燃烧生成指定的化合物时所放出的热量。
“指定压强”
“1mol”
限定燃料的物质的量
“指定的化合物”
C → CO2 (g)
S → SO2 (g)
H → H2O(l)
“完全燃烧”
生成物不能继续燃烧
101kPa
注意:
N → N2 (g)
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036 kJ/mol
①C8H18的燃烧热是多少
△H=-5518 kJ/mol
②1mol C8H18燃烧时放出了多少热量
5518 kJ
思考:
2、表示的意义:
如: CH4的燃烧热为890.3kJ/mol。
含义:在101kPa时,1molCH4完全燃烧时,放出890.3kJ的热量
3、表示燃烧热的热化学方程式的书写:
应以1mol物质的标准来配平其余物质的化学计量数
(常出现分数)
4、一定量可燃物完全燃烧时放出的热量
Q放 = n(可燃物) ×|△H|
名称 化学式 ΔH/kJ·mol-1 名称 化学式 ΔH/kJ·mol-1
石墨 C(s) -393.5 乙烷 C2H6(g) -1559.8
金刚石 C(s) -395.0 乙烯 C2H4(g) -1411.0
氢气 H2(g) -285.8 乙炔 C2H2(g) -1299.6
一氧化碳 CO(g) -283.0 乙醇 C2H5OH(l) -1366.8
甲烷 CH4(g) -890.31 丙烷 C3H8(g) -2219.9
甲醇 CH3OH(l) -726.51 苯 C6H6(l) -3267.5
5、一些物质燃烧热
练习
1、在 101 kPa时,2mol CH4 完全燃烧生成CO2和液态H2O,放出 1780 kJ的热量,CH4 的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
CH4(g)+2O2(g)= CO2(g)+ 2H2O(l) ΔH=-890 kJ/mol
n(CH4)=V(CH4)/Vm=1000L/22.4L·mol-1 = 44.6mol
44.6 molCH4 完全燃烧放出的热量为:
44.6 mol×890 kJ/mol=3.97×104kJ
2、1.5g乙醇完全燃烧生成CO2和液态H2O,放出热量44.5kJ,则乙醇的燃烧热为( )
A.44.5kJ/mol B.1364.7kJ/mol
C.2729.3kJ/mol D.89.0kJ/mol
B
★总结:燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化 放热反应 ΔH ΔH<0 ,单位 kJ/mol 不 同 点 反应物的量 1mol可燃物 可能是1mol也可以是0.5mol(不限)
生成物的量 不限量 1mol H2O
反应热 的含义 1mol反应物完全燃烧时放出的热量;不同的物质燃烧热不同 酸碱中和生成1molH2O时放出的热量,强酸强碱反应的中和热大致相同,均约为57.3kJ/mol
谢谢
