3.1.2铁的氧化物 预学案 高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.2铁的氧化物 预学案 高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 162.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-13 10:22:03 | ||
图片预览


文档简介
铁的氧化物
预习案
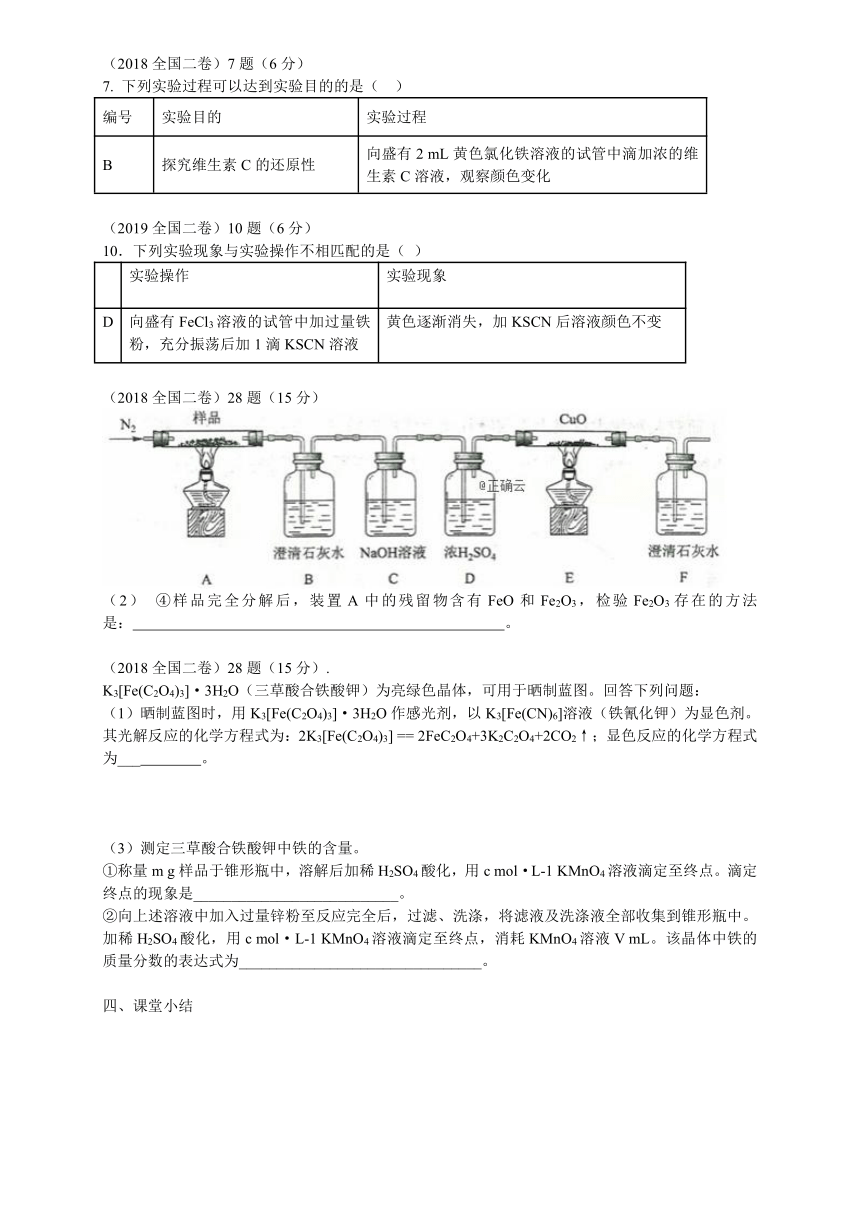
1、结合前面所学,总结Fe3+和Fe2+的检验方法。
Fe2+ Fe3+
方法一:观察颜色 浅绿色 棕黄色
方法二:
方法三:
方法四:
方法五:
2、写出Fe2(SO4)3和KSCN溶液反应的化学方程式
3、写出FeSO4和K3[Fe(CN)6]溶液反应的化学方程式
4、写出Fe3O4和H2SO4溶液反应的离子方程式
铁的重要化合物
学案
一、Fe3O4中Fe3+与Fe2+的检验
Fe3O4中铁的化合价为正几价?
探究活动一:怎样检验Fe3O4粉末与硫酸的反应液中有Fe3+和Fe2+?
二、Fe2+与Fe3+的相互转化
活动探究二:能否将反应液中的Fe3+全部转化成Fe2+使溶液变得更纯净?
1、Fe3+转化成Fe2+发生的是氧化还是还原反应?
2、加入氧化剂还是还原剂?你想到了哪些还原剂?
3、加入什么试剂证明Fe3+完全转化成Fe2+?
4、加入试剂的顺序?
探究活动三:设计实验将反应液中的Fe2+全部转化成Fe3+,使溶液变得更纯净,提供的试剂任选。
试剂:Fe、新制氯水、H2O2 、KMnO4、K3[Fe(CN)6]溶液
实验方案:
知识小结:总结Fe2+与Fe3+转化的规律
三、学以致用挑战高考
(2019全国一卷)
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
(2018全国二卷)7题(6分)
7. 下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程
B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
(2019全国二卷)10题(6分)
10.下列实验现象与实验操作不相匹配的是( )
实验操作 实验现象
D 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变
(2018全国二卷)28题(15分)
(2) ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
(2018全国二卷)28题(15分).
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液(铁氰化钾)为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3] == 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
四、课堂小结
五、课后练习
1、下列说法不正确的是( )
A、Fe3O4为磁性氧化铁,其中铁元素的化合价为+2和+3
B、FeO、Fe2O3均为碱性氧化物,均可以和盐酸反应
C、Fe(OH)2不稳定,在空气中易被氧化成Fe(OH)3
D、Fe(OH)3为红褐色的溶液
2、下列离子检验方法合理的是( )
A、向某溶液中滴入KSCN溶液,溶液呈红色,说明原溶液中不含有Fe2+
B、向某溶液中通入氯气,然后再加入KSCN溶液,溶液变红色,说明原溶液中含有Fe2+
C、向某溶液中加入氢氧化钠溶液,得到红褐色沉淀,说明原溶液中含有Fe3+
D、向某溶液中加入氢氧化钠溶液,得到白色沉淀,又观察到颜色变为灰绿色最后变成红褐色,说明该溶液中只含Fe2+,不含有Mg2+。
3、在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁 B.该反应是化合反应
C.该反应是氧化还原反应 D.氢氧化亚铁作氧化剂
4、按如图所示装置,用两种不同操作分别进行实验,观察B管中的现象。(注:操作过程中不考虑稀H2SO4与NaOH溶液的作用)
(1)操作Ⅰ:先夹紧止水夹a,使A管开始反应,实验中B管观察到的现象是__________
________________________。B管发生反应的化学方程式是____________________________。
(2)操作Ⅱ:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管观察到的现象是______________________________。B管中发生反应的离子方程式是__________________________。
答案
预习案
1、结合前面所学,总结Fe3+和Fe2+的检验方法
2、写出Fe2(SO4)3和KSCN溶液反应的化学方程式
Fe2(SO4)3+3KSCN== Fe(SCN)3+ K2SO4
3、写出FeSO4和K3[Fe(CN)6]溶液反应的化学方程式
FeSO4+ K3[Fe(CN)6]== Fe[Fe(CN)6] 2 + K2SO4
4、写出Fe3O4和H2SO4溶液反应的离子方程式
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
学案
三、学以致用挑战高考
(2019全国一卷)
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
(2018全国二卷)7题(6分)
7. 下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程
B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
(2019全国二卷)10题(6分)
10.下列实验现象与实验操作不相匹配的是( )
实验操作 实验现象
D 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变
(2018全国二卷)28题(15分)
(2) ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
答案:取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3
(2018全国二卷)28题(15分).
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液(铁氰化钾)为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3] == 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
答案:3FeC2O4+2K3[Fe(CN)6] Fe3[Fe(CN)6]2 +3K2C2O4
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
五、课后练习
1、D 2、C
3、C
4、(1)有白色絮状沉淀产生,速速变成灰绿色,最后变成红褐色。
FeSO4+2NaOH=Fe(OH)2↓+ Na2SO4
4Fe(OH)2+2H2O+O2=4Fe(OH)3
(2) 有白色絮状沉淀产生 Fe2++2OH-=Fe(OH)2↓
预习案
1、结合前面所学,总结Fe3+和Fe2+的检验方法。
Fe2+ Fe3+
方法一:观察颜色 浅绿色 棕黄色
方法二:
方法三:
方法四:
方法五:
2、写出Fe2(SO4)3和KSCN溶液反应的化学方程式
3、写出FeSO4和K3[Fe(CN)6]溶液反应的化学方程式
4、写出Fe3O4和H2SO4溶液反应的离子方程式
铁的重要化合物
学案
一、Fe3O4中Fe3+与Fe2+的检验
Fe3O4中铁的化合价为正几价?
探究活动一:怎样检验Fe3O4粉末与硫酸的反应液中有Fe3+和Fe2+?
二、Fe2+与Fe3+的相互转化
活动探究二:能否将反应液中的Fe3+全部转化成Fe2+使溶液变得更纯净?
1、Fe3+转化成Fe2+发生的是氧化还是还原反应?
2、加入氧化剂还是还原剂?你想到了哪些还原剂?
3、加入什么试剂证明Fe3+完全转化成Fe2+?
4、加入试剂的顺序?
探究活动三:设计实验将反应液中的Fe2+全部转化成Fe3+,使溶液变得更纯净,提供的试剂任选。
试剂:Fe、新制氯水、H2O2 、KMnO4、K3[Fe(CN)6]溶液
实验方案:
知识小结:总结Fe2+与Fe3+转化的规律
三、学以致用挑战高考
(2019全国一卷)
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
(2018全国二卷)7题(6分)
7. 下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程
B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
(2019全国二卷)10题(6分)
10.下列实验现象与实验操作不相匹配的是( )
实验操作 实验现象
D 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变
(2018全国二卷)28题(15分)
(2) ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
(2018全国二卷)28题(15分).
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液(铁氰化钾)为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3] == 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
四、课堂小结
五、课后练习
1、下列说法不正确的是( )
A、Fe3O4为磁性氧化铁,其中铁元素的化合价为+2和+3
B、FeO、Fe2O3均为碱性氧化物,均可以和盐酸反应
C、Fe(OH)2不稳定,在空气中易被氧化成Fe(OH)3
D、Fe(OH)3为红褐色的溶液
2、下列离子检验方法合理的是( )
A、向某溶液中滴入KSCN溶液,溶液呈红色,说明原溶液中不含有Fe2+
B、向某溶液中通入氯气,然后再加入KSCN溶液,溶液变红色,说明原溶液中含有Fe2+
C、向某溶液中加入氢氧化钠溶液,得到红褐色沉淀,说明原溶液中含有Fe3+
D、向某溶液中加入氢氧化钠溶液,得到白色沉淀,又观察到颜色变为灰绿色最后变成红褐色,说明该溶液中只含Fe2+,不含有Mg2+。
3、在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁 B.该反应是化合反应
C.该反应是氧化还原反应 D.氢氧化亚铁作氧化剂
4、按如图所示装置,用两种不同操作分别进行实验,观察B管中的现象。(注:操作过程中不考虑稀H2SO4与NaOH溶液的作用)
(1)操作Ⅰ:先夹紧止水夹a,使A管开始反应,实验中B管观察到的现象是__________
________________________。B管发生反应的化学方程式是____________________________。
(2)操作Ⅱ:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管观察到的现象是______________________________。B管中发生反应的离子方程式是__________________________。
答案
预习案
1、结合前面所学,总结Fe3+和Fe2+的检验方法
2、写出Fe2(SO4)3和KSCN溶液反应的化学方程式
Fe2(SO4)3+3KSCN== Fe(SCN)3+ K2SO4
3、写出FeSO4和K3[Fe(CN)6]溶液反应的化学方程式
FeSO4+ K3[Fe(CN)6]== Fe[Fe(CN)6] 2 + K2SO4
4、写出Fe3O4和H2SO4溶液反应的离子方程式
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
学案
三、学以致用挑战高考
(2019全国一卷)
7.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是( )
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
(2018全国二卷)7题(6分)
7. 下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程
B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
(2019全国二卷)10题(6分)
10.下列实验现象与实验操作不相匹配的是( )
实验操作 实验现象
D 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变
(2018全国二卷)28题(15分)
(2) ④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是: 。
答案:取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3
(2018全国二卷)28题(15分).
K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液(铁氰化钾)为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3] == 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
答案:3FeC2O4+2K3[Fe(CN)6] Fe3[Fe(CN)6]2 +3K2C2O4
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
五、课后练习
1、D 2、C
3、C
4、(1)有白色絮状沉淀产生,速速变成灰绿色,最后变成红褐色。
FeSO4+2NaOH=Fe(OH)2↓+ Na2SO4
4Fe(OH)2+2H2O+O2=4Fe(OH)3
(2) 有白色絮状沉淀产生 Fe2++2OH-=Fe(OH)2↓
