2023-2024学年鲁科版高中化学选择性必修一 1.3电能转化为化学能—电解 课件 (共31张PPT)
文档属性
| 名称 | 2023-2024学年鲁科版高中化学选择性必修一 1.3电能转化为化学能—电解 课件 (共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 12.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-13 10:26:49 | ||
图片预览




文档简介
(共31张PPT)
第3节 电能转化为化学能
——电解
高中化学鲁科版选择性必修一第一章
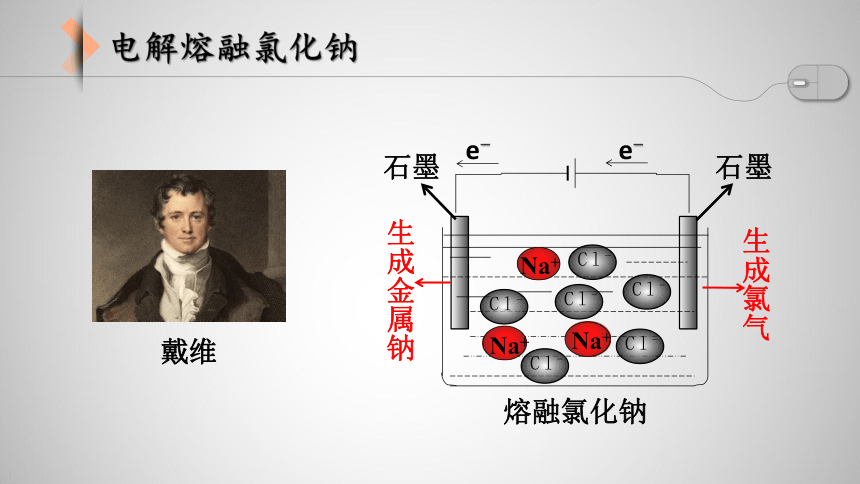
电解熔融氯化钠制得了金属钠
戴维
魔水是通过电解氯化钠溶液而制得
电解熔融氯化钠制得了金属钠
戴维
魔水是通过电解氯化钠溶液而制得
电解熔融氯化钠
e-
e-
Na+
Na+
Na+
石墨
石墨
戴维
熔融氯化钠
生成金属钠
生成氯气
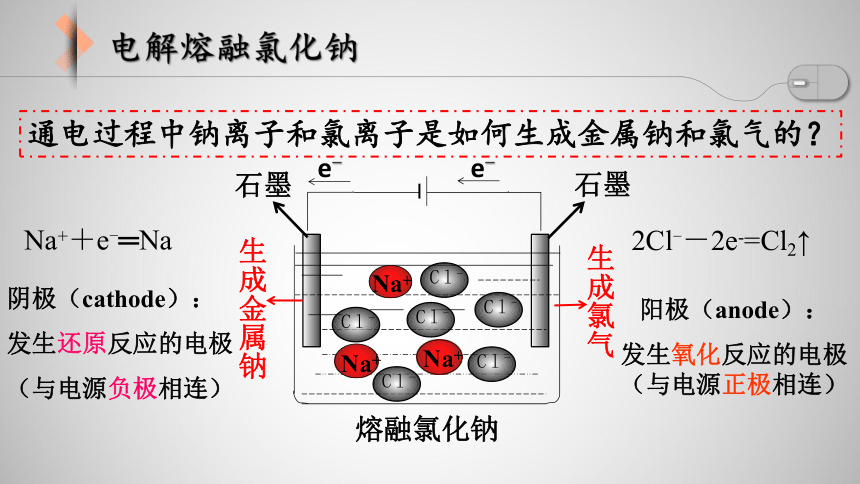
通电过程中钠离子和氯离子是如何生成金属钠和氯气的?
Na++e-═Na
阴极(cathode):
发生还原反应的电极
(与电源负极相连)
阳极(anode):
发生氧化反应的电极(与电源正极相连)
2Cl--2e-=Cl2↑
e-
e-
Na+
Na+
Na+
石墨
石墨
熔融氯化钠
生成金属钠
生成氯气
电解熔融氯化钠
e-
e-
Na+
Na+
Na+
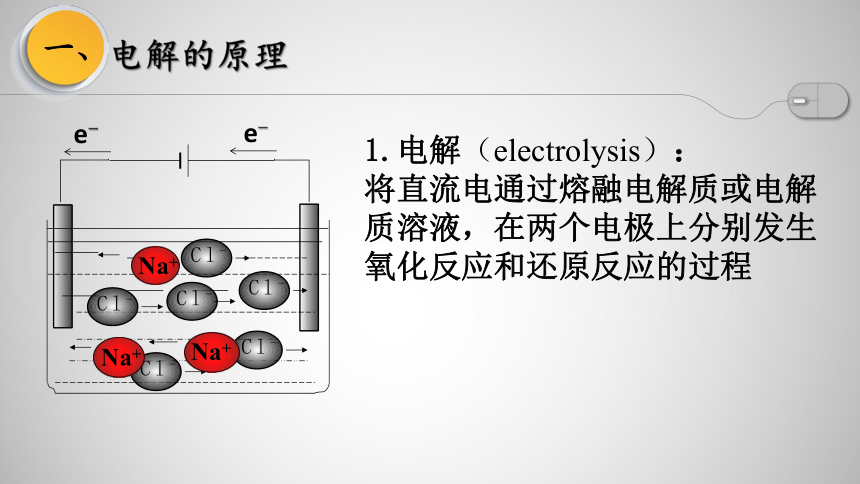
1.电解(electrolysis):
将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程
一、
电解的原理
e-
e-
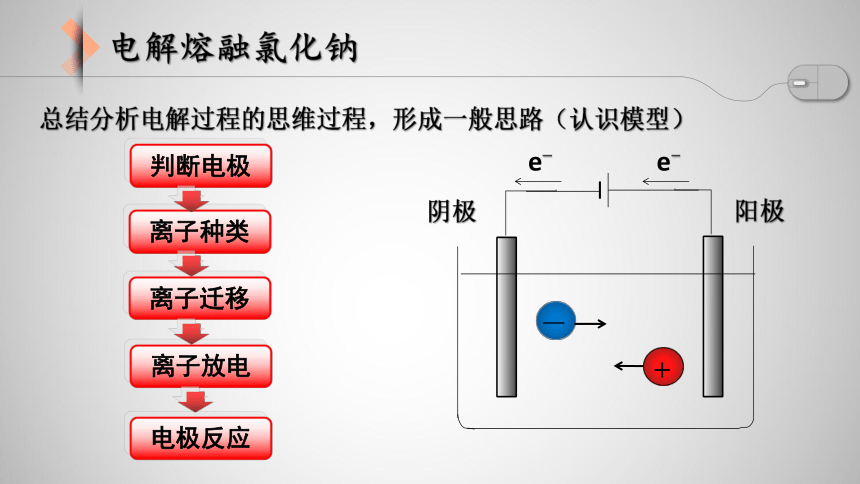
总结分析电解过程的思维过程,形成一般思路(认识模型)
阴极
阳极
+
—
离子迁移
离子种类
判断电极
离子放电
电极反应
电解熔融氯化钠
e-
e-
Na+
Na+
Na+
阴极
阳极
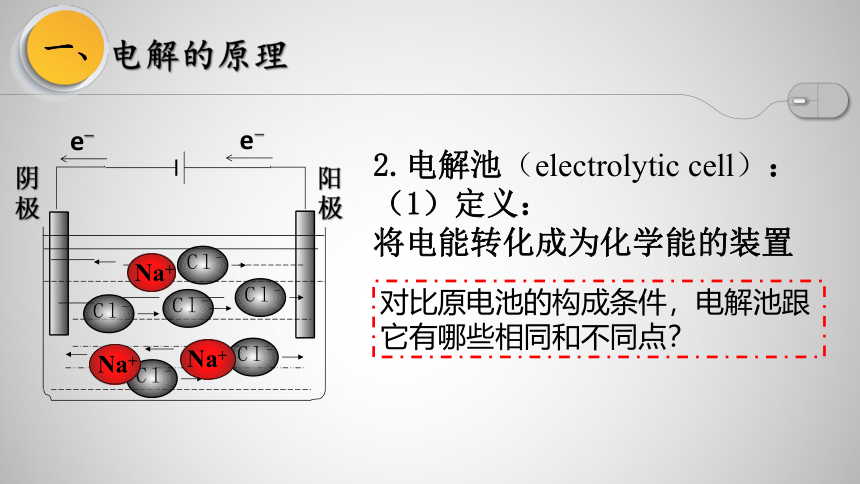
2.电解池(electrolytic cell):
(1)定义:
将电能转化成为化学能的装置
对比原电池的构成条件,电解池跟它有哪些相同和不同点?
一、
电解的原理
e-
e-
Na+
Na+
Na+
阴极
阳极
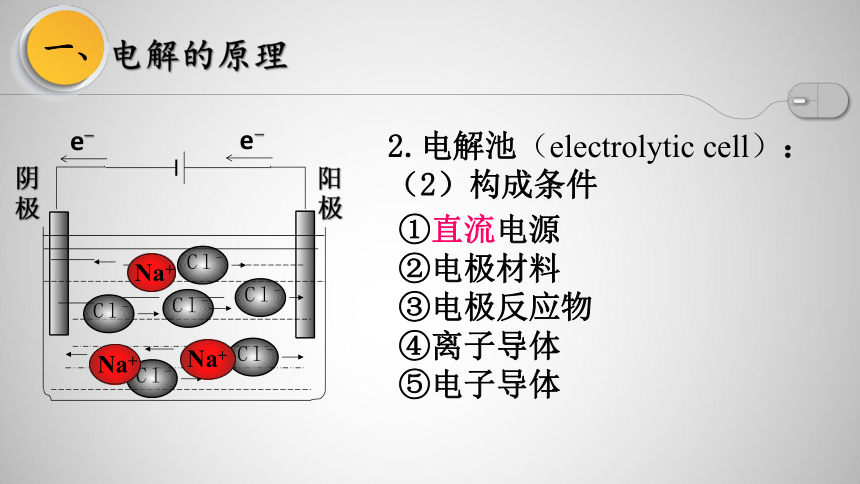
2.电解池(electrolytic cell):
(2)构成条件
①直流电源
②电极材料
③电极反应物
④离子导体
⑤电子导体
一、
电解的原理
e-
e-
Na+
Na+
Na+
石墨
石墨
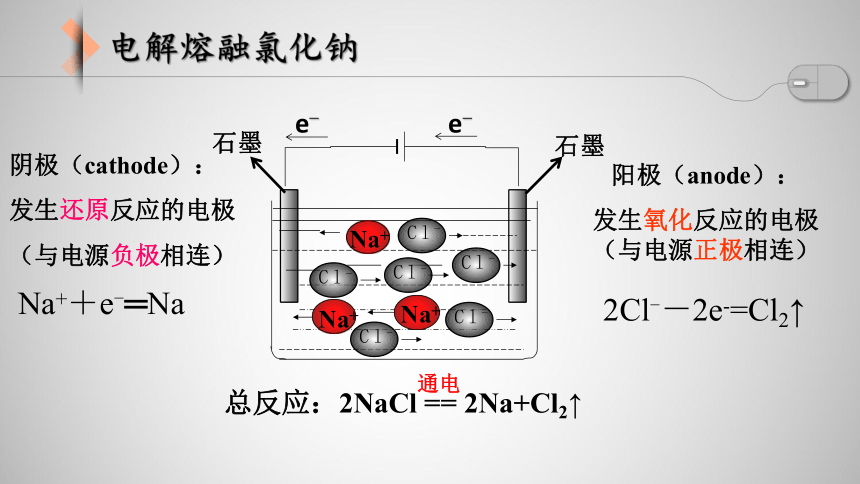
Na++e-═Na
阴极(cathode):
发生还原反应的电极
(与电源负极相连)
阳极(anode):
发生氧化反应的电极(与电源正极相连)
2Cl--2e-=Cl2↑
总反应:2NaCl == 2Na+Cl2↑
通电
电解熔融氯化钠
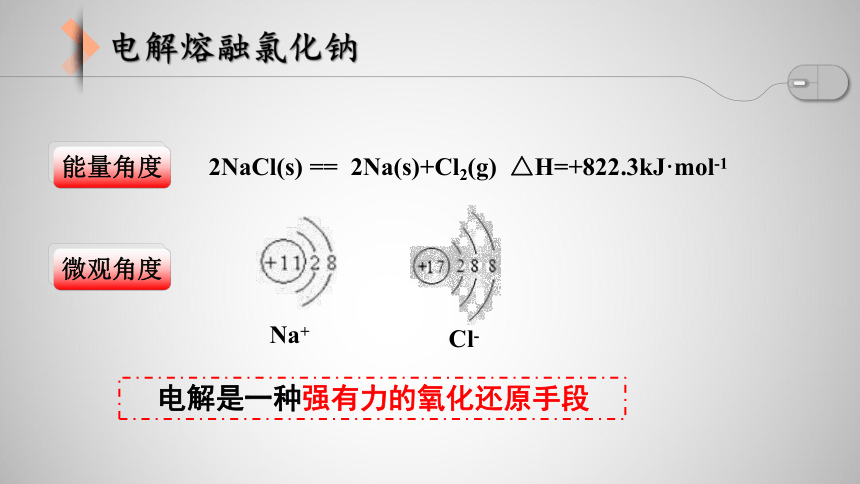
2Na(s)+Cl2(g) =2NaCl(s) △H=-822.3kJ·mol-1
电解熔融氯化钠
能量角度
电解熔融氯化钠
电解是一种强有力的氧化还原手段
能量角度
微观角度
Na+
Cl-
2NaCl(s) == 2Na(s)+Cl2(g) △H=+822.3kJ·mol-1
常温下固体氯化钠无法导电,其原因是什么?
有哪些方法可以实现氯化钠导电?
导电的过程是物理变化还是化学变化?
电解质导电的过程就是氧化还原反应发生的过程,是化学变化
以氯化钠固体为原料,经过电解制备出了金属钠
魔水是通过电解氯化钠溶液而制得
戴维
分析电解池的一般思路
(认识模型)
石墨
石墨
氯化钠溶液
运用认识模型,分析电解过程并预测电解氯化钠溶液初期阴阳极产物可能是什么
电解氯化钠溶液
离子迁移
离子种类
判断电极
离子放电
电极反应
预测产物
任务时间:5 min
电解氯化钠溶液
实验探究
结合学案上知识支持的内容,小组讨论微观上发生了什么反应造成了宏观上阴、阳极的实验现象
实验现象 微观解释
阴极
阳极
电解氯化钠溶液
理论解释
pH试纸变蓝
润湿的淀粉碘化钾试纸变蓝;pH试纸先变红,后褪色
2H+ + 2e-= H2 ↑
2Cl-- 2e-=Cl2↑
2Cl-- 2e-=Cl2↑
2H+ + 2e-= H2 ↑
阴极电极反应:
阳极电极反应:
或2H2O + 2e-= H2 ↑+ 2OH-
电解氯化钠溶液初期的反应
电解氯化钠溶液
理论解释
离子迁移
离子种类
判断电极
放电顺序
电极反应
单一体系:
复杂体系:
分析电解过程的一般思路(认识模型)
离子迁移
离子种类
判断电极
离子放电
电极反应
离子迁移
离子种类
判断电极
放电顺序
电极反应
单一体系:
复杂体系:
分析电解过程的一般思路(认识模型)
离子迁移
离子种类
判断电极
离子放电
电极反应
放电顺序
阴极上离子放电的先后顺序是:
阳极上离子放电的先后顺序是:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+> Mg2+ > Na+>Ca2+>K+
S2->SO32->I->Br->Cl->OH- >非还原性含氧酸根> F-
分析电解过程的一般思路(认识模型)
阳离子氧化性由强到弱:
阴离子还原性由强到弱:
离子迁移
离子种类
判断电极
放电顺序
电极反应
单一体系:
复杂体系:
分析电解过程的一般思路(认识模型)
离子迁移
离子种类
判断电极
离子放电
电极反应
2Cl-- 2e-=Cl2↑
2H+ + 2e-= H2 ↑
2Cl-+2H2O == 2OH-+H2↑+Cl2↑
通电
阴极电极反应:
阳极电极反应:
总反应:
注:由电极反应写总反应时,弱电解质要写成分子的形式
或2H2O + 2e-= H2 ↑+ 2OH-
电解氯化钠溶液初期的反应
电解氯化钠溶液
理论解释
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
通电
魔水是通过电解氯化钠溶液而制得
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
通电
总反应:
结合本节课学习的电解原理和实验,课后尝试设计家庭制备84消毒液的实验装置
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
通电
本节小结
本节小结
电解的原理及相关概念
建立分析电解问题的认识模型
电解熔融氯化钠
电解氯化钠溶液
【巩固练习】以石墨棒作为电极材料,运用认识模型分析以下溶液的电解过程,并书写电解初期的电极反应及总反应。
(1)CuCl2溶液
(2)Na2SO4溶液
(3)AgNO3溶液
分析电解过程复杂体系的认识模型
离子迁移
离子种类
判断电极
放电顺序
电极反应
谢谢!
课后作业:
(1)结合本节课学习的电解原理和实验,课后尝试设计家庭制备84消毒液的实验装置并完成家庭小实验
(2)完成学案上的巩固练习及课后练习1、2题
第3节 电能转化为化学能
——电解
高中化学鲁科版选择性必修一第一章
电解熔融氯化钠制得了金属钠
戴维
魔水是通过电解氯化钠溶液而制得
电解熔融氯化钠制得了金属钠
戴维
魔水是通过电解氯化钠溶液而制得
电解熔融氯化钠
e-
e-
Na+
Na+
Na+
石墨
石墨
戴维
熔融氯化钠
生成金属钠
生成氯气
通电过程中钠离子和氯离子是如何生成金属钠和氯气的?
Na++e-═Na
阴极(cathode):
发生还原反应的电极
(与电源负极相连)
阳极(anode):
发生氧化反应的电极(与电源正极相连)
2Cl--2e-=Cl2↑
e-
e-
Na+
Na+
Na+
石墨
石墨
熔融氯化钠
生成金属钠
生成氯气
电解熔融氯化钠
e-
e-
Na+
Na+
Na+
1.电解(electrolysis):
将直流电通过熔融电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程
一、
电解的原理
e-
e-
总结分析电解过程的思维过程,形成一般思路(认识模型)
阴极
阳极
+
—
离子迁移
离子种类
判断电极
离子放电
电极反应
电解熔融氯化钠
e-
e-
Na+
Na+
Na+
阴极
阳极
2.电解池(electrolytic cell):
(1)定义:
将电能转化成为化学能的装置
对比原电池的构成条件,电解池跟它有哪些相同和不同点?
一、
电解的原理
e-
e-
Na+
Na+
Na+
阴极
阳极
2.电解池(electrolytic cell):
(2)构成条件
①直流电源
②电极材料
③电极反应物
④离子导体
⑤电子导体
一、
电解的原理
e-
e-
Na+
Na+
Na+
石墨
石墨
Na++e-═Na
阴极(cathode):
发生还原反应的电极
(与电源负极相连)
阳极(anode):
发生氧化反应的电极(与电源正极相连)
2Cl--2e-=Cl2↑
总反应:2NaCl == 2Na+Cl2↑
通电
电解熔融氯化钠
2Na(s)+Cl2(g) =2NaCl(s) △H=-822.3kJ·mol-1
电解熔融氯化钠
能量角度
电解熔融氯化钠
电解是一种强有力的氧化还原手段
能量角度
微观角度
Na+
Cl-
2NaCl(s) == 2Na(s)+Cl2(g) △H=+822.3kJ·mol-1
常温下固体氯化钠无法导电,其原因是什么?
有哪些方法可以实现氯化钠导电?
导电的过程是物理变化还是化学变化?
电解质导电的过程就是氧化还原反应发生的过程,是化学变化
以氯化钠固体为原料,经过电解制备出了金属钠
魔水是通过电解氯化钠溶液而制得
戴维
分析电解池的一般思路
(认识模型)
石墨
石墨
氯化钠溶液
运用认识模型,分析电解过程并预测电解氯化钠溶液初期阴阳极产物可能是什么
电解氯化钠溶液
离子迁移
离子种类
判断电极
离子放电
电极反应
预测产物
任务时间:5 min
电解氯化钠溶液
实验探究
结合学案上知识支持的内容,小组讨论微观上发生了什么反应造成了宏观上阴、阳极的实验现象
实验现象 微观解释
阴极
阳极
电解氯化钠溶液
理论解释
pH试纸变蓝
润湿的淀粉碘化钾试纸变蓝;pH试纸先变红,后褪色
2H+ + 2e-= H2 ↑
2Cl-- 2e-=Cl2↑
2Cl-- 2e-=Cl2↑
2H+ + 2e-= H2 ↑
阴极电极反应:
阳极电极反应:
或2H2O + 2e-= H2 ↑+ 2OH-
电解氯化钠溶液初期的反应
电解氯化钠溶液
理论解释
离子迁移
离子种类
判断电极
放电顺序
电极反应
单一体系:
复杂体系:
分析电解过程的一般思路(认识模型)
离子迁移
离子种类
判断电极
离子放电
电极反应
离子迁移
离子种类
判断电极
放电顺序
电极反应
单一体系:
复杂体系:
分析电解过程的一般思路(认识模型)
离子迁移
离子种类
判断电极
离子放电
电极反应
放电顺序
阴极上离子放电的先后顺序是:
阳极上离子放电的先后顺序是:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+> Mg2+ > Na+>Ca2+>K+
S2->SO32->I->Br->Cl->OH- >非还原性含氧酸根> F-
分析电解过程的一般思路(认识模型)
阳离子氧化性由强到弱:
阴离子还原性由强到弱:
离子迁移
离子种类
判断电极
放电顺序
电极反应
单一体系:
复杂体系:
分析电解过程的一般思路(认识模型)
离子迁移
离子种类
判断电极
离子放电
电极反应
2Cl-- 2e-=Cl2↑
2H+ + 2e-= H2 ↑
2Cl-+2H2O == 2OH-+H2↑+Cl2↑
通电
阴极电极反应:
阳极电极反应:
总反应:
注:由电极反应写总反应时,弱电解质要写成分子的形式
或2H2O + 2e-= H2 ↑+ 2OH-
电解氯化钠溶液初期的反应
电解氯化钠溶液
理论解释
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
通电
魔水是通过电解氯化钠溶液而制得
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
通电
总反应:
结合本节课学习的电解原理和实验,课后尝试设计家庭制备84消毒液的实验装置
2NaCl+2H2O == 2NaOH+H2↑+Cl2↑
通电
本节小结
本节小结
电解的原理及相关概念
建立分析电解问题的认识模型
电解熔融氯化钠
电解氯化钠溶液
【巩固练习】以石墨棒作为电极材料,运用认识模型分析以下溶液的电解过程,并书写电解初期的电极反应及总反应。
(1)CuCl2溶液
(2)Na2SO4溶液
(3)AgNO3溶液
分析电解过程复杂体系的认识模型
离子迁移
离子种类
判断电极
放电顺序
电极反应
谢谢!
课后作业:
(1)结合本节课学习的电解原理和实验,课后尝试设计家庭制备84消毒液的实验装置并完成家庭小实验
(2)完成学案上的巩固练习及课后练习1、2题
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
