2022-2023学年山东省青岛市莱西市重点中学八年级(下)期中化学试卷(含解析)
文档属性
| 名称 | 2022-2023学年山东省青岛市莱西市重点中学八年级(下)期中化学试卷(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 303.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-13 00:00:00 | ||
图片预览


文档简介
2022-2023学年山东省青岛市莱西市重点中学八年级(下)期中化学试卷
1. 下列叙述正确的是( )
A. 水结成冰后,质量保持不变,符合质量守恒定律
B. 质量守恒定律揭示了化学变化中宏观物质间的质量关系,与微观过程无关
C. 镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律
D. 碳与氧气恰好完全反应可生成二氧化碳,符合质量守恒定律
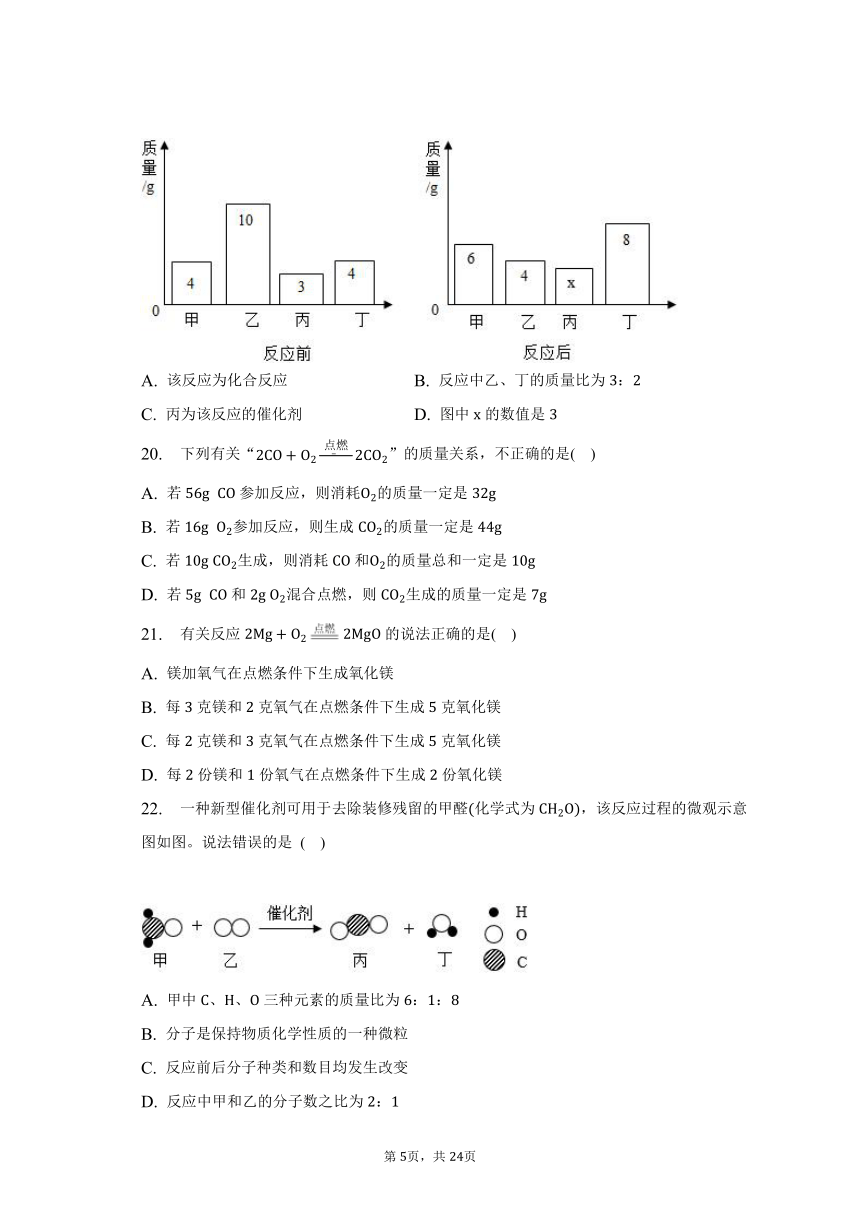
2. 化学方程式:是发射通讯卫星的火箭发生的化学反应.的化学式是( )
A. B. C. D.
3. 如图是某个化学反应的微观模拟示意图,下列关于该反应的说法中,正确的是( )
A. 该反应前后,元素的化合价都没有发生变化
B. 该反应是化合反应
C. 该反应前后,元素的种类和分子的种类都没变化
D. 参加该反应的各物质分子个数比为:
4. 山茶油是一种绿色保健食品,其主要成分是柠檬醛。现从山茶油中提取柠檬醛,使其在氧气中充分燃烧,生成二氧化碳和水,则柠檬醛中( )
A. 只含碳、氢元素 B. 一定含有碳、氢、氧元素
C. 一定含碳、氢元素,可能含有氧元素 D. 含有的元素种类无法判断
5. ,下列各化学计量数之间的关系错误的是( )
A. B. C. D.
6. 某纯净物稍微加热就能分解为、、三种物质,据此不能得出的结论是( )
A. 该物质是化合物 B. 该物质中含有水
C. 该物质不稳定 D. 该物质由四种元素组成
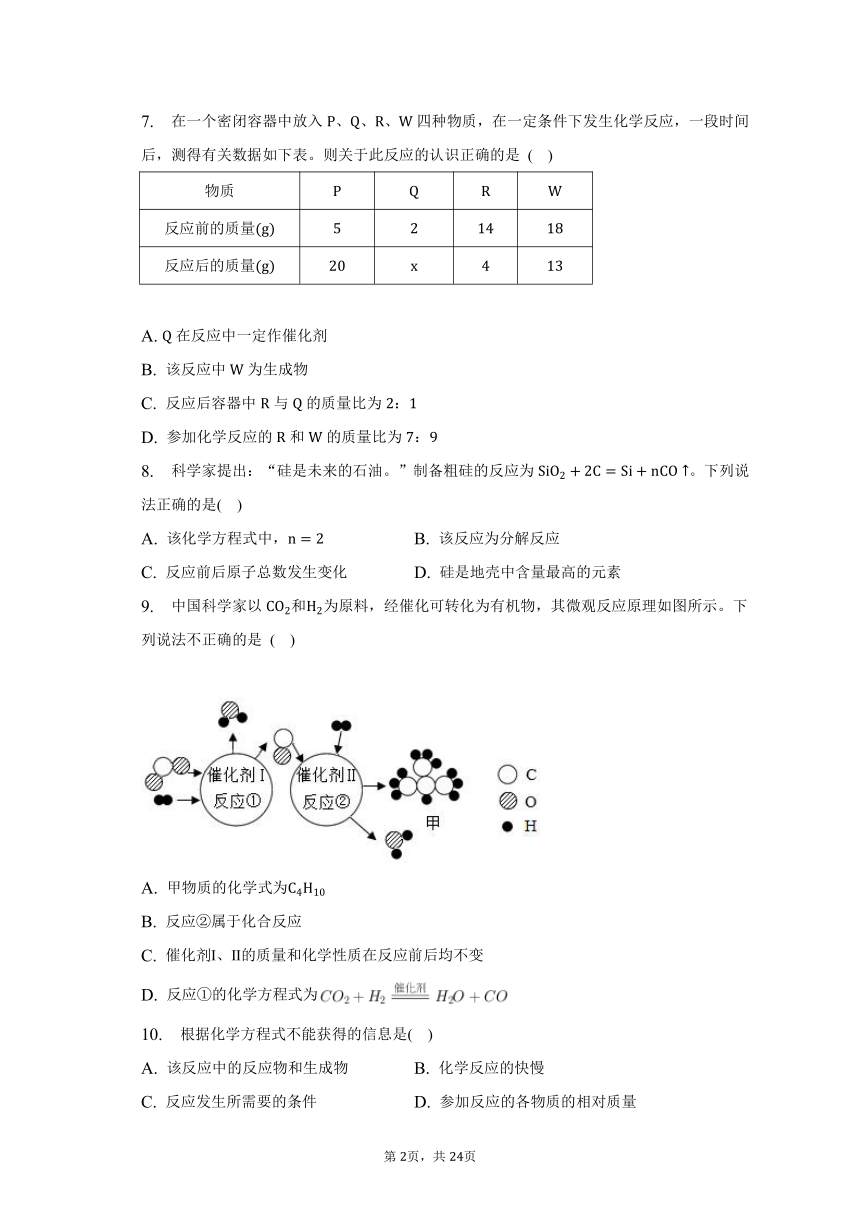
7. 在一个密闭容器中放入、、、四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是 ( )
物质
反应前的质量
反应后的质量
A. 在反应中一定作催化剂
B. 该反应中为生成物
C. 反应后容器中与的质量比为:
D. 参加化学反应的和的质量比为:
8. 科学家提出:“硅是未来的石油。”制备粗硅的反应为。下列说法正确的是( )
A. 该化学方程式中, B. 该反应为分解反应
C. 反应前后原子总数发生变化 D. 硅是地壳中含量最高的元素
9. 中国科学家以和为原料,经催化可转化为有机物,其微观反应原理如图所示。下列说法不正确的是 ( )
A. 甲物质的化学式为
B. 反应属于化合反应
C. 催化剂Ⅰ、Ⅱ的质量和化学性质在反应前后均不变
D. 反应的化学方程式为
10. 根据化学方程式不能获得的信息是( )
A. 该反应中的反应物和生成物 B. 化学反应的快慢
C. 反应发生所需要的条件 D. 参加反应的各物质的相对质量
11. 下列化学方程式书写正确的是( )
A. B.
C. D.
12. 将物质与物质充分反应后,收集到的物质只有,和一种新物质。若、、的相对分子质量为、、,则下列反应的化学方程式正确的是( )
A. B. C. D.
13. 在密闭容器内,有甲、乙、丙、丁四种物质,甲、丁的相对分子质量之比为:在一定条件下充分混合反应,测得反应过程中、时刻的质量分数如图所示,下列说法正确的是( )
A. 乙一定是该反应的催化剂
B. 生成的甲、丙两物质的质量比为:
C. 该反应方程式中丁和甲的计量数之比为:
D. 某时刻,若为,则为
14. 在反应中,和足量在一定条件下充分反应生成,已知的相对原子质量为,则的相对分子质量是( )
A. B. C. D.
15. 中国科学院科研团队研究成果表明,在常温、常压和可见光条件下,基于一种固体催化剂合成氨气的原理如图所示。下列说法不正确的是( )
A. 可通过分离液态空气获得
B. 氧气约占空气体积的
C. 参加反应的与生成的质量比为:
D. 参加反应的与的分子个数比为:
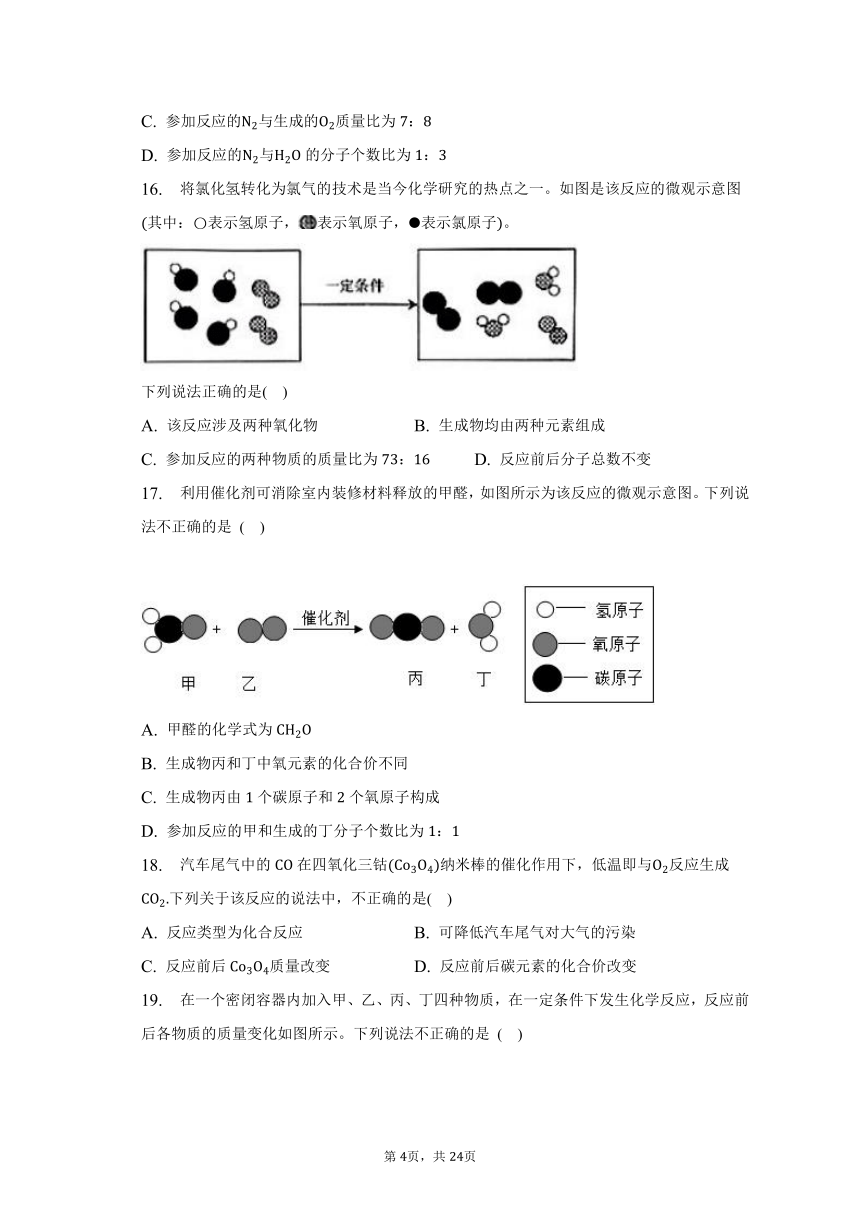
16. 将氯化氢转化为氯气的技术是当今化学研究的热点之一。如图是该反应的微观示意图其中:表示氢原子,表示氧原子,表示氯原子。
下列说法正确的是( )
A. 该反应涉及两种氧化物 B. 生成物均由两种元素组成
C. 参加反应的两种物质的质量比为: D. 反应前后分子总数不变
17. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法不正确的是 ( )
A. 甲醛的化学式为
B. 生成物丙和丁中氧元素的化合价不同
C. 生成物丙由个碳原子和个氧原子构成
D. 参加反应的甲和生成的丁分子个数比为:
18. 汽车尾气中的在四氧化三钴纳米棒的催化作用下,低温即与反应生成下列关于该反应的说法中,不正确的是( )
A. 反应类型为化合反应 B. 可降低汽车尾气对大气的污染
C. 反应前后质量改变 D. 反应前后碳元素的化合价改变
19. 在一个密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图所示。下列说法不正确的是 ( )
A. 该反应为化合反应 B. 反应中乙、丁的质量比为:
C. 丙为该反应的催化剂 D. 图中的数值是
20. 下列有关“”的质量关系,不正确的是( )
A. 若 参加反应,则消耗的质量一定是
B. 若 参加反应,则生成的质量一定是
C. 若 生成,则消耗和的质量总和一定是
D. 若 和 混合点燃,则生成的质量一定是
21. 有关反应的说法正确的是( )
A. 镁加氧气在点燃条件下生成氧化镁
B. 每克镁和克氧气在点燃条件下生成克氧化镁
C. 每克镁和克氧气在点燃条件下生成克氧化镁
D. 每份镁和份氧气在点燃条件下生成份氧化镁
22. 一种新型催化剂可用于去除装修残留的甲醛化学式为,该反应过程的微观示意图如图。说法错误的是 ( )
A. 甲中、、三种元素的质量比为::
B. 分子是保持物质化学性质的一种微粒
C. 反应前后分子种类和数目均发生改变
D. 反应中甲和乙的分子数之比为:
23. 在的反应中,表示 ______ 与 ______ 在点燃的条件下生成了 ______ ;若从反应物、生成物的质量比来看,表示每 ______ 份质量的磷跟 ______ 份质量的氧气完全反应,生成 ______ 份质量的五氧化二磷。
24. 某物质在氧气中完全燃烧,生成二氧化碳、水和二氧化硫,则该物质含氢元素的质量为______该反应方程式中氧气和二氧化硫的化学计量数之比为______.
25. 如图为某化学反应的微观过程,其中“”和“”表示两种不同的原子.
该反应中反应物______填“可能”或“不可能”是氧化物.
图中虚线框内应填的微观图示是______选填、、、,你推断的依据是______
A.B.C.D.
26. 在反应中,、、三种物质的质量比为::,现用与足量反应,可生成 ______ ;若已知的相对分子质量为,则的相对分子质量为 ______ 。
27. 某同学把硫放在给定的氧气中充分燃烧,实验数据如下表所示.
第一次 第二次 第三次
的质量
生成的质量
回答下列问题:
从以上数据说明,这三次实验中第______次恰好完全反应;
第______次实验中硫有剩余,剩余______;
第______次实验中氧气有剩余,剩余______;
这三次实验的化学反应过程中,是否有不符合质量守恒定律的?______.
28. “宏观微观符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图:
从微观构成看:四种物质均由 ______ 构成填“分子”或“原子”或“离子”。
参加反应的甲和乙的粒子个数比为 ______ 。
生成的丙和丁的质量比为 ______ 。
写出该反应的化学方程式 ______ 。
29. 某校化学兴趣小组在老师的引导下进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以、、表示如下:
A、、三个实验分别由甲、乙、丙三个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
实验:白磷刚引燃,立即将锥形瓶放在天平上称量,天平不平衡,结论是:质量不守恒。等锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。你认为结论正确的是 ______ 填“前一种”或“后一种”,导致另一种结论错误的原因是: ______ ,白磷燃烧实验中小气球的变化是 ______ 。气球的作用是 ______ 。
乙组同学认为实验验证了质量守恒定律;请从原子的角度说明为什么? ______ 。
丙组同学得到的错误结论是“实验说明质量不守恒”。你认为实验天平不平衡的原因是 ______ 。该反应的化学方程式为 ______ 。若用该反应验证质量守恒定律,则需将该反应置于 ______ 容器中进行。
30. 化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量过氧化氢溶液和二氧化锰进行实验,反应前后质量随时间变化关系如图。
计算:
最后反应的剩余物中二氧化锰的质量是 ______ ;
制得氧气的质量是 ______ ;
由反应图线可知,随着反应的进行,反应速率逐渐减小,你认为可能的原因是 ______ ;
计算参加反应的过氧化氢质量是多少?
答案和解析
1.【答案】
【解析】解:、水变成冰,发生的是物理变化,不能用质量守恒定律解释,该选项不正确;
B、质量守恒定律揭示了化学变化中宏观物质间的质量关系,与微观过程有关,是因为宏观现象是微观反应的反映,该选项不正确;
C、镁条燃烧后固体质量增加,是因为氧气参加了反应,遵循质量守恒定律,该选项不正确;
D、碳与氧气恰好完全反应可生成二氧化碳,符合质量守恒定律,该选项正确。
故选:。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
2.【答案】
【解析】解:由,
化学反应遵循质量守恒定律,则反应前后的元素相同,原子个数相等,
反应中只有原子个数前后相等,
反应后有元素,则反应前中含有元素,
反应后共个原子,则中有个原子,
反应后共个原子,则中有个原子,
又的化学计量数为,故的化学式为,
故选:。
根据习题中的化学反应,利用化学反应前后原子的种类与数目保持不变来确定的化学式.
本题考查化学式的确定,学生应能根据化学方程式中的化学计量数和质量守恒定律来确定某物质的化学式.
3.【答案】
【解析】解:由化学反应的微观示意图可知,各物质反应的微粒的数目关系是:
A、该反应由两种单质生成了一种化合物,元素的化合价都发生了变化,故A错误;
B、由上图可知,该反应由两种物质生成了一种物质,该反应的基本反应类型为化合反应,故B正确;
C、由微粒的变化可知,该反应前后,原子的种类没有变化,元素的种类也没有变化,分子的种类发生了变化,故C错误;
D、由上图可知,参加反应的两种物质分子个数比为:或:,故D错误。
故选:。
观察化学反应的微观示意图,根据微粒的构成分析物质的种类及类别等,根据微粒的变化分析分子、原子的变化以及分子的个数比等;根据反应的特点分析反应的类型。
此题是微观模型考查题,认真阅读分析图示,看懂每个图形表示的含义,正确判断物质的结构、组成是解决此类题目的关键。
4.【答案】
【解析】解:中含有碳元素的质量为:,水中含有氢元素的质量为:,生成物二氧化碳和水中所含碳、氢元素的质量和,,柠檬醛中含氧元素的质量为:,则柠檬醛中一定含有碳、氢、氧三种元素。
故选:。
根据质量守恒定律,由生成物可以初步确定柠檬醛中含有碳元素和氢元素,由生成的二氧化碳和水中碳、氢元素的质量和与柠檬醛的质量进行对比,从而确定柠檬醛的组成元素。
本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定物质的元素组成。
5.【答案】
【解析】解:、根据反应前后钠原子的数目不变,则,故选项说法正确。
B、根据反应前后氯原子的数目不变,则,故选项说法正确。
C、根据反应前后氧原子的数目不变,则,故选项说法正确。
D、根据反应前后氢原子的数目不变,因为,所以,,故选项说法错误。
故选:。
根据质量守恒定律,反应前后各原子的数目不变,进行分析判断。
本题难度不大,掌握化学反应前后各原子的数目不变是正确解答本题的关键。
6.【答案】
【解析】解:、化合物是由不同种元素组成的纯净物,由分析可知,该物质由氮、氢、碳、氧四种元素组成,则该物质是化合物,故选项说法正确。
B、物质由元素组成,该物质能分解成水,说明该物质中含有氢、氧元素,不能说该物质中含有水,故选项说法错误。
C、该物质稍微加热就能分解,说明该物质不稳定,故选项说法正确。
D、由分析可知,该物质由氮、氢、碳、氧四种元素组成,故选项说法正确。
故选:。
某纯净物稍微加热就能分解为、、三种物质,、、中含有氮、氢、碳、氧四种元素,根据质量守恒定律,反应前后元素的种类不变可知,该物质由氮、氢、碳、氧四种元素组成;据此分析解答。
本题主要考查了质量守恒定律,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
7.【答案】
【解析】解:、,反应前后质量不变,可能是催化剂,也可能既不是催化剂也不是反应物和生成物,该选项说法不正确;
B、反应后质量减小,是反应物,该选项说法不正确;
C、反应后容器中与的质量比为:::,该选项说法正确;
D、参加化学反应的和的质量比为:::,该选项说法不正确。
故选:。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
8.【答案】
【解析】解:、根据质量守恒定律,反应前后原子的种类和数目不变,由碳原子或氧原子守恒可知,,故选项说法正确。
B、该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项说法错误。
C、根据质量守恒定律,反应前后原子的种类和数目不变,则反应前后原子总数没有发生变化,故选项说法错误。
D、地壳中的元素含量按从高到低的顺序是:氧、硅、铝、铁,氧是地壳中含量最高的元素,故选项说法错误。
故选:。
A、根据质量守恒定律,反应前后原子的种类和数目不变来分析;
B、根据该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应来分析;
C、根据质量守恒定律,反应前后原子的种类和数目不变来分析;
D、根据地壳中的元素含量按从高到低的顺序是:氧、硅、铝、铁来分析。
本题主要考查了质量守恒定律、反应类型的判断以及地壳中的元素分布,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
9.【答案】
【解析】解:、由分子结构模型可知,每个甲物质的分子是由个碳原子和个氢原子构成的,其化学式为,故选项说法正确。
B.反应是一氧化碳和氢气在催化剂的催化作用下生成和水,该反应的生成物是两种,不符合“多变一”的形式,不符合化合反应的特征,不属于化合反应,故选项说法错误。
C、催化剂Ⅰ、Ⅱ的质量和化学性质在反应前后均不变,故选项说法正确。
D、由微观反应示意图可知,反应是由二氧化碳和氢气在催化剂Ⅰ的作用下反应生成水和一氧化碳,反应的化学方程式为,故选项说法正确。
故选:。
由题意,反应是由二氧化碳和氢气在催化剂Ⅰ的作用下反应生成水和一氧化碳,反应是一氧化碳和氢气在催化剂的催化作用下生成和水,进行分析判断。
本题通过微观粒子的模型图,考查了对分子、原子及之间的区别与联系的认识,学会从微观的角度看物质、用微粒的变化分析物质的变化是正确解答此类题的关键。
10.【答案】
【解析】解:、化学方程式中,等号左边为反应物,等号右边为生成物,故选项错误。
B、根据化学方程式无法确定化学反应的速率,故选项正确。
C、化学方程式中,等号上方标注的为反应条件,故选项错误。
D、根据化学方程式可以确定参加反应的各物质的相对质量,故选项错误。
故选:。
化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等。
本题难度不大,化学方程式是最重要的化学用语之一,掌握化学方程式的含义宏观、微观、量的含义、了解方化学方程式的读法是正确解答此类题的关键。
11.【答案】
【解析】解:、没有反应条件,正确的化学方程式为:,故A错误;
B、化学方程式没有配平,正确的化学方程式为: ,故B错误;
C、氧化铝的化学式书写错误,正确的化学方程式为:,故C错误;
D、该化学方程式书写正确,故D正确。
故选:。
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;和的标注是否正确。
本题难度不大,在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行判断;化学方程式正误判断方法是:先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,最后短线改成等号。
12.【答案】
【解析】解:将与发生反应,所得混合物中有,则参加反应的的质量为,收集到的物质只有,和一种新物质,由质量守恒定律,则生成的质量为;
设化学方程式为,则
即可得出::::,则反应的化学方程式为;
故选:。
根据质量守恒定律,首先计算出生成的的质量;由、、的相对分子质量分别为、、解和根据化学方程式的计算分析,
本题难度不大,掌握利用化学方程式的简单计算、质量守恒定律等并能灵活运用是正确解答本题的关键。
13.【答案】
【解析】解:由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数增加了,故甲是生成物;乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应;反应后丙的质量分数增加了,故是生成物;丁的质量分数减少了,是反应物。
A、乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
B、反应中甲和丙的质量比为::,故选项说法错误。
C、甲、丁的相对分子质量之比为:该反应中甲、丁的质量比是::,故该反应方程式中丁和甲的计量数之比为:,故选项说法正确。
D、反应中甲和丙的质量比为::,某时刻,若为时,,则为,故选项说法错误。
故选:。
反应后质量分数增加的属于生成物,反应后质量分数减少的属于反应物,反应后质量分数不变可能属于催化剂,进行分析判断。
本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据反应后质量分数增加的属于生成物、质量分数减少的属于反应物,灵活运用质量守恒定律。
14.【答案】
【解析】解:根据质量守恒定律可知,参加反应的的质量为;
设的相对分子质量为.
的相对分子质量是
故选:。
题目想通过的相对分子质量求算的相对分子质量,则需要知道的反应质量,根据质量守恒定律算出的质量,进而根据和的反应关系求算的相对分子质量,据此分析。
本题难度系数中等。根据质量守恒定律求算物质的质量不需要借助相对分子质量,而如果根据化学方程式计算物质的质量则一定需要相对分子质量,所以在物质求算时注意计算的依据和前提。
15.【答案】
【解析】解:、可通过分离液态空气获得,该选项正确。
B、氧气约占空气体积的,该选项正确。
C、反应的化学方程式是,参加反应的与生成的质量比为::,该选项不正确。
D、参加反应的与的分子个数比为:,该选项正确。
故选:。
A、可通过分离液态空气获得。
B、氧气约占空气体积的。
C、一定条件下氮气和水反应生成氨气和氧气。
D、参加反应的与的分子个数比为:。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
16.【答案】
【解析】解:由微观反应示意图可知,该反应是由氧气和氯化氢在一定条件下反应生成氯气和水,化学方程式为。
A、氧化物是由两种元素组成的,且其中一种元素是氧元素的化合物,因此该反应中涉及到水一种氧化物,故A错误;
B、生成物中的氯气是一种单质,是由一种元素组成的,故B错误;
C、由化学方程式可知,参加反应的氯气与氧气的质量比为::,故C正确;
D、由化学方程式可知,反应前后分子总数不相等,故D错误。
故选:。
根据微观反应示意图以及分子结构模型写出化学反应的方程式,然后再根据物质的性质、物质的组成以及化学方程式来分析。
本题综合性较强,但由于问题较多,容易被弄糊涂了,因此要从概念的科学定义出发,逐一解答。不能光看图示,否则容易出错。
17.【答案】
【解析】解:由微观反应示意图可知,该反应的化学方程式为。
A、根据分子结构模型可知,甲醛的化学式为,故A正确;
B、生成物丙是二氧化碳,氧元素的化合价为价;丁是水,水中氧元素的化合价为价,故B错误;
C、生成物丙是二氧化碳,二氧化碳是由二氧化碳分子构成的,每个二氧化碳分子由个碳原子和个氧原子构成,故C错误;
D、该反应的化学方程式为:,故参加反应的甲和生成的丁分子个数比为:,故D正确。
故选:。
A、根据分子结构模型来分析;
B、根据化合物中元素的化合价来分析;
C、根据物质的构成来分析;
D、根据化学方程式来分析。
本题考查了化学反应的微观模拟表示,完成此题,可以依据图示结合已有的知识进行解答。
18.【答案】
【解析】
【分析】
本题难度不大,熟练掌握催化剂的概念,知道催化剂在反应前后质量和化学性质不变,能够根据物质的化学式来判断元素的化合价。
【解答】
A、根据题意可以知道反应物为一氧化碳和氧气,而生成物为二氧化碳,故该反应属于化合反应,故A说法正确;
B、通过的催化可以将一氧化碳转化为二氧化碳,所以可以减少对空气的污染,故B说法正确;
C、催化剂在反应前后质量和化学性质不变,所以反应前后的质量不变,故C说法不正确;
D、反应前为一氧化碳,其中碳元素的化合价为价,而反应后为二氧化碳,其中碳元素的化合价为价,故D说法正确。
故选:。
19.【答案】
【解析】解:、由分析可知,该反应是乙反应生成甲和丁,符合一变多的特点,属于分解反应,故选项说法不正确。
B、反应中乙、丁的质量比为::,故选项说法正确。
C、反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是没有参加反应的物质,故选项说法不正确。
D、由图中数据可知,,故选项说法正确。
故选:。
根据质量守恒定律,化学反应前后物质的总质量不变,由图中数据可知,;反应后甲的质量增加了,则甲是生成物;反应后乙的质量减少了,则乙是反应物;反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是没有参加反应的物质;反应后丁的质量增加了,则丁也是生成物;该反应是乙反应生成甲和丁,符合一变多的特点,属于分解反应;据此分析解答。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.【答案】
【解析】解:、根据化学方程式意义可知,若参加反应,则消耗的质量一定是,故说法正确.
B、每份质量的一氧化碳和份质量的氧气完全反应能生成份质量的二氧化碳,因此若参加反应,则生成的质量一定是,故说法正确.
C、根据质量守恒定律可知,若生成,则消耗和的质量总和一定是,故说法正确.
D、每份质量的一氧化碳和份质量的氧气完全反应能生成份质量的二氧化碳,设和氧气反应的一氧化碳的质量为,则::,解得,因此一氧化碳有剩余,生成二氧化碳的质量是,故说法错误;
故选D.
对于化学方程式表示的意义,则可知:在点燃的条件下,一氧化碳和氧气反应生成了二氧化碳;每份质量的一氧化碳和份质量的氧气完全反应能生成份质量的二氧化碳.
本题主要考查了化学方程式含义方面的知识,应明确化学反应方程式所表示的宏观与微观意义.
21.【答案】
【解析】
【分析】
从化学方程式获得的信息主要有:反应物、生成物、反应条件、各物质间质量的关系,据此结合题意进行分析判断。
本题难度不大,化学方程式是最重要的化学用语之一,掌握化学方程式的含义宏观、微观、量的含义、了解方化学程式的读法是正确解答此类题的关键。
【解答】
A、在反应中“”读作“和”,“”读应作“生成”,故选项说法错误。
B、由化学方程式可知,在点燃条件下,每克镁跟克氧气反应生成克氧化镁,参加反应的镁、氧气和生成氧化镁的质量比为::,则每克镁和克氧气在点燃条件下生成克氧化镁,故选项说法正确。
C、由化学方程式可知,在点燃条件下,每克镁跟克氧气反应生成克氧化镁,参加反应的镁、氧气和生成氧化镁的质量比为::,则与克镁恰好完全反应的氧气的质量小于,故选项说法错误。
D、由化学方程式可知,在点燃条件下,每克镁跟克氧气反应生成克氧化镁,参加反应的镁、氧气和生成氧化镁的质量比为::,则与份质量的镁恰好完全反应的氧气的质量大于份质量,故选项说法错误。
故选:。
22.【答案】
【解析】解:、甲的化学式为:,甲中、、三种元素的质量比为::::,故A正确;
B、构成物质的微粒就是保持物质化学性质的微粒,所以分子、原子、离子都可以保持其构成物质的化学性质,分子是保持物质化学性质的一种微粒,故B正确;
C、根据化学方程式,反应前后分子种类发生改变,分子的数目不变,故C错误;
D、化学计量数之比等于分子个数比,反应中甲和乙的分子数之比为:,故D错误。
故选:。
根据题目信息结合微观示意图,反应的方程式为:,微粒的变化,分析分子、原子的变化等进行分析。
本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键。
23.【答案】磷 氧气 五氧化二磷
【解析】解:对于的反应,表示磷和氧气在点燃的条件下反应生成五氧化二磷,根据方程式可知:每份质量的磷与份质量的氧气反应生成份质量的五氧化二磷。
故答案为:磷;氧气;五氧化二磷;;;。
根据化学方程式的意义以及读法进行分析解答即可.
掌握化学方程式的意义和读法是正确解答本题的关键.
24.【答案】 :
【解析】解:水中氢元素的质量,根据质量守恒定律可知,水中氢元素的质量即该物质中氢元素的质量.根据质量守恒定律,则参加反应的氧气的质量为,因此该反应方程式中氧气和二氧化硫的化学计量数之比为::.
故答案为:;:.
在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.由题意“某物质在氧气中完全燃烧,生成二氧化碳、水和二氧化硫”,则可计算水中氢元素的质量,即该物质含氢元素的质量.
本题是运用化学中的基本思想质量守恒思想,学会处理此类计算的题目,从而培养了学生的创新思维能力.
25.【答案】可能 质量守恒定律
【解析】解:据图可知,该反应的反应物是由两种元素组成的,可能其中一种是氧元素,故反应物可能是氧化物,故填:可能;
根据质量守恒定律,化学反应前后元素的种类和原子的个数不变,据图可知,反应前含有个,个,反应后有个,故D中含有个,观察选项,应选D,故填:,质量守恒定律.
根据图示进行分析,氧化物是指由两种元素组成且一种是氧元素的化合物,化学反应前后元素的种类和原子的个数不变,据此可以推出虚线框内的物质的化学式.
本题考查了化学反应的微观模拟示意图,完成此题,可以依据图示信息进行.
26.【答案】
【解析】解:在中,、、三种物质的质量比为::,所以、、、三种物质的质量比为:::,所以和质量比为:,所以与足量反应生成的质量是;
和的质量为:,设的相对分子质量为。
解得。
故答案为:;。
根据质量守恒定律考虑本题:参加反应的和的质量和等于生成的和的质量,、、三种物质的质量比为::,所以、、、三种物质的质量比为:::,进行解答。
计算相对分子质量时与前面的系数有关,相对分子质量比等于质量比进行列等式。
27.【答案】二 一 三 三次都符合
【解析】解:参加反应的各物质质量总与反应生成物质质量总和相等,符合这一要求的只有第二次实验,所以第二次实验中两种物质恰好完全反应;
根据第二次完全反应,说明硫和氧气按:的质量比进行反应,氧气最多可消耗硫,所以硫会有剩余,剩余硫的质量;
根据第二次完全反应,说明硫和氧气按:的质量比进行反应,硫最多可消耗氧气,那么氧气剩余的质量为:;
只要发生化学变化,就符合质量守恒定律,所以三次实验都符合质量守恒定律.
故答案为:二一;;三;;三次都符合.
根据质量守恒定律,若第一次实验硫与氧气反应,应生成二氧化硫质量,而实际反应中只生成二氧化硫说明两种物质未恰好完全反应,有一种物质有剩余;第二次实验硫与氧气与生成的二氧化硫,质量关系恰好与质量守恒定律相符,说明此时反应为恰好完全反应;则第三次实验中氧气质量再增加至,因硫不足而氧气剩余进行分析.
根据质量守恒定律,反应物质恰好完全反应,参加反应的反应物质质量总和一定等于生成物质量总和即可正确解答.
28.【答案】分子 : :
【解析】解:由图可知,该反应是二氧化碳与水在催化剂和光照的作用下反应生成甲烷和氧气,该反应的化学方程式为:。
由物质的构成可知,四种物质均由分子构成;
由化学方程式的意义可知,参加反应的甲和乙的粒子个数比为:;
由化学方程式的意义可知,生成丙和丁的质量比为:::;
由上述分析可知,该反应的化学方程式为:。
故答案为:分子;
:;
:;
。
根据化学反应的微观示意图,分析物质的构成,写出化学式及反应的方程式,再根据方程式的意义分析回答有关的问题。
本题是有关微观示意图的考查,学会利用微观的观点及微观示意图的意义对反应基本类型判断及化学变化的微观信息的获取等是解题的关键,难度不大。
29.【答案】后一种 白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡 先变大后变小 调节压强 因为反应前后原子种类、数目、质量不变 在敞口容器中进行反应,生成的气体逸散到空中了 密闭
【解析】解:质量守恒定律的适用范围是所有的化学反应,白磷刚引燃,立即将锥形瓶放在天平上称量,由于燃烧放热,气体膨胀,气球膨胀,有向上的浮力,故天平不平衡,等锥形瓶冷却后,气体收缩,气球变瘪,没有了浮力作用,重新放到托盘天平上称量,天平平衡,故结论正确的是后一种;导致另一种结论错误的原因是:白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡;白磷燃烧实验中小气球的变化是先变大后变小;气球在此实验中的作用是调节压强,防止胶塞因气体膨胀而弹出;故答案为:后一种;白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡;先变大后变小;调节压强;后一种;白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡;先变大后变小;调节压强;
实验中铁与硫酸铜反应生成硫酸亚铁和铜,反应前后原子的种类、数目、质量均不变,故物质的总质量不变;
故答案为:因为反应前后原子种类、数目、质量不变;
一切化学反应都遵循质量守恒定律,实验中天平不平衡的原因是:过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出装置外导致天平不平衡;
该反应的化学方程式为:;若用有气体参加或有气体生成的反应验证质量守恒定律,需要将反应置于密闭容器中进行。故答案为:在敞口容器中进行反应,生成的气体逸散到空中了;;密闭。
根据白磷燃烧实验中装置内的压强变化进行分析;
根据质量守恒定律进行分析;
根据有气体参与的化学反应在设计验证质量守恒定律的实验时的注意事项进行分析。
本题难度不大,主要考查质量守恒定律的相关知识,学生可根据所学知识进行分析。
30.【答案】 过氧化氢的浓度越来越小
【解析】解:二氧化锰在过氧化氢分解制氧气的过程中是催化剂,催化剂的质量在化学反应前后不变,故最后反应的剩余物中二氧化锰的质量是;
根据质量守恒定律可知,化学反应前后物质的总质量不变,故制得氧气的质量是;
随着反应的进行,过氧化氢的质量减少,浓度减小,反应速率逐渐减小;
设参加反应的过氧化氢的质量为。
答:参加反应的过氧化氢的质量为。
故答案为:
;
;
过氧化氢的浓度越来越小;
。
根据催化剂的特点分析;
根据质量守恒定律分析;
根据影响反应速率的因素分析;
根据氧气的质量结合化学方程式计算。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
第1页,共1页
1. 下列叙述正确的是( )
A. 水结成冰后,质量保持不变,符合质量守恒定律
B. 质量守恒定律揭示了化学变化中宏观物质间的质量关系,与微观过程无关
C. 镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律
D. 碳与氧气恰好完全反应可生成二氧化碳,符合质量守恒定律
2. 化学方程式:是发射通讯卫星的火箭发生的化学反应.的化学式是( )
A. B. C. D.
3. 如图是某个化学反应的微观模拟示意图,下列关于该反应的说法中,正确的是( )
A. 该反应前后,元素的化合价都没有发生变化
B. 该反应是化合反应
C. 该反应前后,元素的种类和分子的种类都没变化
D. 参加该反应的各物质分子个数比为:
4. 山茶油是一种绿色保健食品,其主要成分是柠檬醛。现从山茶油中提取柠檬醛,使其在氧气中充分燃烧,生成二氧化碳和水,则柠檬醛中( )
A. 只含碳、氢元素 B. 一定含有碳、氢、氧元素
C. 一定含碳、氢元素,可能含有氧元素 D. 含有的元素种类无法判断
5. ,下列各化学计量数之间的关系错误的是( )
A. B. C. D.
6. 某纯净物稍微加热就能分解为、、三种物质,据此不能得出的结论是( )
A. 该物质是化合物 B. 该物质中含有水
C. 该物质不稳定 D. 该物质由四种元素组成
7. 在一个密闭容器中放入、、、四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识正确的是 ( )
物质
反应前的质量
反应后的质量
A. 在反应中一定作催化剂
B. 该反应中为生成物
C. 反应后容器中与的质量比为:
D. 参加化学反应的和的质量比为:
8. 科学家提出:“硅是未来的石油。”制备粗硅的反应为。下列说法正确的是( )
A. 该化学方程式中, B. 该反应为分解反应
C. 反应前后原子总数发生变化 D. 硅是地壳中含量最高的元素
9. 中国科学家以和为原料,经催化可转化为有机物,其微观反应原理如图所示。下列说法不正确的是 ( )
A. 甲物质的化学式为
B. 反应属于化合反应
C. 催化剂Ⅰ、Ⅱ的质量和化学性质在反应前后均不变
D. 反应的化学方程式为
10. 根据化学方程式不能获得的信息是( )
A. 该反应中的反应物和生成物 B. 化学反应的快慢
C. 反应发生所需要的条件 D. 参加反应的各物质的相对质量
11. 下列化学方程式书写正确的是( )
A. B.
C. D.
12. 将物质与物质充分反应后,收集到的物质只有,和一种新物质。若、、的相对分子质量为、、,则下列反应的化学方程式正确的是( )
A. B. C. D.
13. 在密闭容器内,有甲、乙、丙、丁四种物质,甲、丁的相对分子质量之比为:在一定条件下充分混合反应,测得反应过程中、时刻的质量分数如图所示,下列说法正确的是( )
A. 乙一定是该反应的催化剂
B. 生成的甲、丙两物质的质量比为:
C. 该反应方程式中丁和甲的计量数之比为:
D. 某时刻,若为,则为
14. 在反应中,和足量在一定条件下充分反应生成,已知的相对原子质量为,则的相对分子质量是( )
A. B. C. D.
15. 中国科学院科研团队研究成果表明,在常温、常压和可见光条件下,基于一种固体催化剂合成氨气的原理如图所示。下列说法不正确的是( )
A. 可通过分离液态空气获得
B. 氧气约占空气体积的
C. 参加反应的与生成的质量比为:
D. 参加反应的与的分子个数比为:
16. 将氯化氢转化为氯气的技术是当今化学研究的热点之一。如图是该反应的微观示意图其中:表示氢原子,表示氧原子,表示氯原子。
下列说法正确的是( )
A. 该反应涉及两种氧化物 B. 生成物均由两种元素组成
C. 参加反应的两种物质的质量比为: D. 反应前后分子总数不变
17. 利用催化剂可消除室内装修材料释放的甲醛,如图所示为该反应的微观示意图。下列说法不正确的是 ( )
A. 甲醛的化学式为
B. 生成物丙和丁中氧元素的化合价不同
C. 生成物丙由个碳原子和个氧原子构成
D. 参加反应的甲和生成的丁分子个数比为:
18. 汽车尾气中的在四氧化三钴纳米棒的催化作用下,低温即与反应生成下列关于该反应的说法中,不正确的是( )
A. 反应类型为化合反应 B. 可降低汽车尾气对大气的污染
C. 反应前后质量改变 D. 反应前后碳元素的化合价改变
19. 在一个密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图所示。下列说法不正确的是 ( )
A. 该反应为化合反应 B. 反应中乙、丁的质量比为:
C. 丙为该反应的催化剂 D. 图中的数值是
20. 下列有关“”的质量关系,不正确的是( )
A. 若 参加反应,则消耗的质量一定是
B. 若 参加反应,则生成的质量一定是
C. 若 生成,则消耗和的质量总和一定是
D. 若 和 混合点燃,则生成的质量一定是
21. 有关反应的说法正确的是( )
A. 镁加氧气在点燃条件下生成氧化镁
B. 每克镁和克氧气在点燃条件下生成克氧化镁
C. 每克镁和克氧气在点燃条件下生成克氧化镁
D. 每份镁和份氧气在点燃条件下生成份氧化镁
22. 一种新型催化剂可用于去除装修残留的甲醛化学式为,该反应过程的微观示意图如图。说法错误的是 ( )
A. 甲中、、三种元素的质量比为::
B. 分子是保持物质化学性质的一种微粒
C. 反应前后分子种类和数目均发生改变
D. 反应中甲和乙的分子数之比为:
23. 在的反应中,表示 ______ 与 ______ 在点燃的条件下生成了 ______ ;若从反应物、生成物的质量比来看,表示每 ______ 份质量的磷跟 ______ 份质量的氧气完全反应,生成 ______ 份质量的五氧化二磷。
24. 某物质在氧气中完全燃烧,生成二氧化碳、水和二氧化硫,则该物质含氢元素的质量为______该反应方程式中氧气和二氧化硫的化学计量数之比为______.
25. 如图为某化学反应的微观过程,其中“”和“”表示两种不同的原子.
该反应中反应物______填“可能”或“不可能”是氧化物.
图中虚线框内应填的微观图示是______选填、、、,你推断的依据是______
A.B.C.D.
26. 在反应中,、、三种物质的质量比为::,现用与足量反应,可生成 ______ ;若已知的相对分子质量为,则的相对分子质量为 ______ 。
27. 某同学把硫放在给定的氧气中充分燃烧,实验数据如下表所示.
第一次 第二次 第三次
的质量
生成的质量
回答下列问题:
从以上数据说明,这三次实验中第______次恰好完全反应;
第______次实验中硫有剩余,剩余______;
第______次实验中氧气有剩余,剩余______;
这三次实验的化学反应过程中,是否有不符合质量守恒定律的?______.
28. “宏观微观符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图:
从微观构成看:四种物质均由 ______ 构成填“分子”或“原子”或“离子”。
参加反应的甲和乙的粒子个数比为 ______ 。
生成的丙和丁的质量比为 ______ 。
写出该反应的化学方程式 ______ 。
29. 某校化学兴趣小组在老师的引导下进行“化学反应中,反应物与生成物的质量关系”的实验探究。他们使用的实验装置和选用药品如图所示,现分别以、、表示如下:
A、、三个实验分别由甲、乙、丙三个组的同学来完成,他们都进行了规范的操作、准确的称量和细致的观察。
实验:白磷刚引燃,立即将锥形瓶放在天平上称量,天平不平衡,结论是:质量不守恒。等锥形瓶冷却后,重新放到托盘天平上称量,天平平衡。结论是:质量守恒。你认为结论正确的是 ______ 填“前一种”或“后一种”,导致另一种结论错误的原因是: ______ ,白磷燃烧实验中小气球的变化是 ______ 。气球的作用是 ______ 。
乙组同学认为实验验证了质量守恒定律;请从原子的角度说明为什么? ______ 。
丙组同学得到的错误结论是“实验说明质量不守恒”。你认为实验天平不平衡的原因是 ______ 。该反应的化学方程式为 ______ 。若用该反应验证质量守恒定律,则需将该反应置于 ______ 容器中进行。
30. 化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量过氧化氢溶液和二氧化锰进行实验,反应前后质量随时间变化关系如图。
计算:
最后反应的剩余物中二氧化锰的质量是 ______ ;
制得氧气的质量是 ______ ;
由反应图线可知,随着反应的进行,反应速率逐渐减小,你认为可能的原因是 ______ ;
计算参加反应的过氧化氢质量是多少?
答案和解析
1.【答案】
【解析】解:、水变成冰,发生的是物理变化,不能用质量守恒定律解释,该选项不正确;
B、质量守恒定律揭示了化学变化中宏观物质间的质量关系,与微观过程有关,是因为宏观现象是微观反应的反映,该选项不正确;
C、镁条燃烧后固体质量增加,是因为氧气参加了反应,遵循质量守恒定律,该选项不正确;
D、碳与氧气恰好完全反应可生成二氧化碳,符合质量守恒定律,该选项正确。
故选:。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
2.【答案】
【解析】解:由,
化学反应遵循质量守恒定律,则反应前后的元素相同,原子个数相等,
反应中只有原子个数前后相等,
反应后有元素,则反应前中含有元素,
反应后共个原子,则中有个原子,
反应后共个原子,则中有个原子,
又的化学计量数为,故的化学式为,
故选:。
根据习题中的化学反应,利用化学反应前后原子的种类与数目保持不变来确定的化学式.
本题考查化学式的确定,学生应能根据化学方程式中的化学计量数和质量守恒定律来确定某物质的化学式.
3.【答案】
【解析】解:由化学反应的微观示意图可知,各物质反应的微粒的数目关系是:
A、该反应由两种单质生成了一种化合物,元素的化合价都发生了变化,故A错误;
B、由上图可知,该反应由两种物质生成了一种物质,该反应的基本反应类型为化合反应,故B正确;
C、由微粒的变化可知,该反应前后,原子的种类没有变化,元素的种类也没有变化,分子的种类发生了变化,故C错误;
D、由上图可知,参加反应的两种物质分子个数比为:或:,故D错误。
故选:。
观察化学反应的微观示意图,根据微粒的构成分析物质的种类及类别等,根据微粒的变化分析分子、原子的变化以及分子的个数比等;根据反应的特点分析反应的类型。
此题是微观模型考查题,认真阅读分析图示,看懂每个图形表示的含义,正确判断物质的结构、组成是解决此类题目的关键。
4.【答案】
【解析】解:中含有碳元素的质量为:,水中含有氢元素的质量为:,生成物二氧化碳和水中所含碳、氢元素的质量和,,柠檬醛中含氧元素的质量为:,则柠檬醛中一定含有碳、氢、氧三种元素。
故选:。
根据质量守恒定律,由生成物可以初步确定柠檬醛中含有碳元素和氢元素,由生成的二氧化碳和水中碳、氢元素的质量和与柠檬醛的质量进行对比,从而确定柠檬醛的组成元素。
本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定物质的元素组成。
5.【答案】
【解析】解:、根据反应前后钠原子的数目不变,则,故选项说法正确。
B、根据反应前后氯原子的数目不变,则,故选项说法正确。
C、根据反应前后氧原子的数目不变,则,故选项说法正确。
D、根据反应前后氢原子的数目不变,因为,所以,,故选项说法错误。
故选:。
根据质量守恒定律,反应前后各原子的数目不变,进行分析判断。
本题难度不大,掌握化学反应前后各原子的数目不变是正确解答本题的关键。
6.【答案】
【解析】解:、化合物是由不同种元素组成的纯净物,由分析可知,该物质由氮、氢、碳、氧四种元素组成,则该物质是化合物,故选项说法正确。
B、物质由元素组成,该物质能分解成水,说明该物质中含有氢、氧元素,不能说该物质中含有水,故选项说法错误。
C、该物质稍微加热就能分解,说明该物质不稳定,故选项说法正确。
D、由分析可知,该物质由氮、氢、碳、氧四种元素组成,故选项说法正确。
故选:。
某纯净物稍微加热就能分解为、、三种物质,、、中含有氮、氢、碳、氧四种元素,根据质量守恒定律,反应前后元素的种类不变可知,该物质由氮、氢、碳、氧四种元素组成;据此分析解答。
本题主要考查了质量守恒定律,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
7.【答案】
【解析】解:、,反应前后质量不变,可能是催化剂,也可能既不是催化剂也不是反应物和生成物,该选项说法不正确;
B、反应后质量减小,是反应物,该选项说法不正确;
C、反应后容器中与的质量比为:::,该选项说法正确;
D、参加化学反应的和的质量比为:::,该选项说法不正确。
故选:。
化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,是因为化学反应前后,元素的种类不变,原子的种类、总个数不变。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
8.【答案】
【解析】解:、根据质量守恒定律,反应前后原子的种类和数目不变,由碳原子或氧原子守恒可知,,故选项说法正确。
B、该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故选项说法错误。
C、根据质量守恒定律,反应前后原子的种类和数目不变,则反应前后原子总数没有发生变化,故选项说法错误。
D、地壳中的元素含量按从高到低的顺序是:氧、硅、铝、铁,氧是地壳中含量最高的元素,故选项说法错误。
故选:。
A、根据质量守恒定律,反应前后原子的种类和数目不变来分析;
B、根据该反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应来分析;
C、根据质量守恒定律,反应前后原子的种类和数目不变来分析;
D、根据地壳中的元素含量按从高到低的顺序是:氧、硅、铝、铁来分析。
本题主要考查了质量守恒定律、反应类型的判断以及地壳中的元素分布,解答时要根据所学知识,结合各方面条件进行分析、判断,从而得出正确的结论。
9.【答案】
【解析】解:、由分子结构模型可知,每个甲物质的分子是由个碳原子和个氢原子构成的,其化学式为,故选项说法正确。
B.反应是一氧化碳和氢气在催化剂的催化作用下生成和水,该反应的生成物是两种,不符合“多变一”的形式,不符合化合反应的特征,不属于化合反应,故选项说法错误。
C、催化剂Ⅰ、Ⅱ的质量和化学性质在反应前后均不变,故选项说法正确。
D、由微观反应示意图可知,反应是由二氧化碳和氢气在催化剂Ⅰ的作用下反应生成水和一氧化碳,反应的化学方程式为,故选项说法正确。
故选:。
由题意,反应是由二氧化碳和氢气在催化剂Ⅰ的作用下反应生成水和一氧化碳,反应是一氧化碳和氢气在催化剂的催化作用下生成和水,进行分析判断。
本题通过微观粒子的模型图,考查了对分子、原子及之间的区别与联系的认识,学会从微观的角度看物质、用微粒的变化分析物质的变化是正确解答此类题的关键。
10.【答案】
【解析】解:、化学方程式中,等号左边为反应物,等号右边为生成物,故选项错误。
B、根据化学方程式无法确定化学反应的速率,故选项正确。
C、化学方程式中,等号上方标注的为反应条件,故选项错误。
D、根据化学方程式可以确定参加反应的各物质的相对质量,故选项错误。
故选:。
化学方程式可表示:反应物和生成物的种类;反应的条件;反应物和生成物的微观粒子个数比;反应物和生成物的质量比等。
本题难度不大,化学方程式是最重要的化学用语之一,掌握化学方程式的含义宏观、微观、量的含义、了解方化学方程式的读法是正确解答此类题的关键。
11.【答案】
【解析】解:、没有反应条件,正确的化学方程式为:,故A错误;
B、化学方程式没有配平,正确的化学方程式为: ,故B错误;
C、氧化铝的化学式书写错误,正确的化学方程式为:,故C错误;
D、该化学方程式书写正确,故D正确。
故选:。
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;和的标注是否正确。
本题难度不大,在解此类题时,首先分析应用的原理是否正确,然后再根据方程式的书写规则进行判断;化学方程式正误判断方法是:先看化学式是否正确,再看配平,再看反应条件,再看气体和沉淀,最后短线改成等号。
12.【答案】
【解析】解:将与发生反应,所得混合物中有,则参加反应的的质量为,收集到的物质只有,和一种新物质,由质量守恒定律,则生成的质量为;
设化学方程式为,则
即可得出::::,则反应的化学方程式为;
故选:。
根据质量守恒定律,首先计算出生成的的质量;由、、的相对分子质量分别为、、解和根据化学方程式的计算分析,
本题难度不大,掌握利用化学方程式的简单计算、质量守恒定律等并能灵活运用是正确解答本题的关键。
13.【答案】
【解析】解:由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数增加了,故甲是生成物;乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应;反应后丙的质量分数增加了,故是生成物;丁的质量分数减少了,是反应物。
A、乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,故选项说法错误。
B、反应中甲和丙的质量比为::,故选项说法错误。
C、甲、丁的相对分子质量之比为:该反应中甲、丁的质量比是::,故该反应方程式中丁和甲的计量数之比为:,故选项说法正确。
D、反应中甲和丙的质量比为::,某时刻,若为时,,则为,故选项说法错误。
故选:。
反应后质量分数增加的属于生成物,反应后质量分数减少的属于反应物,反应后质量分数不变可能属于催化剂,进行分析判断。
本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析表中数据反应后质量分数增加的属于生成物、质量分数减少的属于反应物,灵活运用质量守恒定律。
14.【答案】
【解析】解:根据质量守恒定律可知,参加反应的的质量为;
设的相对分子质量为.
的相对分子质量是
故选:。
题目想通过的相对分子质量求算的相对分子质量,则需要知道的反应质量,根据质量守恒定律算出的质量,进而根据和的反应关系求算的相对分子质量,据此分析。
本题难度系数中等。根据质量守恒定律求算物质的质量不需要借助相对分子质量,而如果根据化学方程式计算物质的质量则一定需要相对分子质量,所以在物质求算时注意计算的依据和前提。
15.【答案】
【解析】解:、可通过分离液态空气获得,该选项正确。
B、氧气约占空气体积的,该选项正确。
C、反应的化学方程式是,参加反应的与生成的质量比为::,该选项不正确。
D、参加反应的与的分子个数比为:,该选项正确。
故选:。
A、可通过分离液态空气获得。
B、氧气约占空气体积的。
C、一定条件下氮气和水反应生成氨气和氧气。
D、参加反应的与的分子个数比为:。
本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
16.【答案】
【解析】解:由微观反应示意图可知,该反应是由氧气和氯化氢在一定条件下反应生成氯气和水,化学方程式为。
A、氧化物是由两种元素组成的,且其中一种元素是氧元素的化合物,因此该反应中涉及到水一种氧化物,故A错误;
B、生成物中的氯气是一种单质,是由一种元素组成的,故B错误;
C、由化学方程式可知,参加反应的氯气与氧气的质量比为::,故C正确;
D、由化学方程式可知,反应前后分子总数不相等,故D错误。
故选:。
根据微观反应示意图以及分子结构模型写出化学反应的方程式,然后再根据物质的性质、物质的组成以及化学方程式来分析。
本题综合性较强,但由于问题较多,容易被弄糊涂了,因此要从概念的科学定义出发,逐一解答。不能光看图示,否则容易出错。
17.【答案】
【解析】解:由微观反应示意图可知,该反应的化学方程式为。
A、根据分子结构模型可知,甲醛的化学式为,故A正确;
B、生成物丙是二氧化碳,氧元素的化合价为价;丁是水,水中氧元素的化合价为价,故B错误;
C、生成物丙是二氧化碳,二氧化碳是由二氧化碳分子构成的,每个二氧化碳分子由个碳原子和个氧原子构成,故C错误;
D、该反应的化学方程式为:,故参加反应的甲和生成的丁分子个数比为:,故D正确。
故选:。
A、根据分子结构模型来分析;
B、根据化合物中元素的化合价来分析;
C、根据物质的构成来分析;
D、根据化学方程式来分析。
本题考查了化学反应的微观模拟表示,完成此题,可以依据图示结合已有的知识进行解答。
18.【答案】
【解析】
【分析】
本题难度不大,熟练掌握催化剂的概念,知道催化剂在反应前后质量和化学性质不变,能够根据物质的化学式来判断元素的化合价。
【解答】
A、根据题意可以知道反应物为一氧化碳和氧气,而生成物为二氧化碳,故该反应属于化合反应,故A说法正确;
B、通过的催化可以将一氧化碳转化为二氧化碳,所以可以减少对空气的污染,故B说法正确;
C、催化剂在反应前后质量和化学性质不变,所以反应前后的质量不变,故C说法不正确;
D、反应前为一氧化碳,其中碳元素的化合价为价,而反应后为二氧化碳,其中碳元素的化合价为价,故D说法正确。
故选:。
19.【答案】
【解析】解:、由分析可知,该反应是乙反应生成甲和丁,符合一变多的特点,属于分解反应,故选项说法不正确。
B、反应中乙、丁的质量比为::,故选项说法正确。
C、反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是没有参加反应的物质,故选项说法不正确。
D、由图中数据可知,,故选项说法正确。
故选:。
根据质量守恒定律,化学反应前后物质的总质量不变,由图中数据可知,;反应后甲的质量增加了,则甲是生成物;反应后乙的质量减少了,则乙是反应物;反应前后丙的质量不变,则丙可能是该反应的催化剂,也可能是没有参加反应的物质;反应后丁的质量增加了,则丁也是生成物;该反应是乙反应生成甲和丁,符合一变多的特点,属于分解反应;据此分析解答。
化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础。
20.【答案】
【解析】解:、根据化学方程式意义可知,若参加反应,则消耗的质量一定是,故说法正确.
B、每份质量的一氧化碳和份质量的氧气完全反应能生成份质量的二氧化碳,因此若参加反应,则生成的质量一定是,故说法正确.
C、根据质量守恒定律可知,若生成,则消耗和的质量总和一定是,故说法正确.
D、每份质量的一氧化碳和份质量的氧气完全反应能生成份质量的二氧化碳,设和氧气反应的一氧化碳的质量为,则::,解得,因此一氧化碳有剩余,生成二氧化碳的质量是,故说法错误;
故选D.
对于化学方程式表示的意义,则可知:在点燃的条件下,一氧化碳和氧气反应生成了二氧化碳;每份质量的一氧化碳和份质量的氧气完全反应能生成份质量的二氧化碳.
本题主要考查了化学方程式含义方面的知识,应明确化学反应方程式所表示的宏观与微观意义.
21.【答案】
【解析】
【分析】
从化学方程式获得的信息主要有:反应物、生成物、反应条件、各物质间质量的关系,据此结合题意进行分析判断。
本题难度不大,化学方程式是最重要的化学用语之一,掌握化学方程式的含义宏观、微观、量的含义、了解方化学程式的读法是正确解答此类题的关键。
【解答】
A、在反应中“”读作“和”,“”读应作“生成”,故选项说法错误。
B、由化学方程式可知,在点燃条件下,每克镁跟克氧气反应生成克氧化镁,参加反应的镁、氧气和生成氧化镁的质量比为::,则每克镁和克氧气在点燃条件下生成克氧化镁,故选项说法正确。
C、由化学方程式可知,在点燃条件下,每克镁跟克氧气反应生成克氧化镁,参加反应的镁、氧气和生成氧化镁的质量比为::,则与克镁恰好完全反应的氧气的质量小于,故选项说法错误。
D、由化学方程式可知,在点燃条件下,每克镁跟克氧气反应生成克氧化镁,参加反应的镁、氧气和生成氧化镁的质量比为::,则与份质量的镁恰好完全反应的氧气的质量大于份质量,故选项说法错误。
故选:。
22.【答案】
【解析】解:、甲的化学式为:,甲中、、三种元素的质量比为::::,故A正确;
B、构成物质的微粒就是保持物质化学性质的微粒,所以分子、原子、离子都可以保持其构成物质的化学性质,分子是保持物质化学性质的一种微粒,故B正确;
C、根据化学方程式,反应前后分子种类发生改变,分子的数目不变,故C错误;
D、化学计量数之比等于分子个数比,反应中甲和乙的分子数之比为:,故D错误。
故选:。
根据题目信息结合微观示意图,反应的方程式为:,微粒的变化,分析分子、原子的变化等进行分析。
本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键。
23.【答案】磷 氧气 五氧化二磷
【解析】解:对于的反应,表示磷和氧气在点燃的条件下反应生成五氧化二磷,根据方程式可知:每份质量的磷与份质量的氧气反应生成份质量的五氧化二磷。
故答案为:磷;氧气;五氧化二磷;;;。
根据化学方程式的意义以及读法进行分析解答即可.
掌握化学方程式的意义和读法是正确解答本题的关键.
24.【答案】 :
【解析】解:水中氢元素的质量,根据质量守恒定律可知,水中氢元素的质量即该物质中氢元素的质量.根据质量守恒定律,则参加反应的氧气的质量为,因此该反应方程式中氧气和二氧化硫的化学计量数之比为::.
故答案为:;:.
在化学反应中遵循质量守恒定律,即反应前后元素的种类不变,原子的种类、个数不变.由题意“某物质在氧气中完全燃烧,生成二氧化碳、水和二氧化硫”,则可计算水中氢元素的质量,即该物质含氢元素的质量.
本题是运用化学中的基本思想质量守恒思想,学会处理此类计算的题目,从而培养了学生的创新思维能力.
25.【答案】可能 质量守恒定律
【解析】解:据图可知,该反应的反应物是由两种元素组成的,可能其中一种是氧元素,故反应物可能是氧化物,故填:可能;
根据质量守恒定律,化学反应前后元素的种类和原子的个数不变,据图可知,反应前含有个,个,反应后有个,故D中含有个,观察选项,应选D,故填:,质量守恒定律.
根据图示进行分析,氧化物是指由两种元素组成且一种是氧元素的化合物,化学反应前后元素的种类和原子的个数不变,据此可以推出虚线框内的物质的化学式.
本题考查了化学反应的微观模拟示意图,完成此题,可以依据图示信息进行.
26.【答案】
【解析】解:在中,、、三种物质的质量比为::,所以、、、三种物质的质量比为:::,所以和质量比为:,所以与足量反应生成的质量是;
和的质量为:,设的相对分子质量为。
解得。
故答案为:;。
根据质量守恒定律考虑本题:参加反应的和的质量和等于生成的和的质量,、、三种物质的质量比为::,所以、、、三种物质的质量比为:::,进行解答。
计算相对分子质量时与前面的系数有关,相对分子质量比等于质量比进行列等式。
27.【答案】二 一 三 三次都符合
【解析】解:参加反应的各物质质量总与反应生成物质质量总和相等,符合这一要求的只有第二次实验,所以第二次实验中两种物质恰好完全反应;
根据第二次完全反应,说明硫和氧气按:的质量比进行反应,氧气最多可消耗硫,所以硫会有剩余,剩余硫的质量;
根据第二次完全反应,说明硫和氧气按:的质量比进行反应,硫最多可消耗氧气,那么氧气剩余的质量为:;
只要发生化学变化,就符合质量守恒定律,所以三次实验都符合质量守恒定律.
故答案为:二一;;三;;三次都符合.
根据质量守恒定律,若第一次实验硫与氧气反应,应生成二氧化硫质量,而实际反应中只生成二氧化硫说明两种物质未恰好完全反应,有一种物质有剩余;第二次实验硫与氧气与生成的二氧化硫,质量关系恰好与质量守恒定律相符,说明此时反应为恰好完全反应;则第三次实验中氧气质量再增加至,因硫不足而氧气剩余进行分析.
根据质量守恒定律,反应物质恰好完全反应,参加反应的反应物质质量总和一定等于生成物质量总和即可正确解答.
28.【答案】分子 : :
【解析】解:由图可知,该反应是二氧化碳与水在催化剂和光照的作用下反应生成甲烷和氧气,该反应的化学方程式为:。
由物质的构成可知,四种物质均由分子构成;
由化学方程式的意义可知,参加反应的甲和乙的粒子个数比为:;
由化学方程式的意义可知,生成丙和丁的质量比为:::;
由上述分析可知,该反应的化学方程式为:。
故答案为:分子;
:;
:;
。
根据化学反应的微观示意图,分析物质的构成,写出化学式及反应的方程式,再根据方程式的意义分析回答有关的问题。
本题是有关微观示意图的考查,学会利用微观的观点及微观示意图的意义对反应基本类型判断及化学变化的微观信息的获取等是解题的关键,难度不大。
29.【答案】后一种 白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡 先变大后变小 调节压强 因为反应前后原子种类、数目、质量不变 在敞口容器中进行反应,生成的气体逸散到空中了 密闭
【解析】解:质量守恒定律的适用范围是所有的化学反应,白磷刚引燃,立即将锥形瓶放在天平上称量,由于燃烧放热,气体膨胀,气球膨胀,有向上的浮力,故天平不平衡,等锥形瓶冷却后,气体收缩,气球变瘪,没有了浮力作用,重新放到托盘天平上称量,天平平衡,故结论正确的是后一种;导致另一种结论错误的原因是:白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡;白磷燃烧实验中小气球的变化是先变大后变小;气球在此实验中的作用是调节压强,防止胶塞因气体膨胀而弹出;故答案为:后一种;白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡;先变大后变小;调节压强;后一种;白磷燃烧放出的热量使气体受热膨胀,小气球胀大受到浮力,使得天平不平衡;先变大后变小;调节压强;
实验中铁与硫酸铜反应生成硫酸亚铁和铜,反应前后原子的种类、数目、质量均不变,故物质的总质量不变;
故答案为:因为反应前后原子种类、数目、质量不变;
一切化学反应都遵循质量守恒定律,实验中天平不平衡的原因是:过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气逸出装置外导致天平不平衡;
该反应的化学方程式为:;若用有气体参加或有气体生成的反应验证质量守恒定律,需要将反应置于密闭容器中进行。故答案为:在敞口容器中进行反应,生成的气体逸散到空中了;;密闭。
根据白磷燃烧实验中装置内的压强变化进行分析;
根据质量守恒定律进行分析;
根据有气体参与的化学反应在设计验证质量守恒定律的实验时的注意事项进行分析。
本题难度不大,主要考查质量守恒定律的相关知识,学生可根据所学知识进行分析。
30.【答案】 过氧化氢的浓度越来越小
【解析】解:二氧化锰在过氧化氢分解制氧气的过程中是催化剂,催化剂的质量在化学反应前后不变,故最后反应的剩余物中二氧化锰的质量是;
根据质量守恒定律可知,化学反应前后物质的总质量不变,故制得氧气的质量是;
随着反应的进行,过氧化氢的质量减少,浓度减小,反应速率逐渐减小;
设参加反应的过氧化氢的质量为。
答:参加反应的过氧化氢的质量为。
故答案为:
;
;
过氧化氢的浓度越来越小;
。
根据催化剂的特点分析;
根据质量守恒定律分析;
根据影响反应速率的因素分析;
根据氧气的质量结合化学方程式计算。
根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
第1页,共1页
同课章节目录
