(五四制鲁教版)化学九年级全册期末复习:05-专项素养综合全练(五) 课标必做实验
文档属性
| 名称 | (五四制鲁教版)化学九年级全册期末复习:05-专项素养综合全练(五) 课标必做实验 |  | |
| 格式 | docx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-14 09:39:31 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
专项素养综合全练(五)
课标必做实验
类型一 一定溶质质量分数的氯化钠溶液的配制
1.某同学欲配制120 g质量分数为10%的氯化钠溶液,请回答下列问题:
(1)需称取氯化钠的质量为 g。
(2)图示操作中,正确的操作顺序为 (填序号)。
(3)①若其他操作均正确,量取水的体积时仰视读数,则所配制溶液的溶质质量分数 (填“偏大”“偏小”或“无影响”)。
②若称量氯化钠固体时托盘天平指针向右偏转,则应 直到天平平衡。
(4)欲配制60 g质量分数为5%的氯化钠溶液,需要10%的氯化钠溶液的质量为 。
类型二 常见酸、碱的化学性质
2.(2022吉林长春南湖实验中学期末)为探究碱的相关性质,设计实验如下:
(1)实验一能够观察到的明显现象是溶液由无色变为 色,能使酚酞试液变色的离子是 (填离子符号);
(2)实验二为用软矿泉水瓶所做的对比实验,软矿泉水瓶 (填“a”或“b”)变瘪更明显,原因是 (用化学方程式表示),该实验验证了可溶性碱能够与 (填“金属氧化物”或“非金属氧化物”)反应;
(3)实验三体现了用含氢氧化铝的药物治疗胃酸过多的反应原理,反应的化学方程式为 ;
(4)实验四中发生反应的化学方程式为 ;
(5)实验五中,向过量氢氧化钠溶液中滴入几滴硫酸铜溶液,现象是 。
3.(2021湖南长沙中考)为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】
实验一:按下图所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3克Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊试液变 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因: 。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞)
(用化学式表示)。
【应用与拓展】
(4)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜: 。
(5)小明在征得老师的同意后,继续进行了下图所示实验。
由上述实验可以得出氢氧化钙的哪些性质: (写一条)。
类型三 粗盐中难溶性杂质的去除
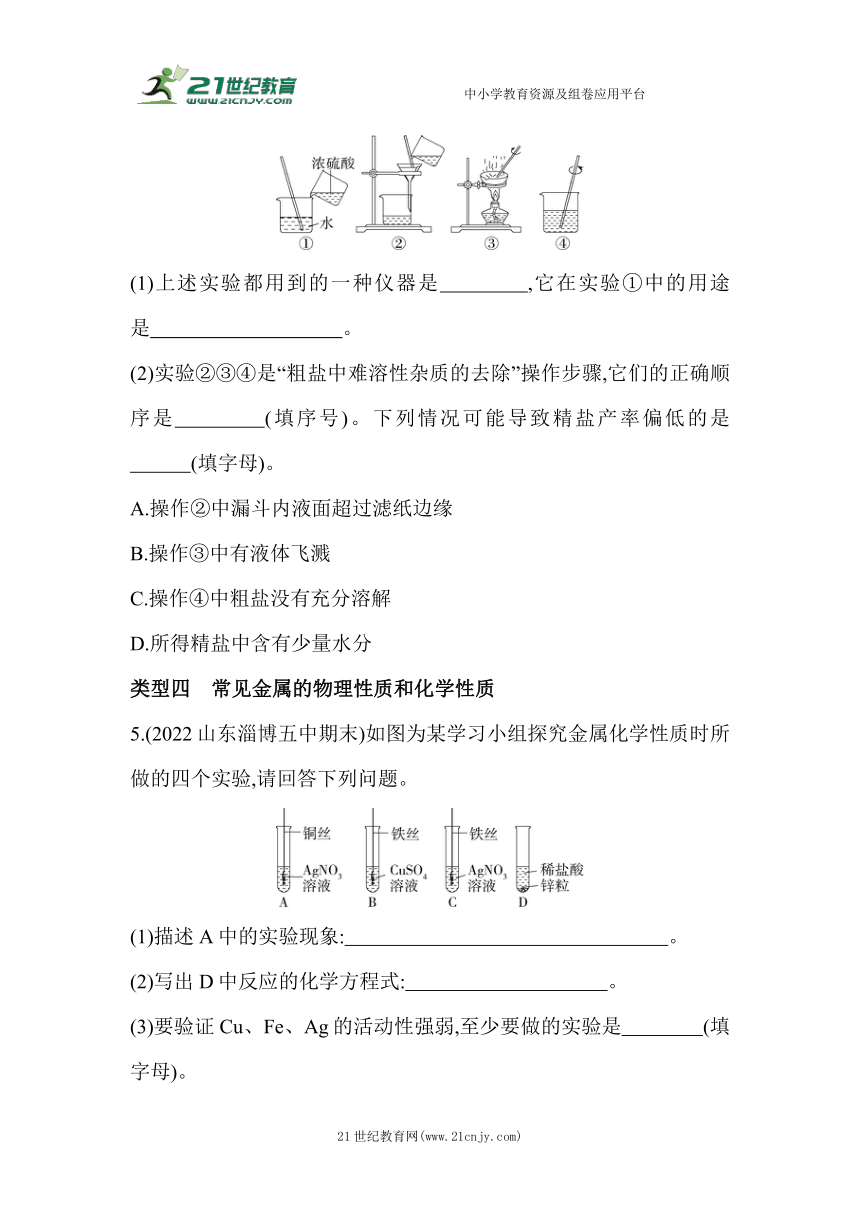
4.(2023山东肥城期中)如图是教材中的常见实验,请回答下列问题。
(1)上述实验都用到的一种仪器是 ,它在实验①中的用途是 。
(2)实验②③④是“粗盐中难溶性杂质的去除”操作步骤,它们的正确顺序是 (填序号)。下列情况可能导致精盐产率偏低的是
(填字母)。
A.操作②中漏斗内液面超过滤纸边缘
B.操作③中有液体飞溅
C.操作④中粗盐没有充分溶解
D.所得精盐中含有少量水分
类型四 常见金属的物理性质和化学性质
5.(2022山东淄博五中期末)如图为某学习小组探究金属化学性质时所做的四个实验,请回答下列问题。
(1)描述A中的实验现象: 。
(2)写出D中反应的化学方程式: 。
(3)要验证Cu、Fe、Ag的活动性强弱,至少要做的实验是 (填字母)。
6.(2022贵州铜仁中考节选)人类的生产、生活离不开金属材料,金属的发现和使用推动了人类社会发展。
某兴趣小组为探究Fe、Cu、R的金属活动性顺序,展开了一系列探究。
【提出问题】如何判断Fe、Cu、R的金属活动性顺序
【猜想与假设】
猜想一:Fe>Cu>R 猜想二:Fe>R>Cu
猜想三:
【进行实验】
实验操作 实验现象 实验结论
猜想二正确
【拓展与应用】为了回收利用金属,同学们将反应后的物质倒入同一容器中,向其中加入过量的铝粉,充分反应后过滤,则滤渣中的金属单质为 。
答案全解全析
1.(1)12 (2)②④⑤③① (3)①偏小 ②继续添加氯化钠 (4)30 g
解析 (1)需要氯化钠的质量为120 g×10%=12 g。(2)配制溶液的一般步骤为计算、称量(量取)、溶解、装瓶,故正确的操作顺序为②④⑤③①。(3)①若量取水的体积时仰视读数,量取的水偏多,则所配制溶液的溶质质量分数会偏小。②若称量氯化钠固体时托盘天平指针向右偏转,说明氯化钠的质量偏少,应该继续添加氯化钠直到天平平衡。(4)溶液稀释前后溶质的质量不变,则需要10%的氯化钠溶液质量为=30 g。
2.(1)红 OH-
(2)a 2NaOH+CO2 Na2CO3+H2O 非金属氧化物
(3)Al(OH)3+3HCl AlCl3+3H2O
(4)Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
(5)有蓝色沉淀生成
解析 (1)氢氧化钠溶液中含有OH-,能使酚酞试液变红。(2)二氧化碳能与氢氧化钠反应,因此a瓶变瘪更明显,反应的化学方程式为CO2+2NaOH Na2CO3+H2O。(3)用含氢氧化铝的药物治疗胃酸过多的反应原理为Al(OH)3+3HCl AlCl3+3H2O。(4)碳酸钠和氢氧化钙反应的化学方程式为Na2CO3+Ca(OH)2 CaCO3↓+2NaOH。(5)氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜蓝色沉淀。
3.(1)红 (2)氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完后,铁与盐酸反应生成氢气,看到产生气泡 (3)NaCl或NaCl和HCl (4)往混合固体中加入足量稀盐酸,然后过滤、洗涤、干燥(合理即可) (5)氢氧化钙溶液显碱性(合理即可)
解析 (1)盐酸为酸性溶液,能使紫色石蕊试液变红。(2)铁锈的主要成分是氧化铁,往生锈的铁钉中加入足量的稀盐酸,表面的氧化铁先与盐酸反应生成氯化铁,然后内部的铁再与盐酸反应生成氢气。(3)往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸,观察到溶液由红色变成无色,说明氢氧化钠全部反应,反应后的溶液可能呈中性或者酸性,因此溶液中的溶质可能只有氯化钠,也可能是氯化钠和氯化氢共同存在。(4)在金属活动性顺序中,铜排在氢之后,因此铜不能与稀盐酸或稀硫酸发生反应,而氧化铜可与稀盐酸和稀硫酸反应,因此可以向混合物中加入足量盐酸或稀硫酸充分反应,然后过滤、洗涤和干燥,得到纯铜。(5)常温下,2 mL水(质量为2 g)不能完全溶解0.02 g氢氧化钙,说明常温下氢氧化钙的溶解度小于1 g,氢氧化钙微溶于水;加入酚酞试液变红,说明氢氧化钙溶液显碱性;加入盐酸后红色消失,说明氢氧化钙可与盐酸反应。
4.(1)玻璃棒 搅拌散热 (2)④②③ BC
解析 (1)据图示可知,图中实验中都用到了玻璃棒;在稀释浓硫酸时,玻璃棒的作用是搅拌散热。(2)除去粗盐中难溶性杂质的操作步骤是溶解、过滤、蒸发,故顺序是④②③。A项,过滤时漏斗内液面超过滤纸边缘,会造成泥沙等进入精盐中,而使精盐的产率偏高;B项,蒸发时有液体飞溅,会导致得到的精盐的质量偏小,而使精盐的产率偏低;C项,溶解时粗盐未充分溶解,会导致得到的精盐的质量偏小,而使精盐的产率偏低;D项,所得精盐中含有少量水分,会造成称得的精盐的质量偏大,而使精盐的产率偏高。
5.(1)铜丝表面附着一层银白色固体,无色溶液逐渐变为蓝色 (2)Zn+2HCl ZnCl2+H2↑ (3)AB
解析 (3)A实验中铜与硝酸银反应,说明铜的活动性比银强;B实验中铁和硫酸铜反应,说明铁的活动性比铜强,通过这两个实验就可验证三种金属的活动性顺序为Fe>Cu>Ag。
6.【猜想与假设】R>Fe>Cu 【进行实验】将打磨过的R分别放入盛有硫酸亚铁溶液和硫酸铜溶液的试管中 在硫酸亚铁溶液内R无明显变化,在硫酸铜溶液内R表面有红色固体析出
【拓展与应用】Al、Fe、R、Cu
解析 【进行实验】根据实验结论可知,三种金属的活动性顺序为Fe>R>Cu,故可将R分别放入盛有硫酸亚铁溶液(或其他可溶性亚铁盐溶液)和硫酸铜溶液(或其他可溶性铜盐溶液)的试管中,实验现象为R在硫酸亚铁溶液中无明显变化,在硫酸铜溶液中析出红色固体。
21世纪教育网(www.21cnjy.com)
专项素养综合全练(五)
课标必做实验
类型一 一定溶质质量分数的氯化钠溶液的配制
1.某同学欲配制120 g质量分数为10%的氯化钠溶液,请回答下列问题:
(1)需称取氯化钠的质量为 g。
(2)图示操作中,正确的操作顺序为 (填序号)。
(3)①若其他操作均正确,量取水的体积时仰视读数,则所配制溶液的溶质质量分数 (填“偏大”“偏小”或“无影响”)。
②若称量氯化钠固体时托盘天平指针向右偏转,则应 直到天平平衡。
(4)欲配制60 g质量分数为5%的氯化钠溶液,需要10%的氯化钠溶液的质量为 。
类型二 常见酸、碱的化学性质
2.(2022吉林长春南湖实验中学期末)为探究碱的相关性质,设计实验如下:
(1)实验一能够观察到的明显现象是溶液由无色变为 色,能使酚酞试液变色的离子是 (填离子符号);
(2)实验二为用软矿泉水瓶所做的对比实验,软矿泉水瓶 (填“a”或“b”)变瘪更明显,原因是 (用化学方程式表示),该实验验证了可溶性碱能够与 (填“金属氧化物”或“非金属氧化物”)反应;
(3)实验三体现了用含氢氧化铝的药物治疗胃酸过多的反应原理,反应的化学方程式为 ;
(4)实验四中发生反应的化学方程式为 ;
(5)实验五中,向过量氢氧化钠溶液中滴入几滴硫酸铜溶液,现象是 。
3.(2021湖南长沙中考)为加深对酸的主要性质的认识,通过实验解释生活中的一些现象。在学完酸的化学性质后,老师组织同学们完成了以下实验活动。
【实验内容与分析】
实验一:按下图所示完成实验。
实验二:往生锈的铁钉中加入足量的稀盐酸。
实验三:往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸。
实验四:往5.3克Na2CO3粉末中加入足量的稀盐酸。
(1)实验一中,观察到石蕊试液变 色。
(2)实验二中,观察到溶液由无色变成黄色,一段时间后有气泡产生,请解释出现这两个现象的原因: 。
(3)实验三中,观察到溶液由红色变成无色,由此现象分析,反应后所得溶液中,溶质成分的可能组合有(不考虑酚酞)
(用化学式表示)。
【应用与拓展】
(4)结合以上实验内容,请设计实验方案除去铜粉中混有的氧化铜,得到纯净的铜: 。
(5)小明在征得老师的同意后,继续进行了下图所示实验。
由上述实验可以得出氢氧化钙的哪些性质: (写一条)。
类型三 粗盐中难溶性杂质的去除
4.(2023山东肥城期中)如图是教材中的常见实验,请回答下列问题。
(1)上述实验都用到的一种仪器是 ,它在实验①中的用途是 。
(2)实验②③④是“粗盐中难溶性杂质的去除”操作步骤,它们的正确顺序是 (填序号)。下列情况可能导致精盐产率偏低的是
(填字母)。
A.操作②中漏斗内液面超过滤纸边缘
B.操作③中有液体飞溅
C.操作④中粗盐没有充分溶解
D.所得精盐中含有少量水分
类型四 常见金属的物理性质和化学性质
5.(2022山东淄博五中期末)如图为某学习小组探究金属化学性质时所做的四个实验,请回答下列问题。
(1)描述A中的实验现象: 。
(2)写出D中反应的化学方程式: 。
(3)要验证Cu、Fe、Ag的活动性强弱,至少要做的实验是 (填字母)。
6.(2022贵州铜仁中考节选)人类的生产、生活离不开金属材料,金属的发现和使用推动了人类社会发展。
某兴趣小组为探究Fe、Cu、R的金属活动性顺序,展开了一系列探究。
【提出问题】如何判断Fe、Cu、R的金属活动性顺序
【猜想与假设】
猜想一:Fe>Cu>R 猜想二:Fe>R>Cu
猜想三:
【进行实验】
实验操作 实验现象 实验结论
猜想二正确
【拓展与应用】为了回收利用金属,同学们将反应后的物质倒入同一容器中,向其中加入过量的铝粉,充分反应后过滤,则滤渣中的金属单质为 。
答案全解全析
1.(1)12 (2)②④⑤③① (3)①偏小 ②继续添加氯化钠 (4)30 g
解析 (1)需要氯化钠的质量为120 g×10%=12 g。(2)配制溶液的一般步骤为计算、称量(量取)、溶解、装瓶,故正确的操作顺序为②④⑤③①。(3)①若量取水的体积时仰视读数,量取的水偏多,则所配制溶液的溶质质量分数会偏小。②若称量氯化钠固体时托盘天平指针向右偏转,说明氯化钠的质量偏少,应该继续添加氯化钠直到天平平衡。(4)溶液稀释前后溶质的质量不变,则需要10%的氯化钠溶液质量为=30 g。
2.(1)红 OH-
(2)a 2NaOH+CO2 Na2CO3+H2O 非金属氧化物
(3)Al(OH)3+3HCl AlCl3+3H2O
(4)Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
(5)有蓝色沉淀生成
解析 (1)氢氧化钠溶液中含有OH-,能使酚酞试液变红。(2)二氧化碳能与氢氧化钠反应,因此a瓶变瘪更明显,反应的化学方程式为CO2+2NaOH Na2CO3+H2O。(3)用含氢氧化铝的药物治疗胃酸过多的反应原理为Al(OH)3+3HCl AlCl3+3H2O。(4)碳酸钠和氢氧化钙反应的化学方程式为Na2CO3+Ca(OH)2 CaCO3↓+2NaOH。(5)氢氧化钠与硫酸铜反应生成硫酸钠和氢氧化铜蓝色沉淀。
3.(1)红 (2)氧化铁与盐酸反应生成氯化铁,此时溶液变为黄色,氧化铁反应完后,铁与盐酸反应生成氢气,看到产生气泡 (3)NaCl或NaCl和HCl (4)往混合固体中加入足量稀盐酸,然后过滤、洗涤、干燥(合理即可) (5)氢氧化钙溶液显碱性(合理即可)
解析 (1)盐酸为酸性溶液,能使紫色石蕊试液变红。(2)铁锈的主要成分是氧化铁,往生锈的铁钉中加入足量的稀盐酸,表面的氧化铁先与盐酸反应生成氯化铁,然后内部的铁再与盐酸反应生成氢气。(3)往滴有酚酞的氢氧化钠溶液中加入一定量的稀盐酸,观察到溶液由红色变成无色,说明氢氧化钠全部反应,反应后的溶液可能呈中性或者酸性,因此溶液中的溶质可能只有氯化钠,也可能是氯化钠和氯化氢共同存在。(4)在金属活动性顺序中,铜排在氢之后,因此铜不能与稀盐酸或稀硫酸发生反应,而氧化铜可与稀盐酸和稀硫酸反应,因此可以向混合物中加入足量盐酸或稀硫酸充分反应,然后过滤、洗涤和干燥,得到纯铜。(5)常温下,2 mL水(质量为2 g)不能完全溶解0.02 g氢氧化钙,说明常温下氢氧化钙的溶解度小于1 g,氢氧化钙微溶于水;加入酚酞试液变红,说明氢氧化钙溶液显碱性;加入盐酸后红色消失,说明氢氧化钙可与盐酸反应。
4.(1)玻璃棒 搅拌散热 (2)④②③ BC
解析 (1)据图示可知,图中实验中都用到了玻璃棒;在稀释浓硫酸时,玻璃棒的作用是搅拌散热。(2)除去粗盐中难溶性杂质的操作步骤是溶解、过滤、蒸发,故顺序是④②③。A项,过滤时漏斗内液面超过滤纸边缘,会造成泥沙等进入精盐中,而使精盐的产率偏高;B项,蒸发时有液体飞溅,会导致得到的精盐的质量偏小,而使精盐的产率偏低;C项,溶解时粗盐未充分溶解,会导致得到的精盐的质量偏小,而使精盐的产率偏低;D项,所得精盐中含有少量水分,会造成称得的精盐的质量偏大,而使精盐的产率偏高。
5.(1)铜丝表面附着一层银白色固体,无色溶液逐渐变为蓝色 (2)Zn+2HCl ZnCl2+H2↑ (3)AB
解析 (3)A实验中铜与硝酸银反应,说明铜的活动性比银强;B实验中铁和硫酸铜反应,说明铁的活动性比铜强,通过这两个实验就可验证三种金属的活动性顺序为Fe>Cu>Ag。
6.【猜想与假设】R>Fe>Cu 【进行实验】将打磨过的R分别放入盛有硫酸亚铁溶液和硫酸铜溶液的试管中 在硫酸亚铁溶液内R无明显变化,在硫酸铜溶液内R表面有红色固体析出
【拓展与应用】Al、Fe、R、Cu
解析 【进行实验】根据实验结论可知,三种金属的活动性顺序为Fe>R>Cu,故可将R分别放入盛有硫酸亚铁溶液(或其他可溶性亚铁盐溶液)和硫酸铜溶液(或其他可溶性铜盐溶液)的试管中,实验现象为R在硫酸亚铁溶液中无明显变化,在硫酸铜溶液中析出红色固体。
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
