4.4 化学方程式 同步练习-2023-2024学年九年级化学上册 科粤版(2012)
文档属性
| 名称 | 4.4 化学方程式 同步练习-2023-2024学年九年级化学上册 科粤版(2012) |

|
|
| 格式 | docx | ||
| 文件大小 | 458.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-14 00:00:00 | ||
图片预览

文档简介
4.4 化学方程式
一、单选题
1.下列化学方程式书写正确的是
A. B.
C. D.
2.某汽车尾气净化转化器如图1所示,其内部设计为蜂窝状陶瓷结构,表面附着的催化剂催化CO、NOX等有害气体转化为无污染的气体,其中发生的某化学反应I的微观示意图见图2。下列说法中不正确的是
A.蜂窝状陶瓷结构能增大反应物与催化剂的接触面积
B.反应I中分子个数会减少
C.反应I中氮元素的化合价发生了变化
D.反应I中两种生成物的质量比为7:11或11:7
3.火箭用偏二甲肼(C2H8N2)和四氧化二氮反应生成氮气、二氧化碳和水并释放能量,推动火箭升空。下列有关该反应的说法正确的是
A.偏二甲肼(C2H8N2)和四氧化二氮反应是吸热反应
B.该反应方程式表示为:
C.该反应中生成物对环境没有污染
D.该反应中生成氮气和二氧化碳的计量数比为1:2
4.已知 2NaClO3+H2SO4+SO2===2X+2NaHSO4 由此可知X物质的化学式为
A.ClO2 B.NaCl C.NaClO D.Cl2O
5.下列反应的化学方程式书写正确的是
A.常温下铝表面氧化膜的生成:4Al+3O2=2Al2O3
B.铁与稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
C.用红磷测定空气中氧气的含量:4P+3O22P2O3
D.洗去石灰水试剂瓶内壁附着的固体:CaO+2HCl=CaCl2+H2O
6.10g石灰石样品,与足量的稀盐酸充分的反应,产生CO2的质量为4g,则样品中混有下列哪种物质( )
A.MgCO3 B.KHCO3 C.NaHCO3 D.K2CO3
7.红磷在氧气中燃烧,生成五氧化二磷,在该反应中红磷、氧气、五氧化二磷的质量比是
A.4:5:2 B.124:160:284 C.31:32:64 D.3l:32:142
8.2022年8月9日,《2022年芯片和科学法案》由美国总统拜登签署生效,硅是现代计算机芯片的基础,工业上制粗硅的反应原理是:2C+SiO2Si+2X,其中X的化学式是
A.CO2 B.H2O C.SiH4 D.CO
二、填空题
9.写出下列反应的化学方程式及(1)(2)的反应类型。
(1)加热氧化汞: ; ;
(2)红磷在氧气中燃烧: ; ;
(3)细铁丝在氧气中燃烧: 。
10.如图是氢气在氯气中燃烧生成氯化氢气体的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A中两种分子的相同点是 ;
(3)氢原子和某原子能形成A2B型分子,且该原子与氧原子的化学性质相似。则该原子的原子结构示意图为 。
11.在电解水的实验中,两电极相连的玻璃管上方产生的气体是 和 二者的体积比为 ,该反应的化学方程式为
三、实验题
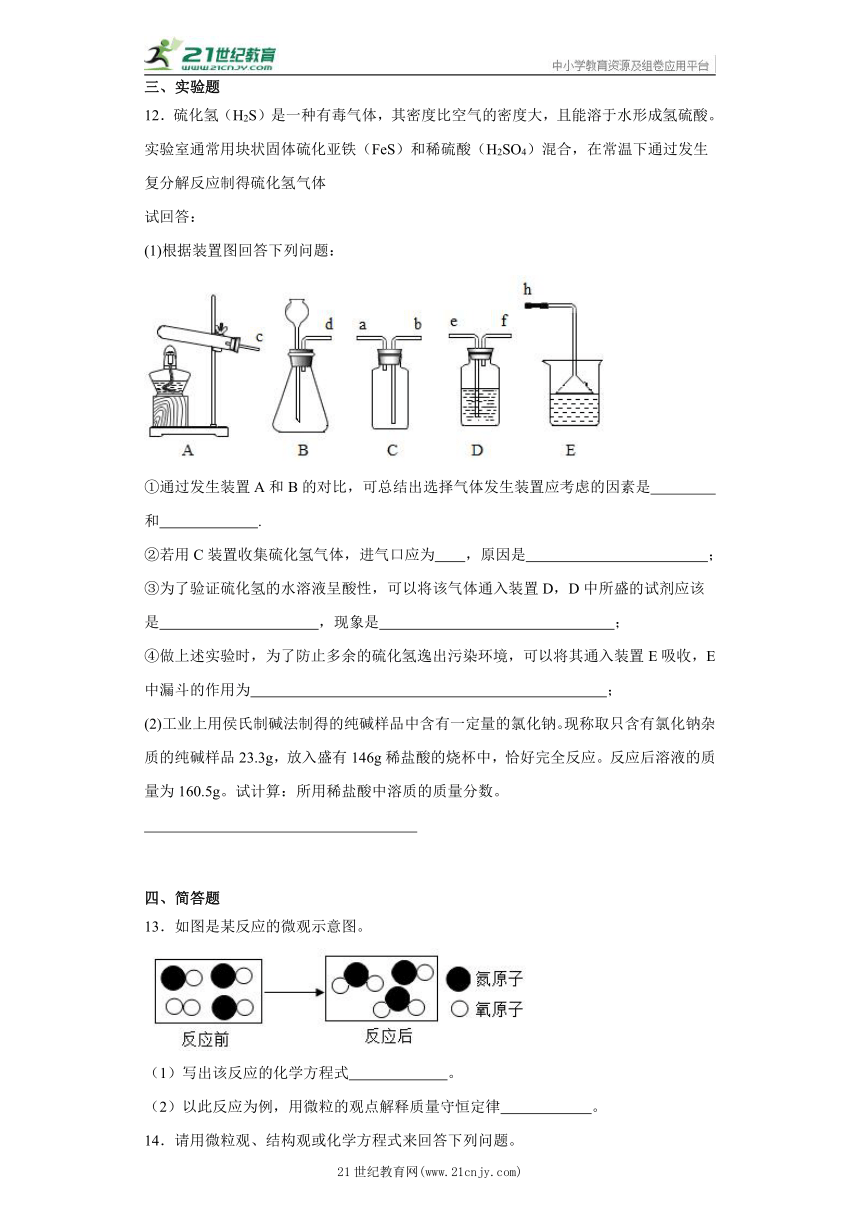
12.硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)混合,在常温下通过发生复分解反应制得硫化氢气体
试回答:
(1)根据装置图回答下列问题:
①通过发生装置A和B的对比,可总结出选择气体发生装置应考虑的因素是 和 .
②若用C装置收集硫化氢气体,进气口应为 ,原因是 ;
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是 ,现象是 ;
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中漏斗的作用为 ;
(2)工业上用侯氏制碱法制得的纯碱样品中含有一定量的氯化钠。现称取只含有氯化钠杂质的纯碱样品23.3g,放入盛有146g稀盐酸的烧杯中,恰好完全反应。反应后溶液的质量为160.5g。试计算:所用稀盐酸中溶质的质量分数。
四、简答题
13.如图是某反应的微观示意图。
(1)写出该反应的化学方程式 。
(2)以此反应为例,用微粒的观点解释质量守恒定律 。
14.请用微粒观、结构观或化学方程式来回答下列问题。
(1)不同元素的本质区别 。
(2)与原子的化学性质关系最密切的是 。
(3)硫酸铜溶液不能盛放在铁桶中 。
五、科学探究题
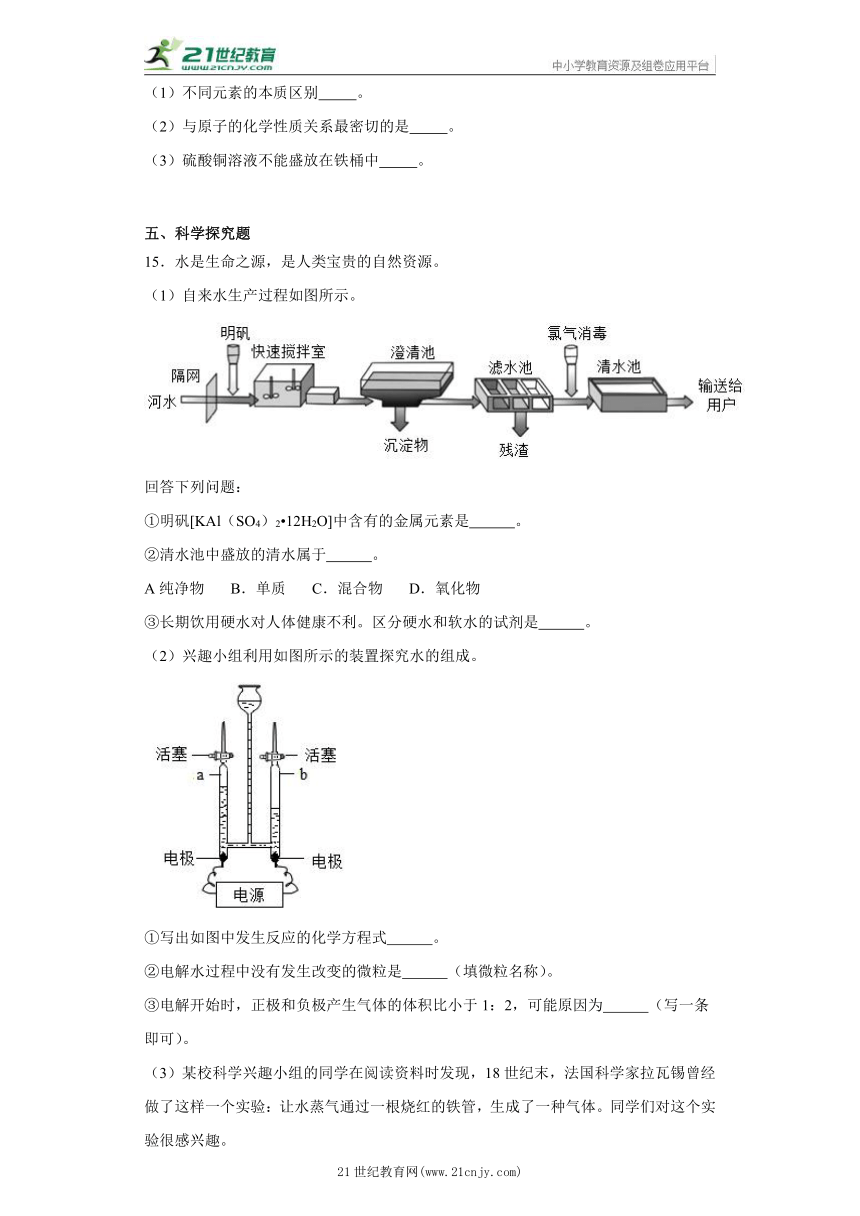
15.水是生命之源,是人类宝贵的自然资源。
(1)自来水生产过程如图所示。
回答下列问题:
①明矾[KAl(SO4)2 12H2O]中含有的金属元素是 。
②清水池中盛放的清水属于 。
A纯净物 B.单质 C.混合物 D.氧化物
③长期饮用硬水对人体健康不利。区分硬水和软水的试剂是 。
(2)兴趣小组利用如图所示的装置探究水的组成。
①写出如图中发生反应的化学方程式 。
②电解水过程中没有发生改变的微粒是 (填微粒名称)。
③电解开始时,正极和负极产生气体的体积比小于1:2,可能原因为 (写一条即可)。
(3)某校科学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样一个实验:让水蒸气通过一根烧红的铁管,生成了一种气体。同学们对这个实验很感兴趣。
【问题】红热的铁与水蒸气反应生成的气体是什么?
【猜想】猜想一:生成的气体可能是氧气。
猜想二:生成的气体可能是氢气。
【探究】为验证生成的气体是什么,该组同学在老师的指导下,设计了如图实验装置,并收集反应产生的气体(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
A试管内装有铁粉,B烧瓶中装有一定量的水,提供反应所需水蒸气。
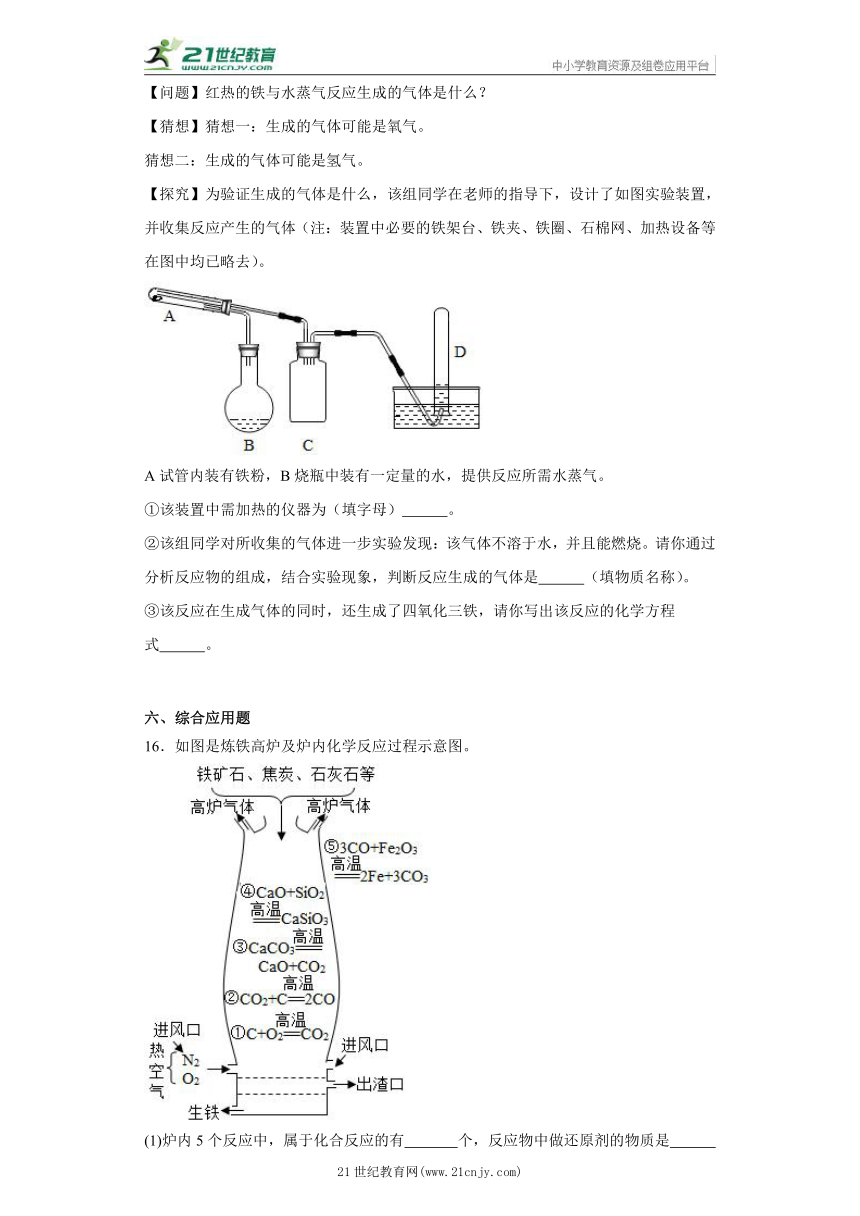
①该装置中需加热的仪器为(填字母) 。
②该组同学对所收集的气体进一步实验发现:该气体不溶于水,并且能燃烧。请你通过分析反应物的组成,结合实验现象,判断反应生成的气体是 (填物质名称)。
③该反应在生成气体的同时,还生成了四氧化三铁,请你写出该反应的化学方程式 。
六、综合应用题
16.如图是炼铁高炉及炉内化学反应过程示意图。
(1)炉内5个反应中,属于化合反应的有 个,反应物中做还原剂的物质是 (填写化学式);
(2)热空气和高炉气体中有一种相同的主要气体,该气体的化学式是 ;
(3)某工厂欲制得560t铁,理论上需要含氧化铁80%的赤铁矿石的质量是多少?
解:设制得560t铁,理论上需要氧化铁的质量为x。
找出对应关系,写出相关的量
列出比例式
求解。
折合为含氧化铁80%的赤铁矿石的质量是 t。
答:(略)。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
参考答案:
1.D
【详解】A、铁在氧气中燃烧应生成四氧化三铁,方程式不符合科学事实,不符合题意;
B、氢氧化钙与二氧化碳反应生成的碳酸钙不溶于水,缺少沉淀符号,不符合题意;
C、锌与稀硫酸反应生成硫酸锌和氢气,氢气为气体,缺少气体符号,不符合题意;
D、碳酸钠与硫酸反应生成硫酸钠,水和二氧化碳,符合题意;
故选D。
2.D
【详解】A、蜂窝状陶瓷结构能增大反应物与催化剂的接触面积,该选项说法正确;
B、由图可知,反应Ⅰ为NO和CO在催化剂条件下反应生成N2和CO2,反应的方程式为,则每2个2氧化碳分子和2个一氧化氮分子反应生成1个氮分子和2个二氧化碳分子,分子个数减少,该选项说法正确;
C、反应前,NO中氧元素化合价为-2价,根据“化合物中各元素化合价代数和为零”,则氮元素化合价为+2价,反应后N2中氮元素化合价为0,则氮元素化合价改变,该选项说法不正确;
反应Ⅰ中生成物的质量比为(14×2):[2×(12+16×2)]=7:22,该选项说法不正确。
故选D。
3.C
【详解】A、偏二甲肼和四氧化二氮反应生成氮气、二氧化碳和水并释放能量,推动火箭升空,即偏二甲肼和四氧化二氮反应是放热反应,选项错误;
B、偏二甲肼和四氧化二氮反应生成氮气、二氧化碳和水,则反应的化学方程式写为:C2H8N2+2N2O4=3N2+2CO2+4H2O,选项错误;
C、偏二甲肼和四氧化二氮反应生成氮气、二氧化碳和水,生成物氮气、二氧化碳和水都是空气的组成成分,不会污染环境,选项正确;
D、由化学方程式可知,该反应中生成氮气和二氧化碳的计量数比为3:2,选项错误。
故选C。
4.A
【详解】由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2NaClO3+H2SO4+SO2═2X+2NaHSO4,反应前钠、氯、氧、氢、硫原子个数分别为2、2、6、10、2、2,反应后的生成物中钠、氯、氧、氢、硫原子个数分别为2、0、8、2、2,根据反应前后原子种类、数目不变,则,2X分子中含有2个氯原子和4个氧原子,则每个X分子由1个氯原子和2个氧原子构成,则物质X的化学式为ClO2。故选A。
5.A
【详解】B. 铁与稀盐酸反应生成氯化亚铁:Fe+2HCl=2FeCl2+H2↑C. 用红磷测定空气中氧气的含量:磷燃烧生成五氧化二磷,4P+5O2点燃2P2O5D.石灰水瓶壁上的白色固体是氢氧化钙与二氧化碳生成的碳酸钙沉淀, 洗去石灰水试剂瓶内壁附着的固体:CaCO3+2HCl=CaCl2+H2O+CO2↑选A
6.D
【详解】解:设混合物的相对分子质量为x,
x=110;
而碳酸钙的相对分子质量为100,所以所含的杂质为一种时,应该相对分子质量大于110,在给定选项中碳酸镁的相对分子质量为84,碳酸氢钾的相对分子质量为100,碳酸氢钠的相对分子质量为84,而碳酸钾的相对分子质量为138。
故选D。
【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
7.B
【详解】利用质量守恒定律的技巧解法,根据质量质量守恒定律,反应物质量和与生成物质量和应相等,因此质量比中反应物磷、氧气的和等于生成物五氧化二磷的量,则只有选项D中满足124+160=284。故选B。
8.D
【详解】根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含C、Si、O的个数分别是2、1、2,生成物中含C、Si、O的个数分别是0、1、0,故生成物中还应含2个C、2个O,故X的化学式为:CO。
故选D。
9.(1) 2HgO 2Hg+O2↑ 分解反应
(2) 4P+5O22P2O5 化合反应
(3)3Fe+2O2Fe3O4
【详解】(1)加热氧化汞生成汞和氧气,反应的化学方程式为:2HgO 2Hg+O2↑;该反应是由一种物质生两种物质的反应,属于分解反应;
(2)红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O22P2O5;该反应是由两种物质生成一种物质的反应,属于化合反应;
(3)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2Fe3O4。
10. 它们的每个分子都是由2个原子构成的
【分析】根据质量守恒定律,反应前后原子种类不变,原子个数相同。
【详解】(1)由质量守恒定律反应前后原子的种类及数目不变可知,在B图中补出两个氯化氢分子即可,如图:
;
(2)由图示中微粒的构成可以得出,A中两种分子的相同点是:它们的每个分子都是由2个原子构成的。
(3)氢原子和某原子能形成A2B型分子,且该原子与氧原子的化学性质相似,则该原子应是硫原子,原子结构示意图为: 。
【点睛】最外层电子数相同,化学性质相似,组成化合物的各元素的化合价代数和为零。
11. 氢气 氧气 2:1 2H2O2H2↑+O2↑
【详解】电解水生成氢气和氧气,体积比氢气比氧气2:1,化学方程式2H2O2H2↑+O2↑,故填:氢气;氧气;2:1;2H2O2H2↑+O2↑。
12.(1) 反应物的状态 反应条件 b 硫化氢气体密度比空气大 紫色石蕊溶液 紫色石蕊溶液变红 防止烧杯里的液体倒吸
(2)10%
【详解】(1)①通过发生装置A和B的对比,选择气体发生装置应考虑的因素是反应物的状态和反应条件;
②用C装置收集硫化氢气体,进气口应为b;原因为硫化氢气体密度比空气大;
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是紫色石蕊溶液,现象是紫色石蕊溶液变红;
④导管末端的漏斗与液体接触面积较大,当气体被吸收时,装置E内液面下降,罩在液面上的漏斗与液体脱离,在重力作用下吸入漏斗内的液体回落到装置E中,从而起到防止液体的倒吸;故答案为:防止烧杯里的液体倒吸。
(2)解:设盐酸中HCl的质量为x,碳酸钠的质量为y
生成CO2的质量为:23.3g+146g-160.9g=8.8g
x=14.6g y=21.2g
盐酸中溶质的的质量分数=
答:样品中Na2CO3的质量为21.2g,盐酸中溶质的质量分数为10%。
13. 2NO+O2═2NO2; 在化学反应前后,原子的种类、数目、质量不变,所以化学反应前后质量守恒。
【详解】(1)该反应是一氧化氮燃烧生成了二氧化氮,反应的化学方程式是:2NO+O2═2NO2;
(2)由微粒的变化可知,在化学反应前后,原子的种类、数目、质量不变,所以化学反应前后质量守恒。
14. 质子数不同 最外层电子数 Fe+CuSO4═FeSO4+Cu
【详解】(1)元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同;
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似;
(3)铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
15. 钾、铝 C 肥皂水 氢原子、氧原子 氧气较氢气在水中溶解度大 AB 氢气
【详解】(1)①明矾[KAl(SO4)2 12H2O]中含有的金属元素是钾(K)、铝(Al)元素。
②清水池中盛放的清水中含有许多可溶性物质,属于混合物;故选D。
③硬水是含较多可溶性钙、镁矿物质的水;鉴别硬水和软水可以使用肥皂水,泡沫较少浮渣较多的是硬水,泡沫较多浮渣较少的是软水,故可用肥皂水鉴别硬水和软水。
(2)①水通电生成氢气和氧气,。
②原子是化学变化中最小的粒子,电解水过程中没有发生改变的微粒是氢原子、氧原子。
③电解开始时,正极和负极产生气体的体积比小于1:2,可能原因为氧气较氢气在水中溶解度大,导致氧气体积体积相对较小。
(3)①水蒸气通过一根烧红的铁管,生成了一种气体,则需要水蒸气,铁也需要加热,则该装置中需加热的仪器为AB。
②反应前后元素种类不变,反应前有铁、氢、氧元素,生成气体不溶于水,并且能燃烧,可判断反应生成的气体是氢气。
③水蒸气和铁在高温的条件下反应生成四氧化三铁和氢气, 。
16.(1) 三/3 C、CO
(2)N2
(3)
1000
【详解】(1)①是两种物质反应生成一种物质,符合多变一的特点,属于化合反应;
②是两种两种物质反应生成一种物质,符合多变一的特点,属于化合反应;
③是一种物质生成两种物质,符合一变多的特点,属于分解反应;
④是两种物质反应生成一种物质,符合多变一的特点,属于化合反应;
⑤是两种物质反应生成两种物质,不属于化合反应;
故炉内5个反应中,属于化合反应的有①②④,有3个;
在氧化还原反应中能够得氧的物质为还原剂,在反应①②中C作还原剂,反应④中CO作还原剂;故反应物中做还原剂的是C、CO;
(2)热空气的主要成分是氧气和氮气,在高炉炼铁的过程中氮气不参加反应,因此热空气和高炉气体中有一种相同的主要气体,该气体的化学式为N2;
(3)解:设制得560t铁,理论上需要氧化铁的质量为x
找出对应关系,写出相关的量,
折合为含氧化铁80%的赤铁矿石的质量是
答:理论上需要含氧化铁80%的赤铁矿石的质量是1000t。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
一、单选题
1.下列化学方程式书写正确的是
A. B.
C. D.
2.某汽车尾气净化转化器如图1所示,其内部设计为蜂窝状陶瓷结构,表面附着的催化剂催化CO、NOX等有害气体转化为无污染的气体,其中发生的某化学反应I的微观示意图见图2。下列说法中不正确的是
A.蜂窝状陶瓷结构能增大反应物与催化剂的接触面积
B.反应I中分子个数会减少
C.反应I中氮元素的化合价发生了变化
D.反应I中两种生成物的质量比为7:11或11:7
3.火箭用偏二甲肼(C2H8N2)和四氧化二氮反应生成氮气、二氧化碳和水并释放能量,推动火箭升空。下列有关该反应的说法正确的是
A.偏二甲肼(C2H8N2)和四氧化二氮反应是吸热反应
B.该反应方程式表示为:
C.该反应中生成物对环境没有污染
D.该反应中生成氮气和二氧化碳的计量数比为1:2
4.已知 2NaClO3+H2SO4+SO2===2X+2NaHSO4 由此可知X物质的化学式为
A.ClO2 B.NaCl C.NaClO D.Cl2O
5.下列反应的化学方程式书写正确的是
A.常温下铝表面氧化膜的生成:4Al+3O2=2Al2O3
B.铁与稀盐酸反应:2Fe+6HCl=2FeCl3+3H2↑
C.用红磷测定空气中氧气的含量:4P+3O22P2O3
D.洗去石灰水试剂瓶内壁附着的固体:CaO+2HCl=CaCl2+H2O
6.10g石灰石样品,与足量的稀盐酸充分的反应,产生CO2的质量为4g,则样品中混有下列哪种物质( )
A.MgCO3 B.KHCO3 C.NaHCO3 D.K2CO3
7.红磷在氧气中燃烧,生成五氧化二磷,在该反应中红磷、氧气、五氧化二磷的质量比是
A.4:5:2 B.124:160:284 C.31:32:64 D.3l:32:142
8.2022年8月9日,《2022年芯片和科学法案》由美国总统拜登签署生效,硅是现代计算机芯片的基础,工业上制粗硅的反应原理是:2C+SiO2Si+2X,其中X的化学式是
A.CO2 B.H2O C.SiH4 D.CO
二、填空题
9.写出下列反应的化学方程式及(1)(2)的反应类型。
(1)加热氧化汞: ; ;
(2)红磷在氧气中燃烧: ; ;
(3)细铁丝在氧气中燃烧: 。
10.如图是氢气在氯气中燃烧生成氯化氢气体的微观模拟图,请回答下列问题:
(1)在B图中将相关粒子图形补充完整;
(2)A中两种分子的相同点是 ;
(3)氢原子和某原子能形成A2B型分子,且该原子与氧原子的化学性质相似。则该原子的原子结构示意图为 。
11.在电解水的实验中,两电极相连的玻璃管上方产生的气体是 和 二者的体积比为 ,该反应的化学方程式为
三、实验题
12.硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)混合,在常温下通过发生复分解反应制得硫化氢气体
试回答:
(1)根据装置图回答下列问题:
①通过发生装置A和B的对比,可总结出选择气体发生装置应考虑的因素是 和 .
②若用C装置收集硫化氢气体,进气口应为 ,原因是 ;
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是 ,现象是 ;
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中漏斗的作用为 ;
(2)工业上用侯氏制碱法制得的纯碱样品中含有一定量的氯化钠。现称取只含有氯化钠杂质的纯碱样品23.3g,放入盛有146g稀盐酸的烧杯中,恰好完全反应。反应后溶液的质量为160.5g。试计算:所用稀盐酸中溶质的质量分数。
四、简答题
13.如图是某反应的微观示意图。
(1)写出该反应的化学方程式 。
(2)以此反应为例,用微粒的观点解释质量守恒定律 。
14.请用微粒观、结构观或化学方程式来回答下列问题。
(1)不同元素的本质区别 。
(2)与原子的化学性质关系最密切的是 。
(3)硫酸铜溶液不能盛放在铁桶中 。
五、科学探究题
15.水是生命之源,是人类宝贵的自然资源。
(1)自来水生产过程如图所示。
回答下列问题:
①明矾[KAl(SO4)2 12H2O]中含有的金属元素是 。
②清水池中盛放的清水属于 。
A纯净物 B.单质 C.混合物 D.氧化物
③长期饮用硬水对人体健康不利。区分硬水和软水的试剂是 。
(2)兴趣小组利用如图所示的装置探究水的组成。
①写出如图中发生反应的化学方程式 。
②电解水过程中没有发生改变的微粒是 (填微粒名称)。
③电解开始时,正极和负极产生气体的体积比小于1:2,可能原因为 (写一条即可)。
(3)某校科学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样一个实验:让水蒸气通过一根烧红的铁管,生成了一种气体。同学们对这个实验很感兴趣。
【问题】红热的铁与水蒸气反应生成的气体是什么?
【猜想】猜想一:生成的气体可能是氧气。
猜想二:生成的气体可能是氢气。
【探究】为验证生成的气体是什么,该组同学在老师的指导下,设计了如图实验装置,并收集反应产生的气体(注:装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
A试管内装有铁粉,B烧瓶中装有一定量的水,提供反应所需水蒸气。
①该装置中需加热的仪器为(填字母) 。
②该组同学对所收集的气体进一步实验发现:该气体不溶于水,并且能燃烧。请你通过分析反应物的组成,结合实验现象,判断反应生成的气体是 (填物质名称)。
③该反应在生成气体的同时,还生成了四氧化三铁,请你写出该反应的化学方程式 。
六、综合应用题
16.如图是炼铁高炉及炉内化学反应过程示意图。
(1)炉内5个反应中,属于化合反应的有 个,反应物中做还原剂的物质是 (填写化学式);
(2)热空气和高炉气体中有一种相同的主要气体,该气体的化学式是 ;
(3)某工厂欲制得560t铁,理论上需要含氧化铁80%的赤铁矿石的质量是多少?
解:设制得560t铁,理论上需要氧化铁的质量为x。
找出对应关系,写出相关的量
列出比例式
求解。
折合为含氧化铁80%的赤铁矿石的质量是 t。
答:(略)。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
参考答案:
1.D
【详解】A、铁在氧气中燃烧应生成四氧化三铁,方程式不符合科学事实,不符合题意;
B、氢氧化钙与二氧化碳反应生成的碳酸钙不溶于水,缺少沉淀符号,不符合题意;
C、锌与稀硫酸反应生成硫酸锌和氢气,氢气为气体,缺少气体符号,不符合题意;
D、碳酸钠与硫酸反应生成硫酸钠,水和二氧化碳,符合题意;
故选D。
2.D
【详解】A、蜂窝状陶瓷结构能增大反应物与催化剂的接触面积,该选项说法正确;
B、由图可知,反应Ⅰ为NO和CO在催化剂条件下反应生成N2和CO2,反应的方程式为,则每2个2氧化碳分子和2个一氧化氮分子反应生成1个氮分子和2个二氧化碳分子,分子个数减少,该选项说法正确;
C、反应前,NO中氧元素化合价为-2价,根据“化合物中各元素化合价代数和为零”,则氮元素化合价为+2价,反应后N2中氮元素化合价为0,则氮元素化合价改变,该选项说法不正确;
反应Ⅰ中生成物的质量比为(14×2):[2×(12+16×2)]=7:22,该选项说法不正确。
故选D。
3.C
【详解】A、偏二甲肼和四氧化二氮反应生成氮气、二氧化碳和水并释放能量,推动火箭升空,即偏二甲肼和四氧化二氮反应是放热反应,选项错误;
B、偏二甲肼和四氧化二氮反应生成氮气、二氧化碳和水,则反应的化学方程式写为:C2H8N2+2N2O4=3N2+2CO2+4H2O,选项错误;
C、偏二甲肼和四氧化二氮反应生成氮气、二氧化碳和水,生成物氮气、二氧化碳和水都是空气的组成成分,不会污染环境,选项正确;
D、由化学方程式可知,该反应中生成氮气和二氧化碳的计量数比为3:2,选项错误。
故选C。
4.A
【详解】由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2NaClO3+H2SO4+SO2═2X+2NaHSO4,反应前钠、氯、氧、氢、硫原子个数分别为2、2、6、10、2、2,反应后的生成物中钠、氯、氧、氢、硫原子个数分别为2、0、8、2、2,根据反应前后原子种类、数目不变,则,2X分子中含有2个氯原子和4个氧原子,则每个X分子由1个氯原子和2个氧原子构成,则物质X的化学式为ClO2。故选A。
5.A
【详解】B. 铁与稀盐酸反应生成氯化亚铁:Fe+2HCl=2FeCl2+H2↑C. 用红磷测定空气中氧气的含量:磷燃烧生成五氧化二磷,4P+5O2点燃2P2O5D.石灰水瓶壁上的白色固体是氢氧化钙与二氧化碳生成的碳酸钙沉淀, 洗去石灰水试剂瓶内壁附着的固体:CaCO3+2HCl=CaCl2+H2O+CO2↑选A
6.D
【详解】解:设混合物的相对分子质量为x,
x=110;
而碳酸钙的相对分子质量为100,所以所含的杂质为一种时,应该相对分子质量大于110,在给定选项中碳酸镁的相对分子质量为84,碳酸氢钾的相对分子质量为100,碳酸氢钠的相对分子质量为84,而碳酸钾的相对分子质量为138。
故选D。
【点睛】根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整。
7.B
【详解】利用质量守恒定律的技巧解法,根据质量质量守恒定律,反应物质量和与生成物质量和应相等,因此质量比中反应物磷、氧气的和等于生成物五氧化二磷的量,则只有选项D中满足124+160=284。故选B。
8.D
【详解】根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含C、Si、O的个数分别是2、1、2,生成物中含C、Si、O的个数分别是0、1、0,故生成物中还应含2个C、2个O,故X的化学式为:CO。
故选D。
9.(1) 2HgO 2Hg+O2↑ 分解反应
(2) 4P+5O22P2O5 化合反应
(3)3Fe+2O2Fe3O4
【详解】(1)加热氧化汞生成汞和氧气,反应的化学方程式为:2HgO 2Hg+O2↑;该反应是由一种物质生两种物质的反应,属于分解反应;
(2)红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O22P2O5;该反应是由两种物质生成一种物质的反应,属于化合反应;
(3)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2Fe3O4。
10. 它们的每个分子都是由2个原子构成的
【分析】根据质量守恒定律,反应前后原子种类不变,原子个数相同。
【详解】(1)由质量守恒定律反应前后原子的种类及数目不变可知,在B图中补出两个氯化氢分子即可,如图:
;
(2)由图示中微粒的构成可以得出,A中两种分子的相同点是:它们的每个分子都是由2个原子构成的。
(3)氢原子和某原子能形成A2B型分子,且该原子与氧原子的化学性质相似,则该原子应是硫原子,原子结构示意图为: 。
【点睛】最外层电子数相同,化学性质相似,组成化合物的各元素的化合价代数和为零。
11. 氢气 氧气 2:1 2H2O2H2↑+O2↑
【详解】电解水生成氢气和氧气,体积比氢气比氧气2:1,化学方程式2H2O2H2↑+O2↑,故填:氢气;氧气;2:1;2H2O2H2↑+O2↑。
12.(1) 反应物的状态 反应条件 b 硫化氢气体密度比空气大 紫色石蕊溶液 紫色石蕊溶液变红 防止烧杯里的液体倒吸
(2)10%
【详解】(1)①通过发生装置A和B的对比,选择气体发生装置应考虑的因素是反应物的状态和反应条件;
②用C装置收集硫化氢气体,进气口应为b;原因为硫化氢气体密度比空气大;
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是紫色石蕊溶液,现象是紫色石蕊溶液变红;
④导管末端的漏斗与液体接触面积较大,当气体被吸收时,装置E内液面下降,罩在液面上的漏斗与液体脱离,在重力作用下吸入漏斗内的液体回落到装置E中,从而起到防止液体的倒吸;故答案为:防止烧杯里的液体倒吸。
(2)解:设盐酸中HCl的质量为x,碳酸钠的质量为y
生成CO2的质量为:23.3g+146g-160.9g=8.8g
x=14.6g y=21.2g
盐酸中溶质的的质量分数=
答:样品中Na2CO3的质量为21.2g,盐酸中溶质的质量分数为10%。
13. 2NO+O2═2NO2; 在化学反应前后,原子的种类、数目、质量不变,所以化学反应前后质量守恒。
【详解】(1)该反应是一氧化氮燃烧生成了二氧化氮,反应的化学方程式是:2NO+O2═2NO2;
(2)由微粒的变化可知,在化学反应前后,原子的种类、数目、质量不变,所以化学反应前后质量守恒。
14. 质子数不同 最外层电子数 Fe+CuSO4═FeSO4+Cu
【详解】(1)元素是质子数(即核电荷数)相同的一类原子的总称,不同种元素最本质的区别是质子数(即核电荷数)不同;
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似;
(3)铁能与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
15. 钾、铝 C 肥皂水 氢原子、氧原子 氧气较氢气在水中溶解度大 AB 氢气
【详解】(1)①明矾[KAl(SO4)2 12H2O]中含有的金属元素是钾(K)、铝(Al)元素。
②清水池中盛放的清水中含有许多可溶性物质,属于混合物;故选D。
③硬水是含较多可溶性钙、镁矿物质的水;鉴别硬水和软水可以使用肥皂水,泡沫较少浮渣较多的是硬水,泡沫较多浮渣较少的是软水,故可用肥皂水鉴别硬水和软水。
(2)①水通电生成氢气和氧气,。
②原子是化学变化中最小的粒子,电解水过程中没有发生改变的微粒是氢原子、氧原子。
③电解开始时,正极和负极产生气体的体积比小于1:2,可能原因为氧气较氢气在水中溶解度大,导致氧气体积体积相对较小。
(3)①水蒸气通过一根烧红的铁管,生成了一种气体,则需要水蒸气,铁也需要加热,则该装置中需加热的仪器为AB。
②反应前后元素种类不变,反应前有铁、氢、氧元素,生成气体不溶于水,并且能燃烧,可判断反应生成的气体是氢气。
③水蒸气和铁在高温的条件下反应生成四氧化三铁和氢气, 。
16.(1) 三/3 C、CO
(2)N2
(3)
1000
【详解】(1)①是两种物质反应生成一种物质,符合多变一的特点,属于化合反应;
②是两种两种物质反应生成一种物质,符合多变一的特点,属于化合反应;
③是一种物质生成两种物质,符合一变多的特点,属于分解反应;
④是两种物质反应生成一种物质,符合多变一的特点,属于化合反应;
⑤是两种物质反应生成两种物质,不属于化合反应;
故炉内5个反应中,属于化合反应的有①②④,有3个;
在氧化还原反应中能够得氧的物质为还原剂,在反应①②中C作还原剂,反应④中CO作还原剂;故反应物中做还原剂的是C、CO;
(2)热空气的主要成分是氧气和氮气,在高炉炼铁的过程中氮气不参加反应,因此热空气和高炉气体中有一种相同的主要气体,该气体的化学式为N2;
(3)解:设制得560t铁,理论上需要氧化铁的质量为x
找出对应关系,写出相关的量,
折合为含氧化铁80%的赤铁矿石的质量是
答:理论上需要含氧化铁80%的赤铁矿石的质量是1000t。
21世纪教育网(www.21cnjy.com)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
