3.2.3-离子反应 课件(共20张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.2.3-离子反应 课件(共20张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-14 19:03:59 | ||
图片预览







文档简介
(共20张PPT)
离
子
反
应
教师:
讲授新课
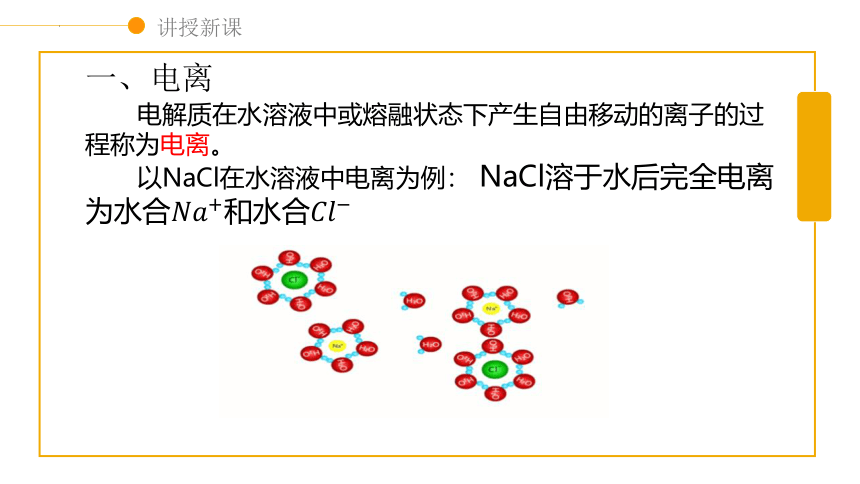
电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离。
以NaCl在水溶液中电离为例: NaCl溶于水后完全电离为水合和水合
一、电离
讲授新课
注意
电解质在水溶液中或熔融状态下即发生电离,电离不需通电。电解质因电离而导电,而不是因导电而电离。
讲授新知
电解质的电离通常用电离方程式表示。电解质溶于水后生成水合离子。但为了书写方便,常写成简单离子的形式。
如:NaCl溶于水后完全电离为水合和水合
电离方程式表示为:
NaCl=
同理:
H2SO4的电离方程式为:H2SO4=2
NaOH的电离方程式为:NaOH=
二、电离方程式
讲授新知
书写电离方程式要注意以下几点
(4)书写电离方程式必须以事实为依据,不能主观臆造。
(2)原子团不可拆分。如KClO3的电离方程式为
KClO3 =
(3)要遵循质量守恒定律(即在方程式两边原子的种类和数目必须相同)和电荷守恒(即电离产生的阳离子所带的正电荷总数等于阴离子所带的负电荷总数)。
(1)电离方程式左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。
学以致用
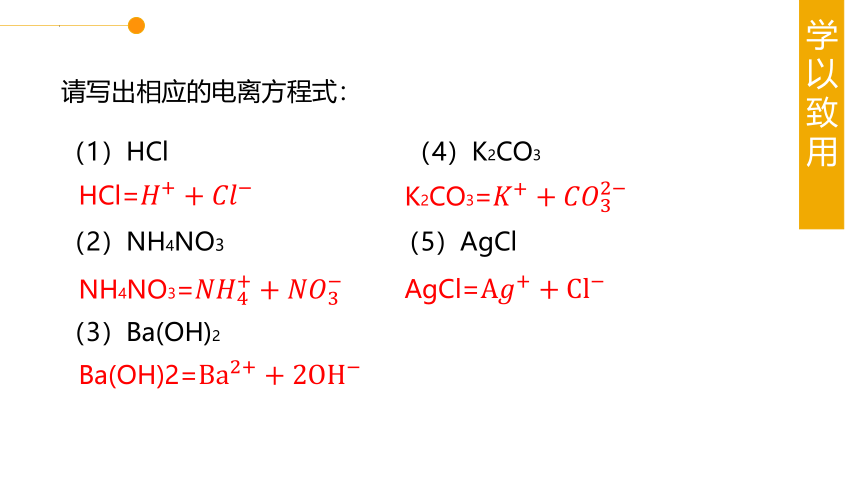
请写出相应的电离方程式:
(1)HCl (4)K2CO3
(2)NH4NO3 (5)AgCl
(3)Ba(OH)2
HCl=
K2CO3=
NH4NO3=
AgCl=
Ba(OH)2=
教师实验
思考:为什么电解质的导电能力不同?
深入探索
三、深入探究电离方程式
(1)强电解质: ,用“=”表示。
如:H2SO4=2+
NaOH=
NaCl=
完全电离
(2)弱电解质: ,用“”表示。
部分电离
如:CH3COOH+
NH
H2CO3
深入探索
(3)酸式盐的电离方程式
NaHSO4是由和的盐,是强电解质,完全电离。但二元强酸硫酸的酸式酸根离子,也能完全电离。
故NaHSO4溶于水的电离方程式应为
NaHSO4= ++
其熔融状态时的电离方程式为
NaHSO4=
①强酸的酸式盐
深入探索
NaHCO3是由和的盐,是强电解质,完全电离。但二元弱酸碳酸的酸式酸根离子,不能完全电离。
故NaHCO3溶于水的电离方程式应为
NaHCO4= + =
②弱酸的酸式盐
(4)活泼金属的氧化物在熔融状态下也可以发生电离。
如:Na2O=2 +
学以致用
下列物质在水溶液中的电离方程式书写错误的是( )
A、Fe2(SO4)2+
B、CaCl2= +
C、K2SO4=2
D、FeSO4=
解析:B错误,CaCl2是盐,属于强电解质,在水溶液中完全电离,书写电离方程式应遵守质量守恒定律。
B
讲授新知
四、从电离的角度认识酸,碱,盐
H2SO4=2
HCl =
HNO3 = +
H2CO3
NaOH =
Ba(OH)2=
Ca(OH)2 = +
KOH =
酸电离出来的阳离子全部都是
碱电离出来的阴离子全部都是
分类 电离特征 举例
酸 电离时生成的阳离子全部都是的化合物称为酸 H2SO4
碱 电离时生成的阴离子全部都是的化合物称为碱 Ba(OH)2
盐 电离时生成金属阳离子(或)和酸根阴离子的化合物称为盐 NaCl,NH4Cl
讲授新知
四、从电离的角度认识酸,碱,盐
理解酸和碱的电离特征时应该注意“全部”两个字,即酸电离产生的阳离子只有,碱产生的阴离子只有。
学以致用
下列关于酸,碱,盐的说法中正确的是( )
A、能电离出的化合物叫酸,能电离出化合物称为碱
B、氯化钠溶液在电流的作用下电离出
C、化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D、NaHSO4可以电离出,因此NaHSO4
解析:A,电离出的阳离子全部都是的化合物叫酸,电离出的阴离子全部是的化合物叫碱。B,氯化钠溶液在水分子的作用下会电离出和,而不是电流作用。D, NaHSO4可以电离出,但阳离子不全是,还有,则NaHSO4不是酸
C
小结
物质
既不是电解质
也不是非电解质
电解质
非电
解质
混合物
纯净物
单质
化合物
酸,碱,盐,活泼金属氧化物,水
除上述五类物质外的其他化合物
电离
定义
表示方式
发生
电解质在水溶液中或熔融状态下产生自由移动的离子的过程
电离方程式
典型例题剖析
1、现有一种固体化合物X不导电,但熔融状态下或溶于水导电,下列说法正确的是( )
A.X只能是盐 B.X可能是酸
C.X一定是电解质 D.X可能是非电解质
解析:在水溶液中或熔融状态下能导电的化合物为电解质,所有的酸、碱、盐和绝大多数金属氧化物均为电解质。由分析可知,X可能是盐或碱,A项错误;虽然酸属于电解质,但是酸只能在水溶液中导电,在熔融状态下不能导电,X不可能是酸,B项错误;X一定为电解质,C项正确;X不可能为非电解质,D项错误。
C
典型例题剖析
2、下列说法正确的是( )
A.铜,石墨均能导电,所以它们都是电解质
B.氨气,二氧化碳的水溶液都能导电,所以它们都是电解质溶液
C.液态氯化氢,固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖,酒精在水溶液里和熔融状态下都不能导电,所以它们都是非电解质
解析:A错,铜和石墨是单质,所以既不是电解质也不是非电解质。B错,NH4、CO2的水溶液能导电,是因为NH3、CO2分别和水反应生成的NH3●H2O、H2CO3电离出离子而使溶液导电,NH3和CO2自身并没有电离,故NH3、CO2是非电解质。C错,HCl和NaCl溶于水能电离出自由移动的离子而使溶液导电,所以氯化氢和氯化钠是电解质。答案:D
D
典型例题剖析
例题总结提升
解答有关电解质问题的思维流程
首先,判断物质是否属于化合物,单质、混合物既不是电解质,也不是非电解质。
其次,判断化合物在溶液里或熔融状态下能否导电,至少其一导电为电解质,两者都不导电为非电解质。
最后,根据电解质所处状态(液态、 熔融态)和化合物的类型,判断电解质在所处状态下能否导电。
核心素质培养
现有以下物质:①NaOH固体、②蔗糖、③BaCO3固体、④KHSO4固体、⑤FeCl3溶液、⑥铜、⑦CO2 、 ⑧熔融KNO3。请回答下列问题。
(1)以上物质中能导电的是 (填序号),以上物质中属于电解质的是 (填序号)。
(2)在小烧杯中加入40mL蒸馏水,加热至沸腾后,向佛水中逐滴滴入几滴饱和FeCl,溶液,继续煮沸至液体呈 色,即制得Fe(OH)3胶体。判断是否成功制备出胶体的最简单操作是:
(3)写出④在水中发生电离的方程式:
(4)写出⑧的电离方程式:
⑤⑥⑧
①③④⑧
KHSO4=
用一支激光笔照射,从侧面观察,看能否可看到一条光亮的通路
红褐
KNO3=
待
续
HAPPY
下次课见
离
子
反
应
教师:
讲授新课
电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离。
以NaCl在水溶液中电离为例: NaCl溶于水后完全电离为水合和水合
一、电离
讲授新课
注意
电解质在水溶液中或熔融状态下即发生电离,电离不需通电。电解质因电离而导电,而不是因导电而电离。
讲授新知
电解质的电离通常用电离方程式表示。电解质溶于水后生成水合离子。但为了书写方便,常写成简单离子的形式。
如:NaCl溶于水后完全电离为水合和水合
电离方程式表示为:
NaCl=
同理:
H2SO4的电离方程式为:H2SO4=2
NaOH的电离方程式为:NaOH=
二、电离方程式
讲授新知
书写电离方程式要注意以下几点
(4)书写电离方程式必须以事实为依据,不能主观臆造。
(2)原子团不可拆分。如KClO3的电离方程式为
KClO3 =
(3)要遵循质量守恒定律(即在方程式两边原子的种类和数目必须相同)和电荷守恒(即电离产生的阳离子所带的正电荷总数等于阴离子所带的负电荷总数)。
(1)电离方程式左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。
学以致用
请写出相应的电离方程式:
(1)HCl (4)K2CO3
(2)NH4NO3 (5)AgCl
(3)Ba(OH)2
HCl=
K2CO3=
NH4NO3=
AgCl=
Ba(OH)2=
教师实验
思考:为什么电解质的导电能力不同?
深入探索
三、深入探究电离方程式
(1)强电解质: ,用“=”表示。
如:H2SO4=2+
NaOH=
NaCl=
完全电离
(2)弱电解质: ,用“”表示。
部分电离
如:CH3COOH+
NH
H2CO3
深入探索
(3)酸式盐的电离方程式
NaHSO4是由和的盐,是强电解质,完全电离。但二元强酸硫酸的酸式酸根离子,也能完全电离。
故NaHSO4溶于水的电离方程式应为
NaHSO4= ++
其熔融状态时的电离方程式为
NaHSO4=
①强酸的酸式盐
深入探索
NaHCO3是由和的盐,是强电解质,完全电离。但二元弱酸碳酸的酸式酸根离子,不能完全电离。
故NaHCO3溶于水的电离方程式应为
NaHCO4= + =
②弱酸的酸式盐
(4)活泼金属的氧化物在熔融状态下也可以发生电离。
如:Na2O=2 +
学以致用
下列物质在水溶液中的电离方程式书写错误的是( )
A、Fe2(SO4)2+
B、CaCl2= +
C、K2SO4=2
D、FeSO4=
解析:B错误,CaCl2是盐,属于强电解质,在水溶液中完全电离,书写电离方程式应遵守质量守恒定律。
B
讲授新知
四、从电离的角度认识酸,碱,盐
H2SO4=2
HCl =
HNO3 = +
H2CO3
NaOH =
Ba(OH)2=
Ca(OH)2 = +
KOH =
酸电离出来的阳离子全部都是
碱电离出来的阴离子全部都是
分类 电离特征 举例
酸 电离时生成的阳离子全部都是的化合物称为酸 H2SO4
碱 电离时生成的阴离子全部都是的化合物称为碱 Ba(OH)2
盐 电离时生成金属阳离子(或)和酸根阴离子的化合物称为盐 NaCl,NH4Cl
讲授新知
四、从电离的角度认识酸,碱,盐
理解酸和碱的电离特征时应该注意“全部”两个字,即酸电离产生的阳离子只有,碱产生的阴离子只有。
学以致用
下列关于酸,碱,盐的说法中正确的是( )
A、能电离出的化合物叫酸,能电离出化合物称为碱
B、氯化钠溶液在电流的作用下电离出
C、化合物电离时,生成金属阳离子(或铵根离子)和酸根阴离子的是盐
D、NaHSO4可以电离出,因此NaHSO4
解析:A,电离出的阳离子全部都是的化合物叫酸,电离出的阴离子全部是的化合物叫碱。B,氯化钠溶液在水分子的作用下会电离出和,而不是电流作用。D, NaHSO4可以电离出,但阳离子不全是,还有,则NaHSO4不是酸
C
小结
物质
既不是电解质
也不是非电解质
电解质
非电
解质
混合物
纯净物
单质
化合物
酸,碱,盐,活泼金属氧化物,水
除上述五类物质外的其他化合物
电离
定义
表示方式
发生
电解质在水溶液中或熔融状态下产生自由移动的离子的过程
电离方程式
典型例题剖析
1、现有一种固体化合物X不导电,但熔融状态下或溶于水导电,下列说法正确的是( )
A.X只能是盐 B.X可能是酸
C.X一定是电解质 D.X可能是非电解质
解析:在水溶液中或熔融状态下能导电的化合物为电解质,所有的酸、碱、盐和绝大多数金属氧化物均为电解质。由分析可知,X可能是盐或碱,A项错误;虽然酸属于电解质,但是酸只能在水溶液中导电,在熔融状态下不能导电,X不可能是酸,B项错误;X一定为电解质,C项正确;X不可能为非电解质,D项错误。
C
典型例题剖析
2、下列说法正确的是( )
A.铜,石墨均能导电,所以它们都是电解质
B.氨气,二氧化碳的水溶液都能导电,所以它们都是电解质溶液
C.液态氯化氢,固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖,酒精在水溶液里和熔融状态下都不能导电,所以它们都是非电解质
解析:A错,铜和石墨是单质,所以既不是电解质也不是非电解质。B错,NH4、CO2的水溶液能导电,是因为NH3、CO2分别和水反应生成的NH3●H2O、H2CO3电离出离子而使溶液导电,NH3和CO2自身并没有电离,故NH3、CO2是非电解质。C错,HCl和NaCl溶于水能电离出自由移动的离子而使溶液导电,所以氯化氢和氯化钠是电解质。答案:D
D
典型例题剖析
例题总结提升
解答有关电解质问题的思维流程
首先,判断物质是否属于化合物,单质、混合物既不是电解质,也不是非电解质。
其次,判断化合物在溶液里或熔融状态下能否导电,至少其一导电为电解质,两者都不导电为非电解质。
最后,根据电解质所处状态(液态、 熔融态)和化合物的类型,判断电解质在所处状态下能否导电。
核心素质培养
现有以下物质:①NaOH固体、②蔗糖、③BaCO3固体、④KHSO4固体、⑤FeCl3溶液、⑥铜、⑦CO2 、 ⑧熔融KNO3。请回答下列问题。
(1)以上物质中能导电的是 (填序号),以上物质中属于电解质的是 (填序号)。
(2)在小烧杯中加入40mL蒸馏水,加热至沸腾后,向佛水中逐滴滴入几滴饱和FeCl,溶液,继续煮沸至液体呈 色,即制得Fe(OH)3胶体。判断是否成功制备出胶体的最简单操作是:
(3)写出④在水中发生电离的方程式:
(4)写出⑧的电离方程式:
⑤⑥⑧
①③④⑧
KHSO4=
用一支激光笔照射,从侧面观察,看能否可看到一条光亮的通路
红褐
KNO3=
待
续
HAPPY
下次课见
