2.4 元素 同步练习 ---2023-2024学年九年级化学鲁教版上册
文档属性
| 名称 | 2.4 元素 同步练习 ---2023-2024学年九年级化学鲁教版上册 |  | |
| 格式 | docx | ||
| 文件大小 | 476.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-15 14:26:05 | ||
图片预览



文档简介
2.4 元素
一、单选题
1.镧是稀土金属中的一员,可制合金、催化剂和昂贵的照相机镜头等;镧原子核内中子数为82,如图为镧元素的残留信息,下列说法中正确的是
A.镧元素符号LA
B.镧的相对原子质量为139g
C.镧原子核外电子数为82
D.镧原子序数为57
2.老年人缺钙会发生骨质疏松,容易骨折,这里“钙”指的是( )
A.原子 B.元素 C.单质 D.分子
3.镍铁双金属纳米颗粒催化剂可以提高电解水制氢的效率。铁、镍元素在元素周期表中的基本信息及它们的原子结构示意图如图所示,下列说法错误的是
A.镍、铁都是金属元素
B.镍的核内质子数为28
C.铁的相对原子质量为55.845
D.镍、铁原子核外电子排布相同
4.在我们的日常生活中出现的“加碘食盐、增铁酱油、高钙牛奶”等.这里的碘、铁、钙应理解为
A.单质 B.分子 C.元素 D.氧化物
5.推理是学习化学的一种方法,以下推理正确的是
A.化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物
B.氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧分子
C.在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数
D.蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快
6.2021年4月16日,我国自主研发出超流氦大型低温制冷装备,打破了发达国家的技术垄断,液氦是制造超低温的“神器”。根据图中信息判断,下列关于氦的说法正确的是
A.氦属于金属元素 B.氦原子容易失去电子
C.氦的相对原子质量是4.003g D.氦原子核内有2个质子
7.下列说法正确的是( )
A.分子在化学变化中不能再分
B.不同元素的本质区别是中子数不同
C.花香四溢说明分子在不断运动
D.原子不能直接构成物质
8.下列说法正确的是
A.不同元素的本质区别是中子数不同
B.原子中一定含有质子
C.化学反应前后分子的种类不变
D.保持水的化学性质的微粒是氢原子和氧原子
9.根据如图四种粒子的结构示意图判断以下说法正确的是
A.②③两图所示的粒子化学性质相似
B.④图是一种非金属元素的原子
C.③图所示的粒子是稀有气体原子
D.图中所示粒子是三种元素的粒子
10.下列有关粒子结构示意图的说法正确的是( )
A.③和④在元素周期表中属于同一族 B.①和②的化学性质相似
C.②和⑤形成的化合物由离子构成 D.示意图中只有③和④具有稳定结构
11.下列符号既能表示一个原子,又能表示一种元素,还能表示一种物质的是
A.O B.Cu C.N2 D.NaCl
12.元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获取的信息不正确的是
A.该元素的元素符号为Ar
B.该元素属于金属元素
C.该元素的原子核内有18个质子
D.该元素的相对原子质量为39.95
13.下列各组物质中,前者属于单质,后者属于化合物的是
A.硬铝、冰水 B.红磷、空气 C.氧化镁、液氮 D.铁粉、锰酸钾
14.某“剪切增稠液体”是由微小且硬度极高的硅颗粒和聚乙二醇混合而成,当受外力打击时硅颗粒迅速沉积成一层坚硬阻挡层,可用于防弹衣。下列关于硅的说法正确的是
A.地壳中含量最高的元素
B.和聚乙二醇混合是化学变化
C.属于金属单质
D.由原子直接构成
二、填空题
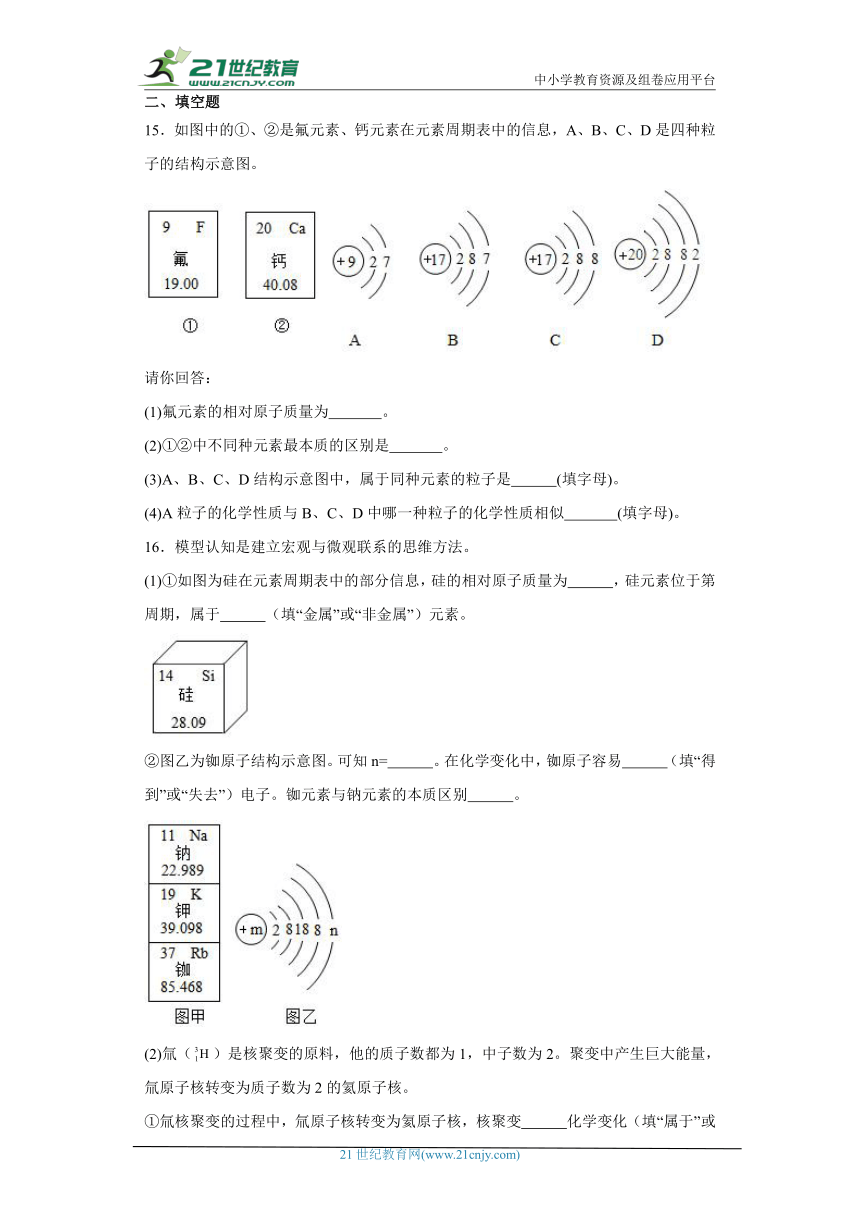
15.如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
请你回答:
(1)氟元素的相对原子质量为 。
(2)①②中不同种元素最本质的区别是 。
(3)A、B、C、D结构示意图中,属于同种元素的粒子是 (填字母)。
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似 (填字母)。
16.模型认知是建立宏观与微观联系的思维方法。
(1)①如图为硅在元素周期表中的部分信息,硅的相对原子质量为 ,硅元素位于第 周期,属于 (填“金属”或“非金属”)元素。
②图乙为铷原子结构示意图。可知n= 。在化学变化中,铷原子容易 (填“得到”或“失去”)电子。铷元素与钠元素的本质区别 。
(2)氚()是核聚变的原料,他的质子数都为1,中子数为2。聚变中产生巨大能量,氚原子核转变为质子数为2的氦原子核。
①氚核聚变的过程中,氚原子核转变为氦原子核,核聚变 化学变化(填“属于”或“不属于”)。
②下列示意图能正确表示氚原子结构的是 。
17.下表是小丽同学绘制的元素周期表的局部,依据此表回答问题
(1)上图中硫元素的核电荷数z= ;氯元素的最外层电子数Y= (填数值),与氯元素化学性质相似的元素是 。
(2)核电荷数为12的元素的原子失去两个电子后,形成的离子的符号是 ,它的核外电子排布与 元素的原子核外电子排布相同.磷元素在元素周期表中位于第 周期
(3)钠元素和钾元素化学性质相似的原因
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:
三、实验题
18.(1)下列分别盛有不同物质的容器中所盛物质属于单质的是 ,属于化合物的是 。
(2)在汞、水、氯化钠三种物质中,由原子直接构成的物质是 。
四、计算题
19.已知铁元素位于元素周期表中的第四周期,其一个原子中有26个质子,一个铁原子的质量是9.288×10-26kg,碳元素的一个原子有6个质子,一个碳—12原子的质量是1.993×10-26kg,求:
(1)在地壳各种元素的含量中,铁元素排在第 位。
(2)铁原子的原子核外有 个电子层。
(3)这种铁原子的相对原子质量为 (结果保留整数)。
20.计算。
(1)据报道,锶晶格钟是一种新型原子钟,其准确度高得惊人,它能在50亿年间不慢一秒也不快一秒。如图为锶元素的相关信息,下列说法正确的是
A.锶属于非金属元素
B.锶原子核内核电荷数为38
C.锶离子Sr2+中有40个电子
D.锶位于元素周期表中第二周期
(2)已知:R原子的中子数比质子数多17个,其阳离子R3+核外共有46个电子。请计算:R的相对原子质量是多少?(必须有具体的计算过程)
五、综合应用题
21.下表是元素周期表中第2、3周期的元素,请回答有关问题。
(1)下列各组具有相似化学性质的元素是 (填字母序号)
A Na、Cl
B O、S
C F、Cl
D Al、Ar
(2)写出一条第三周期元素原子的核外电子排布规律 。
(3)地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物的化学式为 。
(4)某离子的结构示意图为 当x-y=8时,该粒子的符号为 .
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体的是 (填字母序号)
A NO和O2 B CO和N2 C SO3和CO2 D PO43- 和SO42-
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
参考答案:
1.D
【详解】A、两个字母表示的元素符号,第一个字母要大写,第二个字母要小写,因此元素符号为La,错误;
B、相对原子质量的单位为“1”不是“g”,错误;
C、镧原子核内质子数的=原子序数=57,原子的核外电子数=质子数=57,错误;
D、由图可知镧原子序数为57,正确;
故选D。
2.B
【详解】物质是由元素组成的,老年人缺钙会发生骨质疏松的“钙”指的是钙元素,故选B。
3.D
【详解】A.镍、铁名称都带“钅”,都是金属元素,不符合题意;
B.镍的核内质子数=原子序数=28,不符合题意;
C.铁的相对原子质量为55.845,不符合题意;
D.镍、铁原子核外电子层数相同,但次外层电子数不相同,符合题意;
故答案为:D
4.C
【详解】“加碘食盐、增铁酱油、高钙牛奶”等商品,这些商品中所强调的碘、铁、钙、硒、氟,都是说明这些物质的存在了这些元素,而不管以什么形式存在,或者便于说明如何存在,所以就用宏观的元素种类来说明。因此理解为元素,故选C
5.D
【详解】A、由不同种元素组成的纯净物一定是化合物,不同种元素组成的物质不一定是化合物,例如空气由不同种元素组成的物质,属于混合物,故A说法错误;
B、根据质量守恒定律,在反应前后元素的质量不变,氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素,故B说法正确;
C、在原子中质子数等于核外电子数,但不是所有的微粒中质子数一定等于核外电子数,例如离子中质子数不等于核外电子数,故C说法错误;
D、蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快,正确;
故选D。
6.D
【详解】A、氦属于稀有气体元素,选项说法错误,故A不符合题意;
B、氦原子核外有2个电子,已达到稳定结构,选项说法错误,故B不符合题意;
C、相对原子质量的单位是“1”,常省略不写,选项说法错误,故C不符合题意;
D、氦原子核内有2个质子,选项说法正确,故D符合题意。
故选:D。
7.C
【详解】A、原子在化学变化中不能再分,分子在化学变化中可以变化成原子,A选项不正确,不符合题意;
B、不同元素的本质区别是质子数不同,B选项不正确,不符合题意;
C、花香四溢说明分子在不断运动,C选项正确,符合题意;
D、原子能直接构成物质,D选项不正确,不符合题意。故选C。
8.B
【分析】
【详解】A、不同元素的本质区别是质子数不同,错误;
B、原子中一定含有质子,正确;
C、 化学反应前后原子的种类不变,分子种类改变,错误;
D、保持水的化学性质的微粒是水分子,错误。
故选B。
9.D
【详解】A、②③所示的粒子的质子数相同,属于同种元素,但它们的最外层电子数不同,则化学性质不同,该选项说法不正确;
B、④粒子的质子数为13,对应的元素为铝元素,铝属于金属元素,该选项说法不正确;
C、③粒子的质子数为12,对应的为镁元素,镁元素不属于稀有气体元素,该选项说法不正确;
D、②③属于同种元素,则图中所示粒子是三种元素的粒子,该选项说法正确。
故选D。
10.C
【详解】A、③表示的是钠元素的钠离子,④表示的是氖元素,在元素周期表中不属于同一族,错误;
B、①是稀有气体的原子,化学性质稳定,而②在化学反应中容易失去电子,化学性质活泼,错误;
C、②能形成镁离子,⑤能形成硫离子,故形成的化合物由离子构成,正确;
D、①也具有稳定的结构,错误。
故选C。
11.B
【分析】金属、固体非金属、稀有气体是由原子直接构成的,它们的元素符号既能表示一个原子,又能表示一种元素,还能表示一种物质。
【详解】A、O可以表示氧元素,也可以表示表示一个氧原子,不能表示一种物质,故A错误;
B、Cu属于金属元素,可表示铜元素,表示一个铜原子,还能表示铜这种物质,故B正确;
C、N2是氮气的化学式,只能表示氮气这种物质,不能表示元素和原子,故C错误;
D、NaCl表示氯化钠这种物质,不能表示一种元素和一个原子,故D错误。
故选B。
12.B
【详解】A、根据元素周期表的信息可知,右上角的字母表示元素符合,该元素的元素符号为Ar,选项说法正确;
B、根据元素周期表的信息可知,中间汉字表示元素名称,该元素的名称为氩元素,带“气”字旁,属于非金属元素,选项说法不正确;
C、根据元素周期表的信息可知,左上角的数字表示原子序数,氩的原子序数为18,原子中原子序数=质子数=18,选项说法正确;
D、根据元素周期表的信息可知,元素名称下方的数字表示相对原子质量,氩的相对原子质量为39.95,选项说法正确。
故选B。
【点睛】本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)是正确解答本题的关键。
13.D
【分析】根据物质的组成特点分析,单质是由同种元素组成的纯净物.化合物是由不同种元素组成的纯净物。
【详解】A.硬铝是铝的合金,属于混合物,不属于单质,冰水属于水的不同状态混合,是由氢元素和氧元素组成的纯净物,属于化合物,故选项A不符合题意;
B.红磷是磷元素组成的纯净物,属于单质,空气属于混合物,故选项B不符合题意;
C.氧化镁是由镁元素和氧元素组成的纯净物,属于化合物,液氮是氮气的液态形式,是由氮元素组成的纯净物,属于单质,故C选项不符合题意;
D.铁粉是铁元素组成的纯净物,属于单质,锰酸钾是由钾元素、锰元素和氧元素组成的纯净物,属于化合物,符合题意,故选D。
14.D
【详解】A、地壳中含量最高的元素是氧元素,不是硅元素,选项错误;
B、由题意得硅颗粒和聚乙二醇混合没有生成新物质,故属于物理变化,选项错误;
C、根据硅的偏旁是石字旁,故属于非金属元素,所以硅不属于金属单质,选项错误;
D、硅是固态非金属,由硅原子构成,选项正确;
答案为:D。
15.(1)19.00
(2)质子数不同
(3)BC
(4)B
【解析】(1)
根据元素周期表中的一格信息可知:元素名称下方的数字表示相对原子质量,氟元素的相对原子质量为19.00;
(2)
元素是质子数相同的一类原子的总称,①②中不同种元素最本质的区别是质子数不同;
(3)
元素的种类由质子数决定,B、C核内质子数都是17,所以是同种元素,故填BC;
(4)
元素的化学性质由最外层电子数决定,A与B最外层电子数相同,所以化学性质相似,故填:B。
16.(1) 28.09 三 非金属 1 失去 质子数不同
(2) 不属于 A
【详解】(1)①元素信息图中最下方的数字就是元素原子的相对原子质量,由图可知,硅的相对原子质量为28.09,故填28.09;元素信息图中左上角的数字就是元素的原子序数,原子序数等于原子核外的电子数,由图可知,硅元素的原子序数为14,则硅原子核外的电子数为14,其中第一电子层上的电子数为2,第二层电子数为8,第三层电子数为4,即硅原子核外的电子层数为3,所以硅元素位于元素周期表中的第三周期,故填三;硅元素的名称带有石字旁,属于非金属元素,故填非金属。
②由图可知,铷元素的原子序数为37,则其核内质子数为37,原子核内质子数等于核外电子数,则n=37 2 8 18 8=1,故填1;铷原子的最外层电子数为1,在化学反应中容易失去电子形成阳离子,故填失去;由元素的概念可知,铷元素与钠元素是两种不同的元素,它们的本质区别是原子中的质子数不同,故填质子数不同。
(2)①氚核聚变的过程中,氚原子核转变为氦原子核,而化学变化中原子核不变,只是核外的电子数发生改变,所以核聚变不属于化学变化,故填不属于。
②氚原子的质子数都为1,中子数为2,则氚原子的核外电子数也为1,则符合此结构的图形为A,故填A。
17. 16 7 F Mg2+ Ne 三 最外层电子数相等 同一列中,从上到下元素的最外层电子数相同
【详解】(1)由1~18的元素的原子结构示意图可知,每一行从左到右,最外层电子数依次增加,则硫元素的原子最外层电子数为6,Z=2+8+6=16,其核电荷数为16;氯元素的最外层电子数17=2+8+y,y=7.决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质,氯元素的原子的最外层电子数为7,氟原子的最外层电子数为7,故两者具有相似的化学性质;
(2)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,所以核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号为:Mg2+,它的核外电子排布与Ne元素的原子核外电子排布相同;磷原子核外有3个电子层,故位于第三周期;
(3)因为元素的最外层电子数决定元素的性质,由表中数据可知钠元素和钾元素的最外层电子数相等,所以两者化学性质相似;
(4)根据图中所给的信息及其元素周期律可得:同一行中,从左到右元素的最外层电子数依次增加,同一列中,从上到下元素的最外层电子数相同。
18. A D 汞
【分析】混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成,纯净物又分为单质和化合物,由同种元素组成的纯净物叫单质,由两种或两种以上的元素组成的纯净物叫化合物。
【详解】(1)混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质,氧气和液氧中只有氧分子,故属于单质的是A;由两种或两种以上的元素组成的纯净物叫化合物,冰水中只有水分子,故属于化合物的是D。
(2)在汞、水、氯化钠三种物质中,由原子直接构成的物质是汞。
【点睛】臭氧和氧气是同种元素组成的不同单质,属于同素异形体。
19.(1)四
(2)四
(3)
【分析】(1)
地壳中各元素的含量由高到低顺序为:氧、硅、铝、铁、钙,即铁元素排在第四位,故填四。
(2)
元素的原子核外有几个电子层,元素就位于元素周期表中的第几周期,铁元素位于元素周期表中的第四周期,则铁原子的原子核外有四个电子层,故填四。
(3)
根据某原子的相对原子相对质量=可知,这种铁原子的相对原子质量=,故填56。
20.(1)B
(2)解:R3+核外共有46个电子,所以R原子的质子数=46+3=49;
R原子的中子数比质子数多17个,所以R原子的中子数=49+17=66;
R原子的相对原子质量=49+66115。
答:R原子的相对原子质量是115。
【解析】(1)
A.由锶元素的名称可知锶元素属于金属元素,此选项错误;
B.原子序数=质子数=核电荷数=电子数,锶元素的原子序数为38,所以锶原子核内核电荷数为38,此选项正确;
C. 锶原子最外层由2个电子,容易失去最外层的2个电子,形成带两个单位正电荷的阳离子,所以锶离子Sr2+中有38-2=36个电子,此选项错误;
D.原子结构示意图中电子层数等于周期数,由图可知锶原子核外有五个电子层,所以锶元素位于元素周期表中第五周期,此选项错误;
故选B;
(2)
见答案。
21. BC 从左往右,最外层电子数依次增大(合理即可) Al2O3. S2- BD
【详解】(1)
A、Na和Cl的最外层电子数不同,不具有相似的化学性质;
B、O和S的最外层电子数相同,具有相似的化学性质;
C、F和Cl的最外层电子数相同,具有相似的化学性质;
D、Al和Ar的最外层电子数不同,不具有相似的化学性质;
故填:BC;
(2)第三周期元素原子的核外电子排布规律是:从左往右,最外层电子数依次增大(合理即可)
故填:从左往右,最外层电子数依次增大(合理即可);
(3)地壳中含量最多的金属元素是Al元素,在化合物中显+3价;地壳中含量最多的非金属元素O元素,Al元素显正价,故氧元素在该化合物中显-2价,故这二者组成的化合物的化学式为Al2O3。
(4)当x-y=8时,说明带有的是2个单位的负电荷,y=8,该粒子的核内质子数为16,故是硫离子,故填:S2-;
(5)A.NO和O2 的原子数都是2,电子数分别是15和16,不属于等电子体;
B.CO和N2的原子数都是2,电子数都是14,属于等电子体;
C.SO3和CO2的原子数和电子数都不同,不属于等电子体;
D.PO43-和SO42-的原子个数和电子个数都相等,属于等电子体。
故选:BD。
一、单选题
1.镧是稀土金属中的一员,可制合金、催化剂和昂贵的照相机镜头等;镧原子核内中子数为82,如图为镧元素的残留信息,下列说法中正确的是
A.镧元素符号LA
B.镧的相对原子质量为139g
C.镧原子核外电子数为82
D.镧原子序数为57
2.老年人缺钙会发生骨质疏松,容易骨折,这里“钙”指的是( )
A.原子 B.元素 C.单质 D.分子
3.镍铁双金属纳米颗粒催化剂可以提高电解水制氢的效率。铁、镍元素在元素周期表中的基本信息及它们的原子结构示意图如图所示,下列说法错误的是
A.镍、铁都是金属元素
B.镍的核内质子数为28
C.铁的相对原子质量为55.845
D.镍、铁原子核外电子排布相同
4.在我们的日常生活中出现的“加碘食盐、增铁酱油、高钙牛奶”等.这里的碘、铁、钙应理解为
A.单质 B.分子 C.元素 D.氧化物
5.推理是学习化学的一种方法,以下推理正确的是
A.化合物是由不同种元素组成的,所以由不同种元素组成的物质一定是化合物
B.氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧分子
C.在原子中质子数等于核外电子数,所以所有的微粒中质子数一定等于核外电子数
D.蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快
6.2021年4月16日,我国自主研发出超流氦大型低温制冷装备,打破了发达国家的技术垄断,液氦是制造超低温的“神器”。根据图中信息判断,下列关于氦的说法正确的是
A.氦属于金属元素 B.氦原子容易失去电子
C.氦的相对原子质量是4.003g D.氦原子核内有2个质子
7.下列说法正确的是( )
A.分子在化学变化中不能再分
B.不同元素的本质区别是中子数不同
C.花香四溢说明分子在不断运动
D.原子不能直接构成物质
8.下列说法正确的是
A.不同元素的本质区别是中子数不同
B.原子中一定含有质子
C.化学反应前后分子的种类不变
D.保持水的化学性质的微粒是氢原子和氧原子
9.根据如图四种粒子的结构示意图判断以下说法正确的是
A.②③两图所示的粒子化学性质相似
B.④图是一种非金属元素的原子
C.③图所示的粒子是稀有气体原子
D.图中所示粒子是三种元素的粒子
10.下列有关粒子结构示意图的说法正确的是( )
A.③和④在元素周期表中属于同一族 B.①和②的化学性质相似
C.②和⑤形成的化合物由离子构成 D.示意图中只有③和④具有稳定结构
11.下列符号既能表示一个原子,又能表示一种元素,还能表示一种物质的是
A.O B.Cu C.N2 D.NaCl
12.元素周期表是学习化学的重要工具。如图是元素周期表中的一格,从中获取的信息不正确的是
A.该元素的元素符号为Ar
B.该元素属于金属元素
C.该元素的原子核内有18个质子
D.该元素的相对原子质量为39.95
13.下列各组物质中,前者属于单质,后者属于化合物的是
A.硬铝、冰水 B.红磷、空气 C.氧化镁、液氮 D.铁粉、锰酸钾
14.某“剪切增稠液体”是由微小且硬度极高的硅颗粒和聚乙二醇混合而成,当受外力打击时硅颗粒迅速沉积成一层坚硬阻挡层,可用于防弹衣。下列关于硅的说法正确的是
A.地壳中含量最高的元素
B.和聚乙二醇混合是化学变化
C.属于金属单质
D.由原子直接构成
二、填空题
15.如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。
请你回答:
(1)氟元素的相对原子质量为 。
(2)①②中不同种元素最本质的区别是 。
(3)A、B、C、D结构示意图中,属于同种元素的粒子是 (填字母)。
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似 (填字母)。
16.模型认知是建立宏观与微观联系的思维方法。
(1)①如图为硅在元素周期表中的部分信息,硅的相对原子质量为 ,硅元素位于第 周期,属于 (填“金属”或“非金属”)元素。
②图乙为铷原子结构示意图。可知n= 。在化学变化中,铷原子容易 (填“得到”或“失去”)电子。铷元素与钠元素的本质区别 。
(2)氚()是核聚变的原料,他的质子数都为1,中子数为2。聚变中产生巨大能量,氚原子核转变为质子数为2的氦原子核。
①氚核聚变的过程中,氚原子核转变为氦原子核,核聚变 化学变化(填“属于”或“不属于”)。
②下列示意图能正确表示氚原子结构的是 。
17.下表是小丽同学绘制的元素周期表的局部,依据此表回答问题
(1)上图中硫元素的核电荷数z= ;氯元素的最外层电子数Y= (填数值),与氯元素化学性质相似的元素是 。
(2)核电荷数为12的元素的原子失去两个电子后,形成的离子的符号是 ,它的核外电子排布与 元素的原子核外电子排布相同.磷元素在元素周期表中位于第 周期
(3)钠元素和钾元素化学性质相似的原因
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:
三、实验题
18.(1)下列分别盛有不同物质的容器中所盛物质属于单质的是 ,属于化合物的是 。
(2)在汞、水、氯化钠三种物质中,由原子直接构成的物质是 。
四、计算题
19.已知铁元素位于元素周期表中的第四周期,其一个原子中有26个质子,一个铁原子的质量是9.288×10-26kg,碳元素的一个原子有6个质子,一个碳—12原子的质量是1.993×10-26kg,求:
(1)在地壳各种元素的含量中,铁元素排在第 位。
(2)铁原子的原子核外有 个电子层。
(3)这种铁原子的相对原子质量为 (结果保留整数)。
20.计算。
(1)据报道,锶晶格钟是一种新型原子钟,其准确度高得惊人,它能在50亿年间不慢一秒也不快一秒。如图为锶元素的相关信息,下列说法正确的是
A.锶属于非金属元素
B.锶原子核内核电荷数为38
C.锶离子Sr2+中有40个电子
D.锶位于元素周期表中第二周期
(2)已知:R原子的中子数比质子数多17个,其阳离子R3+核外共有46个电子。请计算:R的相对原子质量是多少?(必须有具体的计算过程)
五、综合应用题
21.下表是元素周期表中第2、3周期的元素,请回答有关问题。
(1)下列各组具有相似化学性质的元素是 (填字母序号)
A Na、Cl
B O、S
C F、Cl
D Al、Ar
(2)写出一条第三周期元素原子的核外电子排布规律 。
(3)地壳中含量最多的金属元素与含量最多的非金属元素组成的化合物的化学式为 。
(4)某离子的结构示意图为 当x-y=8时,该粒子的符号为 .
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质。下列各组粒子中属于等电子体的是 (填字母序号)
A NO和O2 B CO和N2 C SO3和CO2 D PO43- 和SO42-
中小学教育资源及组卷应用平台
21世纪教育网(www.21cnjy.com)
参考答案:
1.D
【详解】A、两个字母表示的元素符号,第一个字母要大写,第二个字母要小写,因此元素符号为La,错误;
B、相对原子质量的单位为“1”不是“g”,错误;
C、镧原子核内质子数的=原子序数=57,原子的核外电子数=质子数=57,错误;
D、由图可知镧原子序数为57,正确;
故选D。
2.B
【详解】物质是由元素组成的,老年人缺钙会发生骨质疏松的“钙”指的是钙元素,故选B。
3.D
【详解】A.镍、铁名称都带“钅”,都是金属元素,不符合题意;
B.镍的核内质子数=原子序数=28,不符合题意;
C.铁的相对原子质量为55.845,不符合题意;
D.镍、铁原子核外电子层数相同,但次外层电子数不相同,符合题意;
故答案为:D
4.C
【详解】“加碘食盐、增铁酱油、高钙牛奶”等商品,这些商品中所强调的碘、铁、钙、硒、氟,都是说明这些物质的存在了这些元素,而不管以什么形式存在,或者便于说明如何存在,所以就用宏观的元素种类来说明。因此理解为元素,故选C
5.D
【详解】A、由不同种元素组成的纯净物一定是化合物,不同种元素组成的物质不一定是化合物,例如空气由不同种元素组成的物质,属于混合物,故A说法错误;
B、根据质量守恒定律,在反应前后元素的质量不变,氧气是由氧元素组成的,所以制取氧气的反应物中一定含氧元素,故B说法正确;
C、在原子中质子数等于核外电子数,但不是所有的微粒中质子数一定等于核外电子数,例如离子中质子数不等于核外电子数,故C说法错误;
D、蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快,正确;
故选D。
6.D
【详解】A、氦属于稀有气体元素,选项说法错误,故A不符合题意;
B、氦原子核外有2个电子,已达到稳定结构,选项说法错误,故B不符合题意;
C、相对原子质量的单位是“1”,常省略不写,选项说法错误,故C不符合题意;
D、氦原子核内有2个质子,选项说法正确,故D符合题意。
故选:D。
7.C
【详解】A、原子在化学变化中不能再分,分子在化学变化中可以变化成原子,A选项不正确,不符合题意;
B、不同元素的本质区别是质子数不同,B选项不正确,不符合题意;
C、花香四溢说明分子在不断运动,C选项正确,符合题意;
D、原子能直接构成物质,D选项不正确,不符合题意。故选C。
8.B
【分析】
【详解】A、不同元素的本质区别是质子数不同,错误;
B、原子中一定含有质子,正确;
C、 化学反应前后原子的种类不变,分子种类改变,错误;
D、保持水的化学性质的微粒是水分子,错误。
故选B。
9.D
【详解】A、②③所示的粒子的质子数相同,属于同种元素,但它们的最外层电子数不同,则化学性质不同,该选项说法不正确;
B、④粒子的质子数为13,对应的元素为铝元素,铝属于金属元素,该选项说法不正确;
C、③粒子的质子数为12,对应的为镁元素,镁元素不属于稀有气体元素,该选项说法不正确;
D、②③属于同种元素,则图中所示粒子是三种元素的粒子,该选项说法正确。
故选D。
10.C
【详解】A、③表示的是钠元素的钠离子,④表示的是氖元素,在元素周期表中不属于同一族,错误;
B、①是稀有气体的原子,化学性质稳定,而②在化学反应中容易失去电子,化学性质活泼,错误;
C、②能形成镁离子,⑤能形成硫离子,故形成的化合物由离子构成,正确;
D、①也具有稳定的结构,错误。
故选C。
11.B
【分析】金属、固体非金属、稀有气体是由原子直接构成的,它们的元素符号既能表示一个原子,又能表示一种元素,还能表示一种物质。
【详解】A、O可以表示氧元素,也可以表示表示一个氧原子,不能表示一种物质,故A错误;
B、Cu属于金属元素,可表示铜元素,表示一个铜原子,还能表示铜这种物质,故B正确;
C、N2是氮气的化学式,只能表示氮气这种物质,不能表示元素和原子,故C错误;
D、NaCl表示氯化钠这种物质,不能表示一种元素和一个原子,故D错误。
故选B。
12.B
【详解】A、根据元素周期表的信息可知,右上角的字母表示元素符合,该元素的元素符号为Ar,选项说法正确;
B、根据元素周期表的信息可知,中间汉字表示元素名称,该元素的名称为氩元素,带“气”字旁,属于非金属元素,选项说法不正确;
C、根据元素周期表的信息可知,左上角的数字表示原子序数,氩的原子序数为18,原子中原子序数=质子数=18,选项说法正确;
D、根据元素周期表的信息可知,元素名称下方的数字表示相对原子质量,氩的相对原子质量为39.95,选项说法正确。
故选B。
【点睛】本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元素名称、相对原子质量)是正确解答本题的关键。
13.D
【分析】根据物质的组成特点分析,单质是由同种元素组成的纯净物.化合物是由不同种元素组成的纯净物。
【详解】A.硬铝是铝的合金,属于混合物,不属于单质,冰水属于水的不同状态混合,是由氢元素和氧元素组成的纯净物,属于化合物,故选项A不符合题意;
B.红磷是磷元素组成的纯净物,属于单质,空气属于混合物,故选项B不符合题意;
C.氧化镁是由镁元素和氧元素组成的纯净物,属于化合物,液氮是氮气的液态形式,是由氮元素组成的纯净物,属于单质,故C选项不符合题意;
D.铁粉是铁元素组成的纯净物,属于单质,锰酸钾是由钾元素、锰元素和氧元素组成的纯净物,属于化合物,符合题意,故选D。
14.D
【详解】A、地壳中含量最高的元素是氧元素,不是硅元素,选项错误;
B、由题意得硅颗粒和聚乙二醇混合没有生成新物质,故属于物理变化,选项错误;
C、根据硅的偏旁是石字旁,故属于非金属元素,所以硅不属于金属单质,选项错误;
D、硅是固态非金属,由硅原子构成,选项正确;
答案为:D。
15.(1)19.00
(2)质子数不同
(3)BC
(4)B
【解析】(1)
根据元素周期表中的一格信息可知:元素名称下方的数字表示相对原子质量,氟元素的相对原子质量为19.00;
(2)
元素是质子数相同的一类原子的总称,①②中不同种元素最本质的区别是质子数不同;
(3)
元素的种类由质子数决定,B、C核内质子数都是17,所以是同种元素,故填BC;
(4)
元素的化学性质由最外层电子数决定,A与B最外层电子数相同,所以化学性质相似,故填:B。
16.(1) 28.09 三 非金属 1 失去 质子数不同
(2) 不属于 A
【详解】(1)①元素信息图中最下方的数字就是元素原子的相对原子质量,由图可知,硅的相对原子质量为28.09,故填28.09;元素信息图中左上角的数字就是元素的原子序数,原子序数等于原子核外的电子数,由图可知,硅元素的原子序数为14,则硅原子核外的电子数为14,其中第一电子层上的电子数为2,第二层电子数为8,第三层电子数为4,即硅原子核外的电子层数为3,所以硅元素位于元素周期表中的第三周期,故填三;硅元素的名称带有石字旁,属于非金属元素,故填非金属。
②由图可知,铷元素的原子序数为37,则其核内质子数为37,原子核内质子数等于核外电子数,则n=37 2 8 18 8=1,故填1;铷原子的最外层电子数为1,在化学反应中容易失去电子形成阳离子,故填失去;由元素的概念可知,铷元素与钠元素是两种不同的元素,它们的本质区别是原子中的质子数不同,故填质子数不同。
(2)①氚核聚变的过程中,氚原子核转变为氦原子核,而化学变化中原子核不变,只是核外的电子数发生改变,所以核聚变不属于化学变化,故填不属于。
②氚原子的质子数都为1,中子数为2,则氚原子的核外电子数也为1,则符合此结构的图形为A,故填A。
17. 16 7 F Mg2+ Ne 三 最外层电子数相等 同一列中,从上到下元素的最外层电子数相同
【详解】(1)由1~18的元素的原子结构示意图可知,每一行从左到右,最外层电子数依次增加,则硫元素的原子最外层电子数为6,Z=2+8+6=16,其核电荷数为16;氯元素的最外层电子数17=2+8+y,y=7.决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质,氯元素的原子的最外层电子数为7,氟原子的最外层电子数为7,故两者具有相似的化学性质;
(2)根据离子符号的表示法:在元素符号的右上角标明离子所带电荷数及电性,所以核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号为:Mg2+,它的核外电子排布与Ne元素的原子核外电子排布相同;磷原子核外有3个电子层,故位于第三周期;
(3)因为元素的最外层电子数决定元素的性质,由表中数据可知钠元素和钾元素的最外层电子数相等,所以两者化学性质相似;
(4)根据图中所给的信息及其元素周期律可得:同一行中,从左到右元素的最外层电子数依次增加,同一列中,从上到下元素的最外层电子数相同。
18. A D 汞
【分析】混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成,纯净物又分为单质和化合物,由同种元素组成的纯净物叫单质,由两种或两种以上的元素组成的纯净物叫化合物。
【详解】(1)混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成。纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质,氧气和液氧中只有氧分子,故属于单质的是A;由两种或两种以上的元素组成的纯净物叫化合物,冰水中只有水分子,故属于化合物的是D。
(2)在汞、水、氯化钠三种物质中,由原子直接构成的物质是汞。
【点睛】臭氧和氧气是同种元素组成的不同单质,属于同素异形体。
19.(1)四
(2)四
(3)
【分析】(1)
地壳中各元素的含量由高到低顺序为:氧、硅、铝、铁、钙,即铁元素排在第四位,故填四。
(2)
元素的原子核外有几个电子层,元素就位于元素周期表中的第几周期,铁元素位于元素周期表中的第四周期,则铁原子的原子核外有四个电子层,故填四。
(3)
根据某原子的相对原子相对质量=可知,这种铁原子的相对原子质量=,故填56。
20.(1)B
(2)解:R3+核外共有46个电子,所以R原子的质子数=46+3=49;
R原子的中子数比质子数多17个,所以R原子的中子数=49+17=66;
R原子的相对原子质量=49+66115。
答:R原子的相对原子质量是115。
【解析】(1)
A.由锶元素的名称可知锶元素属于金属元素,此选项错误;
B.原子序数=质子数=核电荷数=电子数,锶元素的原子序数为38,所以锶原子核内核电荷数为38,此选项正确;
C. 锶原子最外层由2个电子,容易失去最外层的2个电子,形成带两个单位正电荷的阳离子,所以锶离子Sr2+中有38-2=36个电子,此选项错误;
D.原子结构示意图中电子层数等于周期数,由图可知锶原子核外有五个电子层,所以锶元素位于元素周期表中第五周期,此选项错误;
故选B;
(2)
见答案。
21. BC 从左往右,最外层电子数依次增大(合理即可) Al2O3. S2- BD
【详解】(1)
A、Na和Cl的最外层电子数不同,不具有相似的化学性质;
B、O和S的最外层电子数相同,具有相似的化学性质;
C、F和Cl的最外层电子数相同,具有相似的化学性质;
D、Al和Ar的最外层电子数不同,不具有相似的化学性质;
故填:BC;
(2)第三周期元素原子的核外电子排布规律是:从左往右,最外层电子数依次增大(合理即可)
故填:从左往右,最外层电子数依次增大(合理即可);
(3)地壳中含量最多的金属元素是Al元素,在化合物中显+3价;地壳中含量最多的非金属元素O元素,Al元素显正价,故氧元素在该化合物中显-2价,故这二者组成的化合物的化学式为Al2O3。
(4)当x-y=8时,说明带有的是2个单位的负电荷,y=8,该粒子的核内质子数为16,故是硫离子,故填:S2-;
(5)A.NO和O2 的原子数都是2,电子数分别是15和16,不属于等电子体;
B.CO和N2的原子数都是2,电子数都是14,属于等电子体;
C.SO3和CO2的原子数和电子数都不同,不属于等电子体;
D.PO43-和SO42-的原子个数和电子个数都相等,属于等电子体。
故选:BD。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
