2019苏教版高中化学必修一专题1-1.3.2-电解质溶液
文档属性
| 名称 | 2019苏教版高中化学必修一专题1-1.3.2-电解质溶液 |  | |
| 格式 | pptx | ||
| 文件大小 | 47.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 08:45:21 | ||
图片预览






文档简介
(共25张PPT)
电
解
质
溶
液
电
解
质
与
非
电
解
质
知识点一
新课导入
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。
这是为什么呢
实验探究
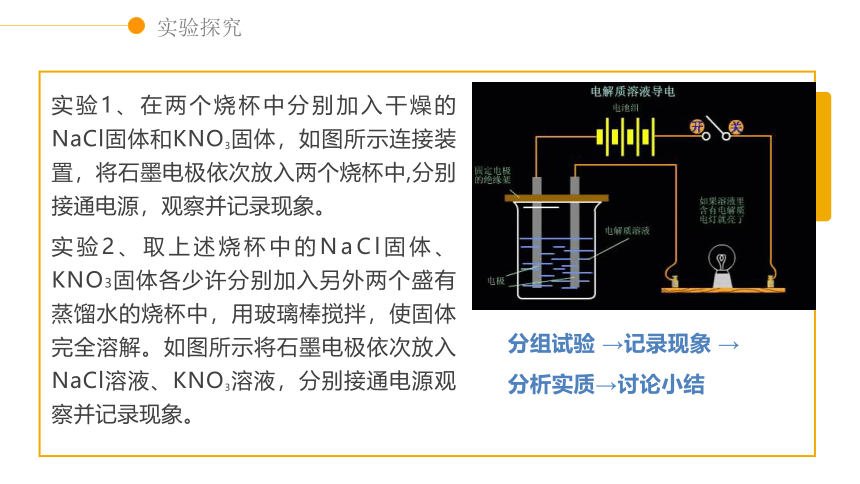
实验1、在两个烧杯中分别加入干燥的NaCl固体和KNO3固体,如图所示连接装置,将石墨电极依次放入两个烧杯中,分别接通电源,观察并记录现象。
实验2、取上述烧杯中的NaCl固体、KNO3固体各少许分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解。如图所示将石墨电极依次放入NaCl溶液、KNO3溶液,分别接通电源观察并记录现象。
分组试验 →记录现象 →
分析实质→讨论小结
实验探究
1、通过观察,发现两组实验的物质中不能导电的物质有 。
干燥的NaCl固体、KNO3固体
2、能导电的物质有 。
3、结合初中物质导电性实验,总结哪些物质的水溶液能导电?
NaCl溶液、KNO3溶液
酸、碱、盐的水溶液
不仅如此,NaCl、KNO3 、NaOH等固体分别加热至熔化,它们也能导电。
讲授新课
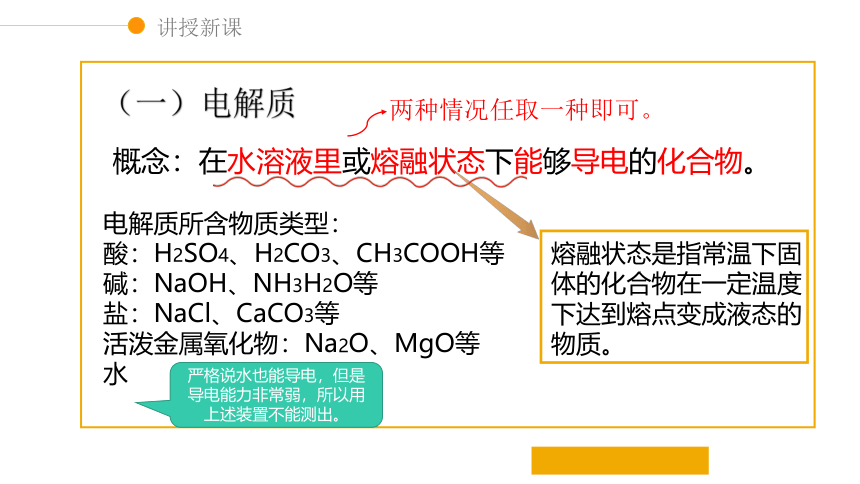
(一)电解质
概念:在水溶液里或熔融状态下能够导电的化合物。
电解质所含物质类型:
酸:H2SO4、H2CO3、CH3COOH等
碱:NaOH、NH3H2O等
盐:NaCl、CaCO3等
活泼金属氧化物:Na2O、MgO等
水
熔融状态是指常温下固体的化合物在一定温度下达到熔点变成液态的物质。
两种情况任取一种即可。
严格说水也能导电,但是导电能力非常弱,所以用上述装置不能测出。
讲授新课
(二)非电解质
概念:在水溶液里或熔融状态下不能够导电的化合物。
非电解质所含物质类型:
非金属化合物:SO2、CO2、CO、P2O5等
非酸性气态氢化物:如NH
大部分有机物:蔗糖、酒精、CH4、乙醇等
蒸馏水
两种情况必须同时满足。
情景解疑
人手上会沾有NaCl(汗液的成分之一),有时也会沾有其他的电解质,当遇到水时,形成电解质溶液。电解质溶液能导电,因此湿手触摸电源容易发生触电事故。
电解质 非电解质
概念
相同点 不同点
本质区别
二、电解质和非电解质的比较
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里或熔融状态下不能导电的化合物。
均为化合物
水溶液或熔融状态下能导电
水溶液或熔融状态下不能导电
在水溶液或熔融状态下自身能发生电离
在水溶液或熔融状态下自身不能发生电离
从微观角度比较电解质与非电解质溶液
NaCl溶解
蔗糖溶解
深入探索
三、电解质与非电解质的辨析
★问题一:在水溶液中不能导电的化合物都不是电解质?
如BaSO4水溶液几乎不导电,那BaSO4是电解质吗?
答:错。
导电的原因是有自由移动的离子,BaSO4难溶于水,因此其水溶液几乎不导电,但BaSO4在熔融状态下能产生自由移动的离子,进而导电,所以BaSO4是电解质。
深入探索
★问题二:电解质溶液能导电,那电解质本身一定导电吗?
如NaCl溶液能导电,NaCl晶体一定导电吗?液态HCl呢?
答:不一定。
因为NaCl晶体里含有带正电的带负电的由于静电作用,它们按一定规则紧密地排列着,这些离子不能自由移动,因而NaCl晶体不能导电。
液态HCl是熔融状态下的HCl,同时HCl是共价化合物,熔融状态下不能产生自由移动的离子,因此液态HCl不能导电,只有溶于水才能导电。
深入探索
★问题三:能导电的一定是电解质吗?
如氯化钠溶液能导电,氯化钠溶液是电解质吗?铁呢?
答:不是。
氯化钠溶液是水与NaCl的混合物,不是化合物,而NaCl是化合物,是电解质;铁是金属单质,不是化合物,所以铁不是电解质,铁也不是非电解质。
深入探索
★问题四:在水溶液中能导电的都是电解质吗?
如SO3水溶液能导电,那SO3是电解质吗?
答:不是。
导电的原因是有自由移动的电子,但是,SO3是与水反应生成了H2SO4,H2SO4电离出了自由移动的离子,而不是SO3自身可以电离,因此H2SO4是电解质,而不能说SO3是电解质。
归纳探讨
[归纳1]对电解质概念的理解
电解质导电的条件是在水溶液中或熔融状态下,两个条件具备一个即可。
(2)所有酸在水溶液中都能导电,在熔融状态下都不能导电。
(1)有些电解质通常在水溶液中不能导电,在熔融状态下能导电,如BaSO4,其水溶液几乎不导电,因为BaSO4难溶于水。
(3)电解质本身不一定能导电,如NaCl晶体。
(5)电解质溶液导电是由于电解质本身能电离出自由移动的离子,溶于水能导电的化合物不一定是电解质。
(4)能导电的物质不一定是电解质,如石墨、金属单质。
[归纳2]判断电解质与非电解质看“三步”:
1、首先看是不是化合物:电解质与非电解质都属于化合物。单质(如石墨)、混合物(如盐酸)既不是电解质,也不是非电解质。
2、其次看在水溶液里或者在熔融状态下能否导电;有些电解质溶于水导电,但熔融状态下不能导电,如HCl气体,有些电解质只有熔融状态下才能的导电,如BaSO4。
3、最后看是否是自身发生电离而导电,溶于水能导电的化合物不一定是电解质,如SO2、SO3、CO2等水溶液能导电,是因为它们与水反应生成对应的酸电离出了自由移动的离子。只能说是它们的酸是电解质,而不能说它们本身是电解质。
学以致用
1、下列属于电解质的是( )
A、食盐水
B、乙酸
C、钠
D、乙醇
解析:A、食盐水是混合物,不是化合物,所以不是电解质。C、那是金属单质,不是化合物,所以不是电解质也不是非电解质。D、乙醇是有机物,自身不能电离出了自由移动的离子,所以不是电解质。
B
学以致用
2、下列有关电解质的叙述正确的是( )
A、液态HCl不导电,所以HCl是非电解质
B、NH3的水溶能够导电,所以NH3是电解质
C、液态Cl2不导电,所以Cl2是非电解质
D、熔融的NaCl可以导电,所以NaCl是电解质
解析:A项错误,虽然液态HCl不导电,但是HCl溶于水能导电,所以HCl是电解质。B项错误,NH3的水溶液能够导电是因为氨气和水反应生成了一水合氨,一水合氨是电解质,NH3是非电解质。C项错误,Cl2是单质,不属于非电解质。D项正确,熔融的NaCl可以导电,所以NaCl是电解质。
D
典型例题剖析
1、现有一种固体化合物X不导电,但熔融状态下或溶于水导电,下列说法正确的是( )
A.X只能是盐 B.X可能是酸
C.X一定是电解质 D.X可能是非电解质
解析:在水溶液中或熔融状态下能导电的化合物为电解质,所有的酸、碱、盐和绝大多数金属氧化物均为电解质。由分析可知,X可能是盐或碱,A项错误;虽然酸属于电解质,但是酸只能在水溶液中导电,在熔融状态下不能导电,X不可能是酸,B项错误;X一定为电解质,C项正确;X不可能为非电解质,D项错误。
C
典型例题剖析
2、下列说法正确的是( )
A.铜,石墨均能导电,所以它们都是电解质
B.氨气,二氧化碳的水溶液都能导电,所以它们都是电解质溶液
C.液态氯化氢,固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖,酒精在水溶液里和熔融状态下都不能导电,所以它们都是非电解质
解析:A错,铜和石墨是单质,所以既不是电解质也不是非电解质。B错,NH4、CO2的水溶液能导电,是因为NH3、CO2分别和水反应生成的NH3●H2O、H2CO3电离出离子而使溶液导电,NH3和CO2自身并没有电离,故NH3、CO2是非电解质。C错,HCl和NaCl溶于水能电离出自由移动的离子而使溶液导电,所以氯化氢和氯化钠是电解质。答案:D
D
典型例题剖析
例题总结提升
解答有关电解质问题的思维流程
首先,判断物质是否属于化合物,单质、混合物既不是电解质,也不是非电解质。
其次,判断化合物在溶液里或熔融状态下能否导电,至少其一导电为电解质,两者都不导电为非电解质。
最后,根据电解质所处状态(液态、 熔融态)和化合物的类型,判断电解质在所处状态下能否导电。
核心素质培养
1.有以下物质:①氨水、②熔融的MgCl2、③CuSO4粉末、④NaOH固体、⑤金属铜、⑥蔗糖。有关它们的说法正确的是( )
A.能导电的有①②③④⑤
B.属于电解质的有①②③④
C.不能导电的有③④⑥
D.属于纯净物的只有④⑤⑥
解析:能导电必须含有自由移动的离子或电子,故为①②⑤,A项错误;电解质是在水溶液中或熔融状态下能够导电的化合物,故为②③④. B项错误;由上述分析可知③④⑥不能导电,C项正确;只由一种物质组成的属于纯净物,②③④⑤⑥属于纯净物,D项错误。
C
核心素质培养
2.利用分类法研究化学物质可系统、全面地认识物质的性质。
I.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCI、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式)① 、② 、③ 。
(2)写出Na2CO3与足量稀硫酸反应的化学方程式:
。
Ⅱ.现有以下物质:①NaCl晶体、②液态HCI、③CaCO3固体、④熔融KCI、⑤蔗糖、⑥铜、⑦CO2、⑧H2SO4、⑨KOH固体。
(1)以上物质中能导电的是 。
(2)以上物质中属于电解质的是 ,属于非电解质的是 。(3)以上物质中,溶于水能导电的物质是 。
CO2
H2O
Na2CO3
Na2CO3+H2SO4=H2O+CO2+Na2SO4
④⑥
①②③④⑧⑨
⑤⑦
①②④⑦⑧⑨
待
续
HAPPY
下次课见
电
解
质
溶
液
电
解
质
与
非
电
解
质
知识点一
新课导入
生活常识告诉我们,给电器设备通电时,湿手操作容易发生触电事故。
这是为什么呢
实验探究
实验1、在两个烧杯中分别加入干燥的NaCl固体和KNO3固体,如图所示连接装置,将石墨电极依次放入两个烧杯中,分别接通电源,观察并记录现象。
实验2、取上述烧杯中的NaCl固体、KNO3固体各少许分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解。如图所示将石墨电极依次放入NaCl溶液、KNO3溶液,分别接通电源观察并记录现象。
分组试验 →记录现象 →
分析实质→讨论小结
实验探究
1、通过观察,发现两组实验的物质中不能导电的物质有 。
干燥的NaCl固体、KNO3固体
2、能导电的物质有 。
3、结合初中物质导电性实验,总结哪些物质的水溶液能导电?
NaCl溶液、KNO3溶液
酸、碱、盐的水溶液
不仅如此,NaCl、KNO3 、NaOH等固体分别加热至熔化,它们也能导电。
讲授新课
(一)电解质
概念:在水溶液里或熔融状态下能够导电的化合物。
电解质所含物质类型:
酸:H2SO4、H2CO3、CH3COOH等
碱:NaOH、NH3H2O等
盐:NaCl、CaCO3等
活泼金属氧化物:Na2O、MgO等
水
熔融状态是指常温下固体的化合物在一定温度下达到熔点变成液态的物质。
两种情况任取一种即可。
严格说水也能导电,但是导电能力非常弱,所以用上述装置不能测出。
讲授新课
(二)非电解质
概念:在水溶液里或熔融状态下不能够导电的化合物。
非电解质所含物质类型:
非金属化合物:SO2、CO2、CO、P2O5等
非酸性气态氢化物:如NH
大部分有机物:蔗糖、酒精、CH4、乙醇等
蒸馏水
两种情况必须同时满足。
情景解疑
人手上会沾有NaCl(汗液的成分之一),有时也会沾有其他的电解质,当遇到水时,形成电解质溶液。电解质溶液能导电,因此湿手触摸电源容易发生触电事故。
电解质 非电解质
概念
相同点 不同点
本质区别
二、电解质和非电解质的比较
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里或熔融状态下不能导电的化合物。
均为化合物
水溶液或熔融状态下能导电
水溶液或熔融状态下不能导电
在水溶液或熔融状态下自身能发生电离
在水溶液或熔融状态下自身不能发生电离
从微观角度比较电解质与非电解质溶液
NaCl溶解
蔗糖溶解
深入探索
三、电解质与非电解质的辨析
★问题一:在水溶液中不能导电的化合物都不是电解质?
如BaSO4水溶液几乎不导电,那BaSO4是电解质吗?
答:错。
导电的原因是有自由移动的离子,BaSO4难溶于水,因此其水溶液几乎不导电,但BaSO4在熔融状态下能产生自由移动的离子,进而导电,所以BaSO4是电解质。
深入探索
★问题二:电解质溶液能导电,那电解质本身一定导电吗?
如NaCl溶液能导电,NaCl晶体一定导电吗?液态HCl呢?
答:不一定。
因为NaCl晶体里含有带正电的带负电的由于静电作用,它们按一定规则紧密地排列着,这些离子不能自由移动,因而NaCl晶体不能导电。
液态HCl是熔融状态下的HCl,同时HCl是共价化合物,熔融状态下不能产生自由移动的离子,因此液态HCl不能导电,只有溶于水才能导电。
深入探索
★问题三:能导电的一定是电解质吗?
如氯化钠溶液能导电,氯化钠溶液是电解质吗?铁呢?
答:不是。
氯化钠溶液是水与NaCl的混合物,不是化合物,而NaCl是化合物,是电解质;铁是金属单质,不是化合物,所以铁不是电解质,铁也不是非电解质。
深入探索
★问题四:在水溶液中能导电的都是电解质吗?
如SO3水溶液能导电,那SO3是电解质吗?
答:不是。
导电的原因是有自由移动的电子,但是,SO3是与水反应生成了H2SO4,H2SO4电离出了自由移动的离子,而不是SO3自身可以电离,因此H2SO4是电解质,而不能说SO3是电解质。
归纳探讨
[归纳1]对电解质概念的理解
电解质导电的条件是在水溶液中或熔融状态下,两个条件具备一个即可。
(2)所有酸在水溶液中都能导电,在熔融状态下都不能导电。
(1)有些电解质通常在水溶液中不能导电,在熔融状态下能导电,如BaSO4,其水溶液几乎不导电,因为BaSO4难溶于水。
(3)电解质本身不一定能导电,如NaCl晶体。
(5)电解质溶液导电是由于电解质本身能电离出自由移动的离子,溶于水能导电的化合物不一定是电解质。
(4)能导电的物质不一定是电解质,如石墨、金属单质。
[归纳2]判断电解质与非电解质看“三步”:
1、首先看是不是化合物:电解质与非电解质都属于化合物。单质(如石墨)、混合物(如盐酸)既不是电解质,也不是非电解质。
2、其次看在水溶液里或者在熔融状态下能否导电;有些电解质溶于水导电,但熔融状态下不能导电,如HCl气体,有些电解质只有熔融状态下才能的导电,如BaSO4。
3、最后看是否是自身发生电离而导电,溶于水能导电的化合物不一定是电解质,如SO2、SO3、CO2等水溶液能导电,是因为它们与水反应生成对应的酸电离出了自由移动的离子。只能说是它们的酸是电解质,而不能说它们本身是电解质。
学以致用
1、下列属于电解质的是( )
A、食盐水
B、乙酸
C、钠
D、乙醇
解析:A、食盐水是混合物,不是化合物,所以不是电解质。C、那是金属单质,不是化合物,所以不是电解质也不是非电解质。D、乙醇是有机物,自身不能电离出了自由移动的离子,所以不是电解质。
B
学以致用
2、下列有关电解质的叙述正确的是( )
A、液态HCl不导电,所以HCl是非电解质
B、NH3的水溶能够导电,所以NH3是电解质
C、液态Cl2不导电,所以Cl2是非电解质
D、熔融的NaCl可以导电,所以NaCl是电解质
解析:A项错误,虽然液态HCl不导电,但是HCl溶于水能导电,所以HCl是电解质。B项错误,NH3的水溶液能够导电是因为氨气和水反应生成了一水合氨,一水合氨是电解质,NH3是非电解质。C项错误,Cl2是单质,不属于非电解质。D项正确,熔融的NaCl可以导电,所以NaCl是电解质。
D
典型例题剖析
1、现有一种固体化合物X不导电,但熔融状态下或溶于水导电,下列说法正确的是( )
A.X只能是盐 B.X可能是酸
C.X一定是电解质 D.X可能是非电解质
解析:在水溶液中或熔融状态下能导电的化合物为电解质,所有的酸、碱、盐和绝大多数金属氧化物均为电解质。由分析可知,X可能是盐或碱,A项错误;虽然酸属于电解质,但是酸只能在水溶液中导电,在熔融状态下不能导电,X不可能是酸,B项错误;X一定为电解质,C项正确;X不可能为非电解质,D项错误。
C
典型例题剖析
2、下列说法正确的是( )
A.铜,石墨均能导电,所以它们都是电解质
B.氨气,二氧化碳的水溶液都能导电,所以它们都是电解质溶液
C.液态氯化氢,固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖,酒精在水溶液里和熔融状态下都不能导电,所以它们都是非电解质
解析:A错,铜和石墨是单质,所以既不是电解质也不是非电解质。B错,NH4、CO2的水溶液能导电,是因为NH3、CO2分别和水反应生成的NH3●H2O、H2CO3电离出离子而使溶液导电,NH3和CO2自身并没有电离,故NH3、CO2是非电解质。C错,HCl和NaCl溶于水能电离出自由移动的离子而使溶液导电,所以氯化氢和氯化钠是电解质。答案:D
D
典型例题剖析
例题总结提升
解答有关电解质问题的思维流程
首先,判断物质是否属于化合物,单质、混合物既不是电解质,也不是非电解质。
其次,判断化合物在溶液里或熔融状态下能否导电,至少其一导电为电解质,两者都不导电为非电解质。
最后,根据电解质所处状态(液态、 熔融态)和化合物的类型,判断电解质在所处状态下能否导电。
核心素质培养
1.有以下物质:①氨水、②熔融的MgCl2、③CuSO4粉末、④NaOH固体、⑤金属铜、⑥蔗糖。有关它们的说法正确的是( )
A.能导电的有①②③④⑤
B.属于电解质的有①②③④
C.不能导电的有③④⑥
D.属于纯净物的只有④⑤⑥
解析:能导电必须含有自由移动的离子或电子,故为①②⑤,A项错误;电解质是在水溶液中或熔融状态下能够导电的化合物,故为②③④. B项错误;由上述分析可知③④⑥不能导电,C项正确;只由一种物质组成的属于纯净物,②③④⑤⑥属于纯净物,D项错误。
C
核心素质培养
2.利用分类法研究化学物质可系统、全面地认识物质的性质。
I.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCI、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式)① 、② 、③ 。
(2)写出Na2CO3与足量稀硫酸反应的化学方程式:
。
Ⅱ.现有以下物质:①NaCl晶体、②液态HCI、③CaCO3固体、④熔融KCI、⑤蔗糖、⑥铜、⑦CO2、⑧H2SO4、⑨KOH固体。
(1)以上物质中能导电的是 。
(2)以上物质中属于电解质的是 ,属于非电解质的是 。(3)以上物质中,溶于水能导电的物质是 。
CO2
H2O
Na2CO3
Na2CO3+H2SO4=H2O+CO2+Na2SO4
④⑥
①②③④⑧⑨
⑤⑦
①②④⑦⑧⑨
待
续
HAPPY
下次课见
