2019苏教版高中化学必修一专题4-4.1.硫酸的工业制备j及浓硫酸的性质(共36张PPT)
文档属性
| 名称 | 2019苏教版高中化学必修一专题4-4.1.硫酸的工业制备j及浓硫酸的性质(共36张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 48.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-15 21:08:46 | ||
图片预览










文档简介
(共36张PPT)
N
F
S
O
A
I
硫酸的工业制备
浓硫酸的性质
专题4 第一单元
fashion
H
硫酸的工业制备
胆矾 CuSO4 5H2O
绿矾 FeSO4 7H2O
CuSO4·5H2O=CuO+SO3↑+5H2O
SO3 + H2O=H2SO4
2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14 H2O
SO3+H2O=H2SO4
△
△
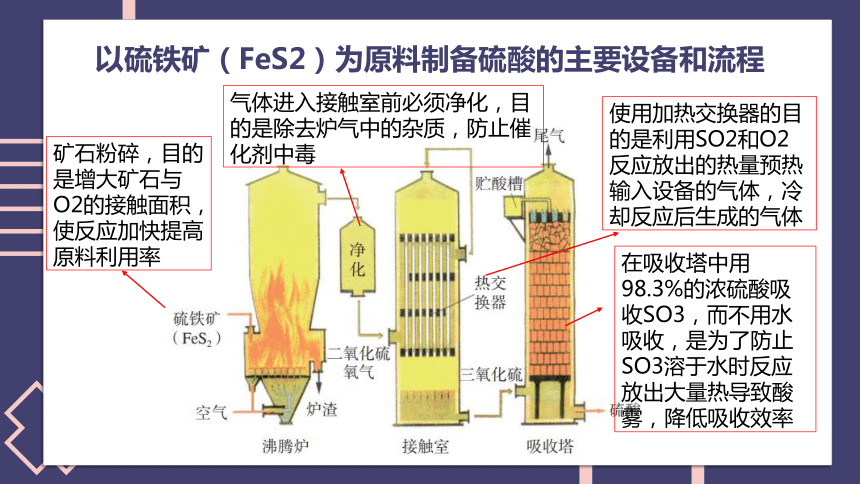
以硫铁矿(FeS2)为原料制备硫酸的主要设备和流程
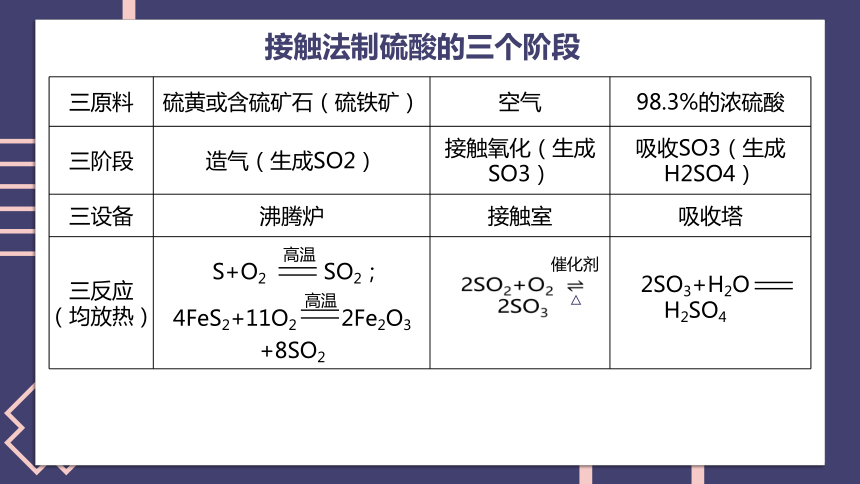
三原料 硫黄或含硫矿石(硫铁矿) 空气 98.3%的浓硫酸
三阶段 造气(生成SO2) 接触氧化(生成SO3) 吸收SO3(生成H2SO4)
三设备 沸腾炉 接触室 吸收塔
三反应 (均放热)
2SO3+H2O
H2SO4
S+O2 SO2;
高温
4FeS2+11O2 2Fe2O3
+8SO2
高温
接触法制硫酸的三个阶段
2SO2+O2
2SO3
催化剂
△
阅读:课本93-94页
思考并回答下列问题:
(1)硫铁矿为什么要粉碎?
(2)从沸腾炉中出来的气体在进去接触室前为什么要净化?
(3)热交换器起什么作用?
(4)为什么用98.3%的浓硫酸吸收而不用水吸收?
以硫铁矿(FeS2)为原料制备硫酸的主要设备和流程
在吸收塔中用98.3%的浓硫酸吸收SO3,而不用水吸收,是为了防止SO3溶于水时反应放出大量热导致酸雾,降低吸收效率
气体进入接触室前必须净化,目的是除去炉气中的杂质,防止催化剂中毒
使用加热交换器的目的是利用SO2和O2反应放出的热量预热输入设备的气体,冷却反应后生成的气体
矿石粉碎,目的是增大矿石与O2的接触面积,使反应加快提高原料利用率
阅读:课本94页选择决策
硫铁矿
硫磺
FeS2质量分数为20%~50%
原料价格便宜
矿渣、废气多
流程、装置复杂,设备投资高
原料价格较贵
杂质少
工艺流程和设备相对简易
不产生矿渣,可免去气体净化
具体选用何种硫酸制备工艺,应根据实际条件和要求进行决策。
化学工业制备的要求
1.原料廉价且稳定,最好能结合本地地理环境的优势资源,以降低运输成本。
2.从环保、成本等角度选择合适的化学反应,设计合理的反应装置,对原料进行粉碎等预处理,使得原料尽可能地被富集,保证在反应中能充分接触。
3.制备流程简单高效,能耗低,反应放出的热量和剩余物质尽可能加以循环利用,生成的副产物较少
4.制备过程绿色环保,没有使用或生成对环境有害的物质,若有,须对有害物质进行无害化处理
在硫酸的工业制法中,下列说法正确的是( )
A.黄铁矿煅烧前要粉碎,因为大块黄铁矿不能燃烧
B.从沸腾炉出来的气体只有SO2
C.SO2氧化生成SO3,SO2能全部转化为SO3
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
D
学以致用
H2SO4(稀)=2H++SO2-4
具有酸的通性
浓硫酸
H2SO4
具有独特的性质
浓硫酸的性质
浓硫酸的性质
颜色 状态 沸点 密度 挥发性 溶解性
无色 粘稠油状液体 高 大(1.84g cm3) 难 任意比与水混溶
1.物理性质
2.浓硫酸的特性
①吸水性
②脱水性
③强氧化性
①吸水性
实验记录
实验序号 实验现象 结论
实验1
蓝色固体变成白色
浓硫酸可吸收结晶水合物中的结晶水
实验序号 实验现象 结论
实验2
实验记录(教师实验)
蔗糖逐渐变黑,体积膨胀,形成黑色疏松多孔的海绵状的炭,并放出刺激性气味的气体
浓硫酸具有脱水性:
C12H22O11 12C+11H2O
浓硫酸具有强氧化性,把C氧化成CO2,并有SO2放出
浓硫酸
②脱水性
③强氧化性
实验序号 实验现象 结论
实验3
实验记录
a中铜片表面变黑,有气泡逸出;b中品红溶液逐渐变为无色;
c中紫色石蕊溶液变红;
冷却后,将a中的溶液倒入水中,溶液变蓝。
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
△
总结 浓硫酸的特性
(1)吸水性
①浓硫酸可吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水。
②常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等),不能干燥碱性气体(如NH3等)和强还原性气体(如H2S)。
(2)脱水性
①蔗糖逐渐变黑,原因是浓硫酸具有脱水性:
C12H22O11 12C+11H2O
浓硫酸
②体积膨胀,形成黑色疏松多孔的海绵状的炭,并放出刺激性气味的气体。原因浓硫酸具有强氧化性,把C氧化成CO2,并有SO2气体放出。
C+2H2SO4(浓) CO2↑+SO2↑+2H2O
△
拓展 浓硫酸吸水性和脱水性的区别
吸水性
脱水性
浓硫酸吸取物质本身存在的水或结晶水的性质
浓硫酸将组成有机物的H、O元素按原子个数2:1以“H2O”的形式脱去的性质
二者的根本区别在于物质本身是否存在水分子
总结 浓硫酸的特性
(3)强氧化性
①本质:浓硫酸具有强氧化性,是因为H2SO4分子+6价的硫原子具有很强的得电子能力。
②反应规律:
a.常温下与活泼金属反应(除铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸变稀后,生成的气体为H2。
Mg+2H2SO4 (浓) MgSO4+SO2↑+2H2O
Mg+H2SO4(稀) MgSO4+H2↑
Fe、Al的钝化
在常温下,铁、铝等少数金属遇浓硫酸会发生反应,表面生成一层致密的氧化物薄膜,而出现“钝化”现象
总结 浓硫酸的特性
b.与不活泼金属和非金属反应规律
ⅰ.反应需要加热,否则不反应。
Cu+2H2SO4 (浓) CuSO4+2H2O+SO2↑
△
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
△
ⅱ.还原产物一般为SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
ⅲ.浓硫酸与金属反应时,既表现酸性有表现强氧化性,而与非金属反应时,只表现强氧化性
ⅳ.随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应就停止。
(3)强氧化性
总结 浓硫酸的特性
c.与具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
(3)强氧化性
H2S+H2SO4 (浓) S↓+SO2↑+2H2O
e.H2、N2、O2、F2、Cl2、Br2等不能被浓硫酸氧化
d.与碱性气体反应,如NH3。
2NH3+H2SO4 (浓) (NH4)2SO4
浓硫酸的用途
几种重要的硫酸盐
硫酸盐 常见的存在形式与俗名 用途
硫酸钙 CaSO4 2H2O,生石膏 2CaSO2 H2O,熟石膏 利用熟石膏向生石膏的转化制取石膏绷带、模型;调节水泥凝固时间;制硫酸
硫酸钡 BaSO4,重晶石 医疗上用作“钡餐”;用作白色颜料
硫酸亚铁 FeSO4 7H2O,绿矾 医药(补铁剂);生产净水剂和铁红
浓硫酸与稀硫酸的比较
项目 浓硫酸 稀硫酸
酸性 强弱 弱(主要以分子的状态存在,不能用来制取氢气) 强(可以用来与活泼金属反应制取氧气)
化学方程式 H2SO4+2NaOH=Na2SO4+2H2O 2NaCl+H2SO4Na2SO4+2HCl↑ H2SO4+2NaOH=Na2SO4+2H2O
2NH3+H2SO4=(NH4)2SO4
应用 制取氯化氢等挥发性酸 除铁锈,制硫酸铵等盐类
氧化性 强弱 强氧化性(硫元素被还原) 弱氧化性(氢元素被还原)
化学方程式 Cu+2H2SO4CuSO4+SO2↑+2H2O Zn+H2SO4=ZnSO4+H2↑
应用 精炼石油,制造炸药等 实验室制取氢气、制盐等
浓硫酸与稀硫酸的比较
吸水性 有无 有 无
应用 干燥剂 无
脱水性 有无 有 无
化学方程式 浓硫酸 C12H22O11→12C+11H2O 无
应用 在有机反应中作脱水剂,制染料等 无
1.下列有关铜与过量浓硫酸反应的实验的说法不正确的是( )
A.喷有碱液的棉花是为了防止SO2污染环境
B.将水注入反应后冷却的试管a,溶液变为蓝色
C.铜片表面先发黑,反应完全后试管a底部有灰白色固体
D. SO2能使KMnO4水溶液褪色
学以致用
B
2.在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶被所含离子的推斯中正确的是( )
A.一定含有SO2-4
B.含有SO2-4和Ag+
C.可能含有SO2-4或SO2-3或Ag+或SO2-4、SO2-3
D.可能含有SO2-3或CO2-3
学以致用
C
课堂小结
三原料
三阶段
三设备
三反应 (均放热)
S+O2 SO2;
高温
4FeS2+11O2 2Fe2O3
+8SO2
高温
1.硫酸的制备
2SO2+O2
2SO3
催化剂
△
2SO3+H2O
H2SO4
硫黄或含硫矿石(硫铁矿)
空气
98.3%的浓硫酸
造气(生成SO2)
接触氧化
(生成SO3)
吸收SO3
(生成H2SO4)
沸腾炉
接触室
吸收塔
2.硫酸的性质
硫酸
酸的通性
能与酸碱指示剂作用,能与活泼金属、碱、碱性氧化物及其某些盐反应
浓硫酸的特性
吸水性
脱水性
强氧化性
单元典型例题剖析
3、利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 ① ② ③ 实验结论
A 浓盐酸 KMnO4 紫色石蕊溶液 氯气具有酸性、漂白性
B 浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性
C 稀硝酸 Na2SO3 品红溶液 实验室制取并检验SO2
D 浓硝酸 Na2CO3 澄清石灰水 氧化性:硝酸>碳酸
B
4、将适量的蔗糖( C12H22O11)放入烧杯,滴人几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热(如图所示)。下列说法不正确的是( )
D
A.在该过程中,固体变黑体现了浓硫酸的脱水性
B.有刺激性气味的气体生成,体现了浓硫酸的强氧化性
C.将产生的气体通入品红溶液后,溶液褪色,加热,颜色恢复,说明该气体中一定含有SO2
D.将产生的气体通人澄清石灰水,溶液变浑浊,说明该气体中一定含有CO2
U
H
N
O
A
K
T
Y
N
F
S
O
A
I
硫酸的工业制备
浓硫酸的性质
专题4 第一单元
fashion
H
硫酸的工业制备
胆矾 CuSO4 5H2O
绿矾 FeSO4 7H2O
CuSO4·5H2O=CuO+SO3↑+5H2O
SO3 + H2O=H2SO4
2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14 H2O
SO3+H2O=H2SO4
△
△
以硫铁矿(FeS2)为原料制备硫酸的主要设备和流程
三原料 硫黄或含硫矿石(硫铁矿) 空气 98.3%的浓硫酸
三阶段 造气(生成SO2) 接触氧化(生成SO3) 吸收SO3(生成H2SO4)
三设备 沸腾炉 接触室 吸收塔
三反应 (均放热)
2SO3+H2O
H2SO4
S+O2 SO2;
高温
4FeS2+11O2 2Fe2O3
+8SO2
高温
接触法制硫酸的三个阶段
2SO2+O2
2SO3
催化剂
△
阅读:课本93-94页
思考并回答下列问题:
(1)硫铁矿为什么要粉碎?
(2)从沸腾炉中出来的气体在进去接触室前为什么要净化?
(3)热交换器起什么作用?
(4)为什么用98.3%的浓硫酸吸收而不用水吸收?
以硫铁矿(FeS2)为原料制备硫酸的主要设备和流程
在吸收塔中用98.3%的浓硫酸吸收SO3,而不用水吸收,是为了防止SO3溶于水时反应放出大量热导致酸雾,降低吸收效率
气体进入接触室前必须净化,目的是除去炉气中的杂质,防止催化剂中毒
使用加热交换器的目的是利用SO2和O2反应放出的热量预热输入设备的气体,冷却反应后生成的气体
矿石粉碎,目的是增大矿石与O2的接触面积,使反应加快提高原料利用率
阅读:课本94页选择决策
硫铁矿
硫磺
FeS2质量分数为20%~50%
原料价格便宜
矿渣、废气多
流程、装置复杂,设备投资高
原料价格较贵
杂质少
工艺流程和设备相对简易
不产生矿渣,可免去气体净化
具体选用何种硫酸制备工艺,应根据实际条件和要求进行决策。
化学工业制备的要求
1.原料廉价且稳定,最好能结合本地地理环境的优势资源,以降低运输成本。
2.从环保、成本等角度选择合适的化学反应,设计合理的反应装置,对原料进行粉碎等预处理,使得原料尽可能地被富集,保证在反应中能充分接触。
3.制备流程简单高效,能耗低,反应放出的热量和剩余物质尽可能加以循环利用,生成的副产物较少
4.制备过程绿色环保,没有使用或生成对环境有害的物质,若有,须对有害物质进行无害化处理
在硫酸的工业制法中,下列说法正确的是( )
A.黄铁矿煅烧前要粉碎,因为大块黄铁矿不能燃烧
B.从沸腾炉出来的气体只有SO2
C.SO2氧化生成SO3,SO2能全部转化为SO3
D.SO3用98.3%的浓硫酸吸收,目的是防止形成酸雾,以便使SO3吸收完全
D
学以致用
H2SO4(稀)=2H++SO2-4
具有酸的通性
浓硫酸
H2SO4
具有独特的性质
浓硫酸的性质
浓硫酸的性质
颜色 状态 沸点 密度 挥发性 溶解性
无色 粘稠油状液体 高 大(1.84g cm3) 难 任意比与水混溶
1.物理性质
2.浓硫酸的特性
①吸水性
②脱水性
③强氧化性
①吸水性
实验记录
实验序号 实验现象 结论
实验1
蓝色固体变成白色
浓硫酸可吸收结晶水合物中的结晶水
实验序号 实验现象 结论
实验2
实验记录(教师实验)
蔗糖逐渐变黑,体积膨胀,形成黑色疏松多孔的海绵状的炭,并放出刺激性气味的气体
浓硫酸具有脱水性:
C12H22O11 12C+11H2O
浓硫酸具有强氧化性,把C氧化成CO2,并有SO2放出
浓硫酸
②脱水性
③强氧化性
实验序号 实验现象 结论
实验3
实验记录
a中铜片表面变黑,有气泡逸出;b中品红溶液逐渐变为无色;
c中紫色石蕊溶液变红;
冷却后,将a中的溶液倒入水中,溶液变蓝。
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
△
总结 浓硫酸的特性
(1)吸水性
①浓硫酸可吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水。
②常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等),不能干燥碱性气体(如NH3等)和强还原性气体(如H2S)。
(2)脱水性
①蔗糖逐渐变黑,原因是浓硫酸具有脱水性:
C12H22O11 12C+11H2O
浓硫酸
②体积膨胀,形成黑色疏松多孔的海绵状的炭,并放出刺激性气味的气体。原因浓硫酸具有强氧化性,把C氧化成CO2,并有SO2气体放出。
C+2H2SO4(浓) CO2↑+SO2↑+2H2O
△
拓展 浓硫酸吸水性和脱水性的区别
吸水性
脱水性
浓硫酸吸取物质本身存在的水或结晶水的性质
浓硫酸将组成有机物的H、O元素按原子个数2:1以“H2O”的形式脱去的性质
二者的根本区别在于物质本身是否存在水分子
总结 浓硫酸的特性
(3)强氧化性
①本质:浓硫酸具有强氧化性,是因为H2SO4分子+6价的硫原子具有很强的得电子能力。
②反应规律:
a.常温下与活泼金属反应(除铁、铝除外)表现强氧化性和酸性,生成硫酸盐和SO2,硫酸变稀后,生成的气体为H2。
Mg+2H2SO4 (浓) MgSO4+SO2↑+2H2O
Mg+H2SO4(稀) MgSO4+H2↑
Fe、Al的钝化
在常温下,铁、铝等少数金属遇浓硫酸会发生反应,表面生成一层致密的氧化物薄膜,而出现“钝化”现象
总结 浓硫酸的特性
b.与不活泼金属和非金属反应规律
ⅰ.反应需要加热,否则不反应。
Cu+2H2SO4 (浓) CuSO4+2H2O+SO2↑
△
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
△
ⅱ.还原产物一般为SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态氧化物或含氧酸。
ⅲ.浓硫酸与金属反应时,既表现酸性有表现强氧化性,而与非金属反应时,只表现强氧化性
ⅳ.随着反应的进行,浓硫酸浓度变小,一旦变为稀硫酸,反应就停止。
(3)强氧化性
总结 浓硫酸的特性
c.与具有还原性的化合物反应,如与H2S、HI、HBr、FeCl2等物质反应。
(3)强氧化性
H2S+H2SO4 (浓) S↓+SO2↑+2H2O
e.H2、N2、O2、F2、Cl2、Br2等不能被浓硫酸氧化
d.与碱性气体反应,如NH3。
2NH3+H2SO4 (浓) (NH4)2SO4
浓硫酸的用途
几种重要的硫酸盐
硫酸盐 常见的存在形式与俗名 用途
硫酸钙 CaSO4 2H2O,生石膏 2CaSO2 H2O,熟石膏 利用熟石膏向生石膏的转化制取石膏绷带、模型;调节水泥凝固时间;制硫酸
硫酸钡 BaSO4,重晶石 医疗上用作“钡餐”;用作白色颜料
硫酸亚铁 FeSO4 7H2O,绿矾 医药(补铁剂);生产净水剂和铁红
浓硫酸与稀硫酸的比较
项目 浓硫酸 稀硫酸
酸性 强弱 弱(主要以分子的状态存在,不能用来制取氢气) 强(可以用来与活泼金属反应制取氧气)
化学方程式 H2SO4+2NaOH=Na2SO4+2H2O 2NaCl+H2SO4Na2SO4+2HCl↑ H2SO4+2NaOH=Na2SO4+2H2O
2NH3+H2SO4=(NH4)2SO4
应用 制取氯化氢等挥发性酸 除铁锈,制硫酸铵等盐类
氧化性 强弱 强氧化性(硫元素被还原) 弱氧化性(氢元素被还原)
化学方程式 Cu+2H2SO4CuSO4+SO2↑+2H2O Zn+H2SO4=ZnSO4+H2↑
应用 精炼石油,制造炸药等 实验室制取氢气、制盐等
浓硫酸与稀硫酸的比较
吸水性 有无 有 无
应用 干燥剂 无
脱水性 有无 有 无
化学方程式 浓硫酸 C12H22O11→12C+11H2O 无
应用 在有机反应中作脱水剂,制染料等 无
1.下列有关铜与过量浓硫酸反应的实验的说法不正确的是( )
A.喷有碱液的棉花是为了防止SO2污染环境
B.将水注入反应后冷却的试管a,溶液变为蓝色
C.铜片表面先发黑,反应完全后试管a底部有灰白色固体
D. SO2能使KMnO4水溶液褪色
学以致用
B
2.在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸,沉淀不溶解,则下列关于该溶被所含离子的推斯中正确的是( )
A.一定含有SO2-4
B.含有SO2-4和Ag+
C.可能含有SO2-4或SO2-3或Ag+或SO2-4、SO2-3
D.可能含有SO2-3或CO2-3
学以致用
C
课堂小结
三原料
三阶段
三设备
三反应 (均放热)
S+O2 SO2;
高温
4FeS2+11O2 2Fe2O3
+8SO2
高温
1.硫酸的制备
2SO2+O2
2SO3
催化剂
△
2SO3+H2O
H2SO4
硫黄或含硫矿石(硫铁矿)
空气
98.3%的浓硫酸
造气(生成SO2)
接触氧化
(生成SO3)
吸收SO3
(生成H2SO4)
沸腾炉
接触室
吸收塔
2.硫酸的性质
硫酸
酸的通性
能与酸碱指示剂作用,能与活泼金属、碱、碱性氧化物及其某些盐反应
浓硫酸的特性
吸水性
脱水性
强氧化性
单元典型例题剖析
3、利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 ① ② ③ 实验结论
A 浓盐酸 KMnO4 紫色石蕊溶液 氯气具有酸性、漂白性
B 浓硫酸 蔗糖 溴水 浓硫酸具有脱水性、氧化性
C 稀硝酸 Na2SO3 品红溶液 实验室制取并检验SO2
D 浓硝酸 Na2CO3 澄清石灰水 氧化性:硝酸>碳酸
B
4、将适量的蔗糖( C12H22O11)放入烧杯,滴人几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热(如图所示)。下列说法不正确的是( )
D
A.在该过程中,固体变黑体现了浓硫酸的脱水性
B.有刺激性气味的气体生成,体现了浓硫酸的强氧化性
C.将产生的气体通入品红溶液后,溶液褪色,加热,颜色恢复,说明该气体中一定含有SO2
D.将产生的气体通人澄清石灰水,溶液变浑浊,说明该气体中一定含有CO2
U
H
N
O
A
K
T
Y
