2019苏教版高中化学必修一专题5-5.1.1-元素周期律(共33张PPT)
文档属性
| 名称 | 2019苏教版高中化学必修一专题5-5.1.1-元素周期律(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 60.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-15 21:10:30 | ||
图片预览








文档简介
(共33张PPT)
第一单元
元素周期律
授课人:
01
元素周期律
CONTENTS
内容
金属性强弱规律
04
非金属性强弱规律
05
原子半径变化规律
02
化合价的变化规律
03
元素周期律
06
原子序数
01
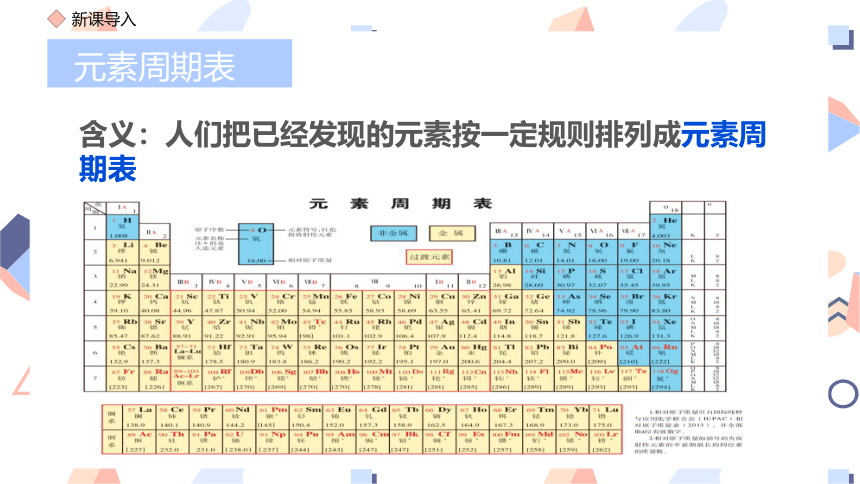
元素周期表
含义:人们把已经发现的元素按一定规则排列成元素周期表
元素符号
相对原子质量
元素名称
注*的是人造元素
原子序数
定义:按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数
等式
关系
原子序数=核电荷数=质子数=原子核外电子数
原子序数
在数值上相等
【思考】根据原子序数的规定方法,该序数与原子组成的哪些粒子数有关系 有什么关系
原子核外最外层电子排布规律
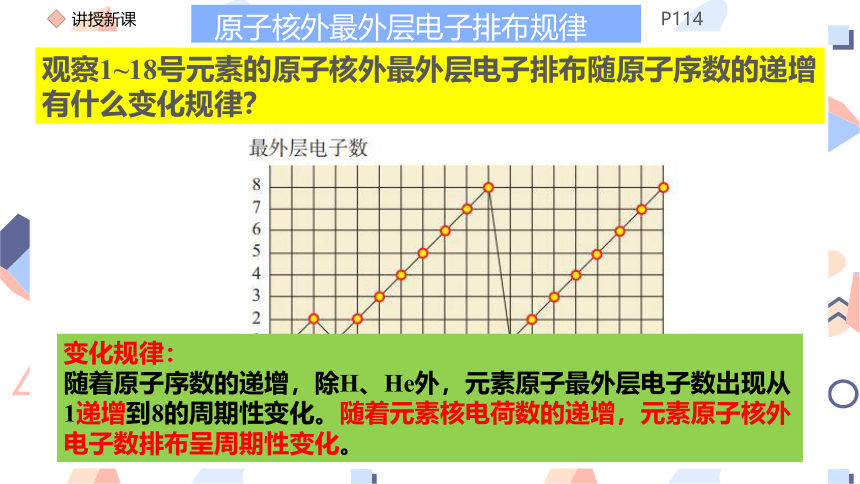
观察1~18号元素的原子核外最外层电子排布随原子序数的递增有什么变化规律?
变化规律:
随着原子序数的递增,除H、He外,元素原子最外层电子数出现从1递增到8的周期性变化。随着元素核电荷数的递增,元素原子核外电子数排布呈周期性变化。
P114
原子半径的变化规律
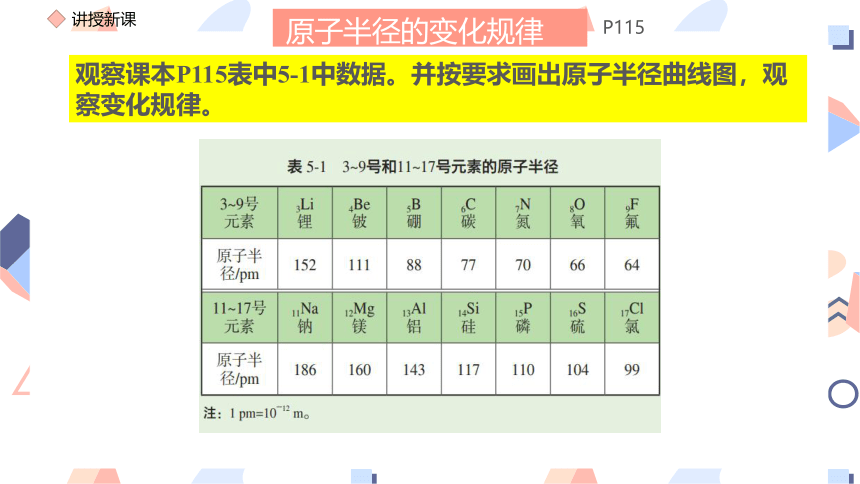
观察课本P115表中5-1中数据。并按要求画出原子半径曲线图,观察变化规律。
P115
(1)数据分析
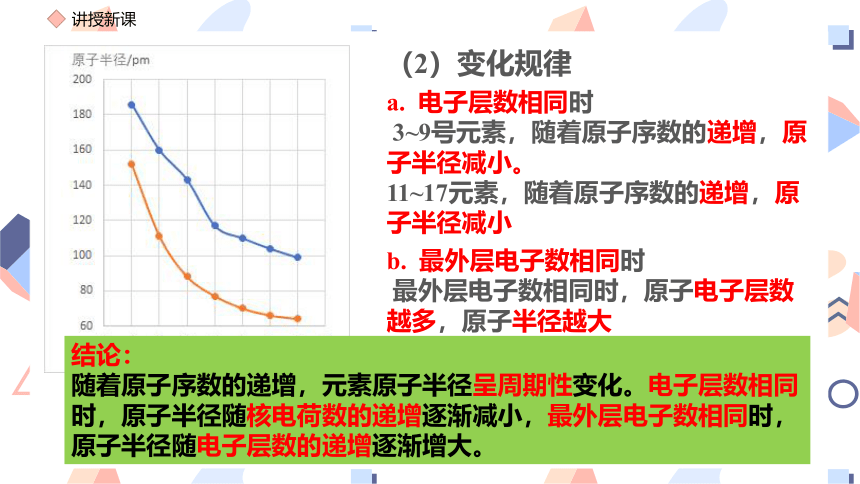
(2)变化规律
a. 电子层数相同时
3~9号元素,随着原子序数的递增,原子半径减小。
11~17元素,随着原子序数的递增,原子半径减小
b. 最外层电子数相同时
最外层电子数相同时,原子电子层数越多,原子半径越大
结论:
随着原子序数的递增,元素原子半径呈周期性变化。电子层数相同时,原子半径随核电荷数的递增逐渐减小,最外层电子数相同时,原子半径随电子层数的递增逐渐增大。
微粒半径大小比较规律:
(稀有气体除外)
1.先看电子层,层多径大
2.层同看序号,序大径小
3.序同看电子数,数大径大
原子半径大小比较规律:
(3)金属原子的半径大于相应金属的阳离子,非金属原子的半径小于相应非金属的阴离子;
(4)电子层结构相同的阴、阳离子,核电荷数越多其离子半径越小;
(1)一般情况下,电子层数相同时,随着核电荷数的递增,
原子半径逐渐 ;
变小
(2)一般情况下,最外层电子数相同时,随着核电荷数的递增, 原子半径逐渐 ;
增大;
下列有关物质原子半径的比较,结论正确的是( )
A. Na>O>N
B. Ge>Si>C
C. Be>K>B>O>F
D.O>P>Cl
B
结构
性质
决定
元素原子核外电子排布是决定元素性质的主要因素
核外电子排布随核电荷数的递增呈周期性变化
元素性质随核电荷数的递增是否呈周期性变化
元素的性质随核电荷数的递增呈周期性变化
结论
?
化合价的变化规律
P116
观察1~18号元素的最高化合价和最低化合价,画出折线图,探索元素最高和最低化合价随着核电荷数变化的规律。
思考:
(1)元素的化合价随着元素原子序数的递增有什么规律性的变化
(2)元素的最高正价与什么有关?元素的最低负价与什么有关?元素的最高正价与最低负价之间有什么联系?
原子序数 化合价的变化
1~2 +1→0
3~10 +1→+5;-4→-1→0
11~18 +1→+7;-4→-1→0
结论:随着原子序数的递增,元素最高化合价和最低化合价呈周期性变化。
元素的最高正化合价由+1递增到+7(O、F除外),元素的最低负化合价由-4递增到-1。
O无最高正价,F没有正价
常见元素化合价的一般变化规律
①1~20号元素中,除了O、F以外
元素的最高化合价=最外层电子数
(O、F及稀有气体除外)
②元素的最低化合价(非金属具有)=最外层电子数-8
③最高化合价+│最低化合价│=8
④金属元素无负价,既有正价又有负价的元素一定是非金属元素;
元素原子失电子能力越强
金属性与非金属性的判断依据
金属性强弱的判断依据
元素的金属性越强
它的单质越容易从水或酸中置换出氢
该元素最高价氧化物的水化物的碱性越强
非金属性强弱的判断依据
元素原子得电子能力越强
元素的非金属性越强
它的单质越容易与氢气反应形成气态氢化物
气态氢化物的热稳定性越强
该元素最高价氧化物的水化物的酸性越强
P117
金属性强弱变化规律
P117
实验探究:钠、镁、铝性质的递变
思考:钠、镁、铝的金属性有什么变化规律?
实验 Na Mg Al
与水反应 与冷水反应
与热水反应 ─
与盐酸反应 ─
钠与水反应剧烈,熔成闪亮的小球,四处游动最终消失,溶液变红
反应缓慢
不反应
镁条表面产生气泡,溶液变红
铝条表面产生气泡,溶液变红
两种金属均与盐酸反应并产生大量气泡;镁与盐酸的反应比铝与盐酸的反应剧烈
分析:钠、镁、铝金属性强弱的顺序是 。
Na>Mg>Al
结论:当元素原子的核外电子层数相同时,随着核电荷数的递增,元素的金属性逐渐减弱。随着核电荷数的递增,元素的金属性呈现周期性的变化。
非金属性强弱规律
分析:随着Si、P、S、Cl的核电荷数的递增,其气态氢化物稳定性 ;非金属性 。
SiH4SiP118
观察P118表5-4中不同非金属物质的气态氢化物的形成条件和热稳定性,你能发现什么规律?
结论:当元素原子的核外电子层数相同时,随着核电荷数的递增,元素的非金属性逐渐增强。随着核电荷数的递增,元素的非金属性呈现周期性的变化。
观察P118表5-5中11~17号元素最高价氧化物的水化物的酸碱性强弱,你能发现什么规律?
P118
从上表分析可知,11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律是 。
11~17号元素的金属性和非金属性强弱的变化规律是
。
2.根据11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律,预测Al(OH)3可能具有的性质是 。
可能既具有碱性又具有酸性
随着原子序数的递增,金属性逐渐减弱,非金属性逐渐增强
随着原子序数的递增,碱性逐渐减弱,酸性逐渐增强
实验探究:Al(OH)3的性质
现象: 。
两支试管中的Al(OH)3沉淀逐渐溶解,最终消失
Al(OH)3的性质
(2)结论
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,Al(OH)3是两性氢氧化物。
离子方程式:
Al(OH)3+3H+ = Al3++3H2O
Al(OH)3+OH- = AlO-2+2H2O
金属性逐渐减弱,非金属性逐渐增强
元素原子半径逐渐减小,原子核吸电子能力逐渐增强
元素原子失电子能力减弱,得电子能力增强
元素金属性和非金属性的变化规律
随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的主要化合价(最高化合价和最低化合价)、元素的金属性和非金属性均呈现周期性变化。
元素周期律总结:
元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周期律
实质:是元素原子核外电子排布随元素核电荷数的递增发生周期性变化的必然结果,揭示了元素之间的关系。
1.下列不能说明氯元素的非金属性比硫元素强的事实是( )
A.HCl比H2S稳定
B. HCIO氧化性比H2SO4强
C. HCIO4酸性比H2SO4强
D.Cl2比S更易与H2反应
解析:非金属性强弱与其化合物的氧化性无关,所以B项符合题意。
B
2.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
解析:元素性质呈周期性变化的决定因素是元素原子核外电子排布呈周期性变化,所以C项正确。
C
3.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg
B.铁投人CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Fe>Na
C.酸性H2CO3C
D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl
B
解析:B项,钠投入硫酸铜溶液中,钠先和水反应生成NaOH,而Fe不能与水反应,因此可说明Na的活动性强于Fe。
4.下列根据事实得出的元素金属性或非金属性相对强弱的推论错误的是( )
选项 事实 推论
A 与冷水反应,Na比Mg剧烈 金属性:Na>Mg
B Ca(OH)2的碱性强于Mg(OH)2 金属性:Ca>Mg
C SO2与NaHCO3溶液反应生成CO2性 非金属:S>C
D 一定条件下,等物质的量的Br2(g)、I2(g)、H2(g)在同一容器中反应,最终生成的HBr的量多于HI的 非金属性:Br>I
解析:C项,SO2不是S元素的最高价氧化物,不能以此为依据判断S、C元素的非金属性强弱,错误。
C
总结常见判断金属性和非金属性强弱的两种题型:
一是正向分析,根据金属性和非金属性的强弱关系,分析提升题给事实是否正确:
二是逆向分析,判断题给事实能否确定元素金属性和非金属性的强弱。不论哪种题型,均考查元素金属性和非金属性的判断方法,因此要熟练掌握元素金属性和非金属性强弱的判断方法,以及根据元素性质判断化合物性质。
小结
元素周期律
原子序数
元素周期律
概念:
等式关系:
原子序数=核电荷数=质子数=原子核外电子数
按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数。
结构
元素性质
核外电子呈现周期性变化
原子半径呈现周期性变化
元素的化合价呈现周期性变化
元素的金属性与非金属性呈现周期性变化
下一节课见
THANKS
第一单元
元素周期律
授课人:
01
元素周期律
CONTENTS
内容
金属性强弱规律
04
非金属性强弱规律
05
原子半径变化规律
02
化合价的变化规律
03
元素周期律
06
原子序数
01
元素周期表
含义:人们把已经发现的元素按一定规则排列成元素周期表
元素符号
相对原子质量
元素名称
注*的是人造元素
原子序数
定义:按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数
等式
关系
原子序数=核电荷数=质子数=原子核外电子数
原子序数
在数值上相等
【思考】根据原子序数的规定方法,该序数与原子组成的哪些粒子数有关系 有什么关系
原子核外最外层电子排布规律
观察1~18号元素的原子核外最外层电子排布随原子序数的递增有什么变化规律?
变化规律:
随着原子序数的递增,除H、He外,元素原子最外层电子数出现从1递增到8的周期性变化。随着元素核电荷数的递增,元素原子核外电子数排布呈周期性变化。
P114
原子半径的变化规律
观察课本P115表中5-1中数据。并按要求画出原子半径曲线图,观察变化规律。
P115
(1)数据分析
(2)变化规律
a. 电子层数相同时
3~9号元素,随着原子序数的递增,原子半径减小。
11~17元素,随着原子序数的递增,原子半径减小
b. 最外层电子数相同时
最外层电子数相同时,原子电子层数越多,原子半径越大
结论:
随着原子序数的递增,元素原子半径呈周期性变化。电子层数相同时,原子半径随核电荷数的递增逐渐减小,最外层电子数相同时,原子半径随电子层数的递增逐渐增大。
微粒半径大小比较规律:
(稀有气体除外)
1.先看电子层,层多径大
2.层同看序号,序大径小
3.序同看电子数,数大径大
原子半径大小比较规律:
(3)金属原子的半径大于相应金属的阳离子,非金属原子的半径小于相应非金属的阴离子;
(4)电子层结构相同的阴、阳离子,核电荷数越多其离子半径越小;
(1)一般情况下,电子层数相同时,随着核电荷数的递增,
原子半径逐渐 ;
变小
(2)一般情况下,最外层电子数相同时,随着核电荷数的递增, 原子半径逐渐 ;
增大;
下列有关物质原子半径的比较,结论正确的是( )
A. Na>O>N
B. Ge>Si>C
C. Be>K>B>O>F
D.O>P>Cl
B
结构
性质
决定
元素原子核外电子排布是决定元素性质的主要因素
核外电子排布随核电荷数的递增呈周期性变化
元素性质随核电荷数的递增是否呈周期性变化
元素的性质随核电荷数的递增呈周期性变化
结论
?
化合价的变化规律
P116
观察1~18号元素的最高化合价和最低化合价,画出折线图,探索元素最高和最低化合价随着核电荷数变化的规律。
思考:
(1)元素的化合价随着元素原子序数的递增有什么规律性的变化
(2)元素的最高正价与什么有关?元素的最低负价与什么有关?元素的最高正价与最低负价之间有什么联系?
原子序数 化合价的变化
1~2 +1→0
3~10 +1→+5;-4→-1→0
11~18 +1→+7;-4→-1→0
结论:随着原子序数的递增,元素最高化合价和最低化合价呈周期性变化。
元素的最高正化合价由+1递增到+7(O、F除外),元素的最低负化合价由-4递增到-1。
O无最高正价,F没有正价
常见元素化合价的一般变化规律
①1~20号元素中,除了O、F以外
元素的最高化合价=最外层电子数
(O、F及稀有气体除外)
②元素的最低化合价(非金属具有)=最外层电子数-8
③最高化合价+│最低化合价│=8
④金属元素无负价,既有正价又有负价的元素一定是非金属元素;
元素原子失电子能力越强
金属性与非金属性的判断依据
金属性强弱的判断依据
元素的金属性越强
它的单质越容易从水或酸中置换出氢
该元素最高价氧化物的水化物的碱性越强
非金属性强弱的判断依据
元素原子得电子能力越强
元素的非金属性越强
它的单质越容易与氢气反应形成气态氢化物
气态氢化物的热稳定性越强
该元素最高价氧化物的水化物的酸性越强
P117
金属性强弱变化规律
P117
实验探究:钠、镁、铝性质的递变
思考:钠、镁、铝的金属性有什么变化规律?
实验 Na Mg Al
与水反应 与冷水反应
与热水反应 ─
与盐酸反应 ─
钠与水反应剧烈,熔成闪亮的小球,四处游动最终消失,溶液变红
反应缓慢
不反应
镁条表面产生气泡,溶液变红
铝条表面产生气泡,溶液变红
两种金属均与盐酸反应并产生大量气泡;镁与盐酸的反应比铝与盐酸的反应剧烈
分析:钠、镁、铝金属性强弱的顺序是 。
Na>Mg>Al
结论:当元素原子的核外电子层数相同时,随着核电荷数的递增,元素的金属性逐渐减弱。随着核电荷数的递增,元素的金属性呈现周期性的变化。
非金属性强弱规律
分析:随着Si、P、S、Cl的核电荷数的递增,其气态氢化物稳定性 ;非金属性 。
SiH4
观察P118表5-4中不同非金属物质的气态氢化物的形成条件和热稳定性,你能发现什么规律?
结论:当元素原子的核外电子层数相同时,随着核电荷数的递增,元素的非金属性逐渐增强。随着核电荷数的递增,元素的非金属性呈现周期性的变化。
观察P118表5-5中11~17号元素最高价氧化物的水化物的酸碱性强弱,你能发现什么规律?
P118
从上表分析可知,11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律是 。
11~17号元素的金属性和非金属性强弱的变化规律是
。
2.根据11~17号元素最高价氧化物的水化物的酸碱性强弱的变化规律,预测Al(OH)3可能具有的性质是 。
可能既具有碱性又具有酸性
随着原子序数的递增,金属性逐渐减弱,非金属性逐渐增强
随着原子序数的递增,碱性逐渐减弱,酸性逐渐增强
实验探究:Al(OH)3的性质
现象: 。
两支试管中的Al(OH)3沉淀逐渐溶解,最终消失
Al(OH)3的性质
(2)结论
Al(OH)3既能与盐酸反应,又能与氢氧化钠溶液反应,Al(OH)3是两性氢氧化物。
离子方程式:
Al(OH)3+3H+ = Al3++3H2O
Al(OH)3+OH- = AlO-2+2H2O
金属性逐渐减弱,非金属性逐渐增强
元素原子半径逐渐减小,原子核吸电子能力逐渐增强
元素原子失电子能力减弱,得电子能力增强
元素金属性和非金属性的变化规律
随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的主要化合价(最高化合价和最低化合价)、元素的金属性和非金属性均呈现周期性变化。
元素周期律总结:
元素的性质随着元素核电荷数的递增呈周期性变化的规律叫作元素周期律
实质:是元素原子核外电子排布随元素核电荷数的递增发生周期性变化的必然结果,揭示了元素之间的关系。
1.下列不能说明氯元素的非金属性比硫元素强的事实是( )
A.HCl比H2S稳定
B. HCIO氧化性比H2SO4强
C. HCIO4酸性比H2SO4强
D.Cl2比S更易与H2反应
解析:非金属性强弱与其化合物的氧化性无关,所以B项符合题意。
B
2.元素性质呈周期性变化的决定因素是( )
A.元素原子半径大小呈周期性变化
B.元素相对原子质量依次递增
C.元素原子核外电子排布呈周期性变化
D.元素的最高正化合价呈周期性变化
解析:元素性质呈周期性变化的决定因素是元素原子核外电子排布呈周期性变化,所以C项正确。
C
3.下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断金属活动性强弱:Na>Mg
B.铁投人CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱:Fe>Na
C.酸性H2CO3
D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱:F>Cl
B
解析:B项,钠投入硫酸铜溶液中,钠先和水反应生成NaOH,而Fe不能与水反应,因此可说明Na的活动性强于Fe。
4.下列根据事实得出的元素金属性或非金属性相对强弱的推论错误的是( )
选项 事实 推论
A 与冷水反应,Na比Mg剧烈 金属性:Na>Mg
B Ca(OH)2的碱性强于Mg(OH)2 金属性:Ca>Mg
C SO2与NaHCO3溶液反应生成CO2性 非金属:S>C
D 一定条件下,等物质的量的Br2(g)、I2(g)、H2(g)在同一容器中反应,最终生成的HBr的量多于HI的 非金属性:Br>I
解析:C项,SO2不是S元素的最高价氧化物,不能以此为依据判断S、C元素的非金属性强弱,错误。
C
总结常见判断金属性和非金属性强弱的两种题型:
一是正向分析,根据金属性和非金属性的强弱关系,分析提升题给事实是否正确:
二是逆向分析,判断题给事实能否确定元素金属性和非金属性的强弱。不论哪种题型,均考查元素金属性和非金属性的判断方法,因此要熟练掌握元素金属性和非金属性强弱的判断方法,以及根据元素性质判断化合物性质。
小结
元素周期律
原子序数
元素周期律
概念:
等式关系:
原子序数=核电荷数=质子数=原子核外电子数
按照核电荷数由小到大的顺序给元素依次编号,这种编号叫作原子序数。
结构
元素性质
核外电子呈现周期性变化
原子半径呈现周期性变化
元素的化合价呈现周期性变化
元素的金属性与非金属性呈现周期性变化
下一节课见
THANKS
