2019苏教版高中化学必修一专题5-5.1.2-元素周期表(共30张PPT)
文档属性
| 名称 | 2019苏教版高中化学必修一专题5-5.1.2-元素周期表(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 36.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-15 21:13:32 | ||
图片预览











文档简介
(共30张PPT)
第一单元
元素周期表
授课人:
02
元素周期表
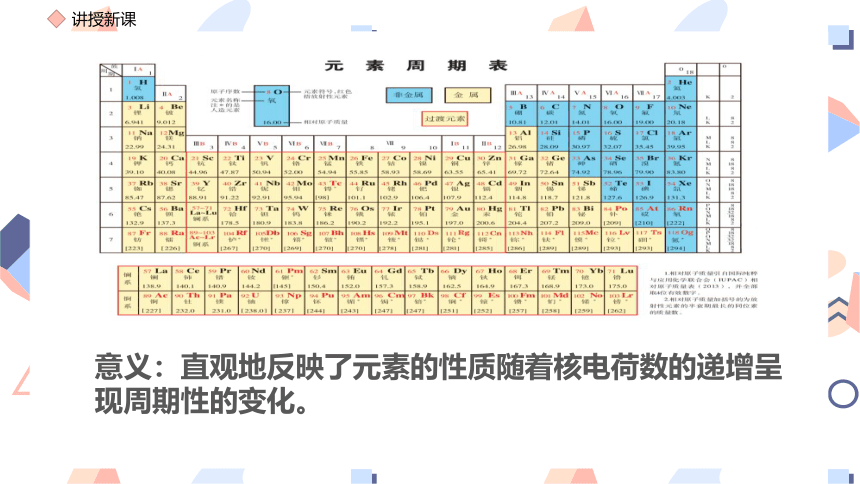
意义:直观地反映了元素的性质随着核电荷数的递增呈现周期性的变化。
19世纪中叶,俄国化学家门捷列夫发现了元素周期律并编制出元素周期表。
门捷列夫
(1834-1907)
2019年是门捷列夫发现元素周期律150年,联合国将2019年定“国际化学元素周期表年”。
CONTENTS
内容
碱金属
04
卤素
05
编排原则
02
元素周期表的结构
03
元素周期表和元素性质
06
编排原则
横行
要点一:电子层数相同
要点二:按原子序数递增的顺序从左到右排成行
纵列
要点一:最外层电子数相同(氦除外)
要点二:按电子层数递增的顺序由上到下排成列
元素周期表的结构
(1)周期
①整体结构
元素周期表中共有7个横行,每一个横行称为一个周期,即7个周期(到目前为止)。
②具体情况
周期分为短周期和长周期,如下表:
行数(从上到下) 名称 元素种数 原子的电子层数 同周期内元素原子序数的变化规律 位置与结构的关系
按序数命名 按所含元素命名
1 第一周期 短周期 2 1 从左到右,依次增大 周期序数=电子层数
2 第二周期 8 2
3 第三周期 8 3
4 第四周期 长周期 18 4
5 第五周期 18 5
6 第六周期 32 6
7 第七周期 32 7
(1)周期
(2)族
①整体结构
元素周期表有18列,16个族。
列数 1 2 3 4 5 6 7 8 9 10 11 17 13 14 15 16 17 18
类别
名称
元素种数
位置与结构的关系
7
6
32
4
4
4
4
4
4
4
4
4
5
5
5
5
5
6
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
①主族元素的族序数=最外层电子数=最高正价数值(O、F除外)
主族
主族
副族
副族
0族
0族
Ⅷ
Ⅷ
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
②副族元素最外层电子数一般不等于族序数(ⅠB族、ⅡB族除外),最外层只有1~2电子。
归纳:
(1)两个等式关系
元素所在周期序数 =原子的电子层数;
元素所在主族序数=原子的最外层电子数。
(2)元素在周期表中的位置由周期和族确定,二者缺一不可。
(3)元素周期表中从IIIB族到IIB族,共10个纵列,包括7个副族和VIII族,全部都是金属元素,统称为过渡金属。
描述一下Al、Fe、Cu在周期表中的位置。
下列说法正确的是( )
A.第1列元素全部为金属元素;
B.短周期元素是指第一、二、三周期的元素;
C.原子的核外电子层数等周期数,最外层电子数等于族序数;
D.元素周期表有7个横行和18个纵列,即7个周期和18个族
B
碱金属和卤素
人们根据同一族中元素的性质特点,给一些族以特殊的名字,如IA族中除氢以外的元素称为碱金属。
同一主族的元素的最外层电子数相同,元素的性质具有相似性,但由于电子层数不同,他们的性质也呈现出一定的递变规律。
VIIA族的元素统称为卤素。
碱金属 Li Na K Rb Cs Fr
卤素 F Cl Br I At
碱金属 原子结构
Li
Na
K
Rb
Cs
碱金属
(1)原子的结构特征
①不同点:
②相同点:
原子核外电子层数逐渐增多,依次为2~6层。
原子核外的最外层上都只有1个电子。
碱金属
(2)物理性质
碱金属 原子结构
Li
Na
K
Rb
Cs
除了铯外,碱金属都是银白色的单质,硬度小,延展性好,密度比较小,熔点也比较低。
(3)化学性质
它们原子的最外层都只有1个电子,在化学反应中易失去1个电子,成为带一个单位正电荷的简单粒子。
(4)碱金属金属性强弱规律
规律:IA族元素金属性强弱规律为:
IA族元素(氢元素除外)金属性从上到下逐渐增强。
卤素
(1)原子的结构特征
卤素 原子结构
F
Cl
Br
I
①不同点:
原子核外电子层数逐渐增多,依次为2~6层。
②相同点:
原子核外的最外层上都只有7个电子。
卤素
(2)物理性质
卤素 F2 Cl2 Br2 I2
颜色 淡黄绿色 黄绿色 深红棕色 紫黑色
状态 气态 气态 液态 固态
密度 F2→I2逐渐增大
熔、沸点 F2→I2逐渐升高
(3)化学性质
卤素原子最外层有7个电子,在化学反应中易得到1个电子,生成带一个单位负电荷的简单粒子,因此卤素属于活泼的非金属性。
实验探究
实验操作 实验现象 化学方程式
1.将少量氯水分别加入盛有NaBr和KI溶液的试管中,振荡、静置
2.将少量溴水加入盛有KI溶液的试管中,振荡,加入少量四氯化碳,振荡,静置
(4)卤素非金属性强弱规律
盛NaBr溶液的试管中,溶液颜色逐渐变为橙色;盛NaI的试管中溶液颜色逐渐变为棕红色。
静置后,液体分层,上层接近无色,下层呈紫红色。
Cl2+2NaBr = 2NaCl+Br2
Cl2+2KI = 2KCl+I2
Br2+2KI = 2KBr+I2
结论:
①随着核电荷数的递增,卤素单质的氧化性强弱顺序为 。
②VIIA族元素非金属性强弱变化规律是
。
Cl2>Br2>I2
从上到下非金属性逐渐减弱
归纳1 元素周期表中元素的原子结构与性质的周期性变化规律
项目 同周期(左→右) 同主族(上→下)
原子结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小 逐渐增大
元素性质 化合价 最高化合价由+1→+7 负化合价=-(8-主族序数) 相同,最高化合价=族序数
元素原子得、失电子能力 得电子能力逐渐增强,失电子能力逐渐减弱 得电子能力逐渐减弱,失电子能力逐渐增强
离子的氧化性和还原性 阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱 阳离子的氧化性逐渐减弱,阴离子的还原性逐渐增强
气态氢化物的稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
归纳2 元素周期表中金属与非金属元素
金属元素
非金属元素
说明:
位于分界线附近的元素既能表现出一定的金属性,又能表现出一定的非金属性。
1、元素周期表共有18个纵行,从左到右排为1 ~ 18列,即H和碱金属元素为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A.第7列元素中没有非金属元素
B.只有第2列的元素原子最外层电子数都是2
C. CO2分子中的C、O元素分别位于第4列和第6列
D.同周期第1、11列的两种元素原子序数一定相差10
解析:B项,第18列中的氮元素的原子最外层只有2个电子,第3~ 12列中多数金属元素最外层电子数均为2,错误;C项,C元素位于第14列,0元素位于第16列,错误;D项,第六周期和第七周期的第1、11列的元素原子序数相差24,错误。
A
2、某同学对一些元素 进行排列(表中数字为原子序数),根据元素周期表,下列排列你认为合理的是( )
解析:A项,1、3同主族,不可能同周期,错误;B项,第一周期只有H、He两种元素,3、4应位于第二周期,错误;C项,5、6、7同在第二周期,6、14同在第IVA族,位置合理,正确;D项,10位于0族,9、17位于同主族,位置不合理,错误。
C
1 2 3
10
2 3 4
11
5 6 7
14
8 9 10
17
A
B
C
D
常见“元素周期表的结构“有两种题型:
一是纯文字形式;
二是给出元素周期表的部分结构。
考查点主要有两点:
一是元素周期表的结构;
二是特殊位置元素原子序数的关系。
要记住元素周期表的基本结构,每一列对应的族序数,要记住元素周期表结构的特殊性,如第一周期只有两种元素等;能够从周期和族两个角度梳理元素原子序数的关系,如同周期I A、II A族元素的序数差,I A、VI A族第二、三周期,第三、四周期以及第四、五周期和第五、六周期的序数差。
3.下列有关碱金属元素和卤素的说法中,错识的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱,卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属单质和卤素单质的熔、沸点都逐渐降低
解析:D项,随核电荷数的增加,碱金属单质的熔、沸点逐渐降低,卤素单质的熔、沸点逐渐升高,错误。
D
4、如图是卤素单质(F2、Cl2、Br2、I2)的佛点与相对分子质量的关系图,下列说法错误的是( )
A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.单质②能从盐溶液中置换出单质
D.单质④组成元素的氢化物最稳定
解析:D项,HI的稳定性最差,错误。答案D
D
常见“同主族元素及其化合物性质”有两种题型:
一是直接判断卤素和碱金属元素及其化合物性质的递支性;
二是根据同主族元素性质递变规律分析别斯题给元素及其化合物的性质。
学习时要注意两点:
一是熟练掌握同主族元素及其化合物性质递变规律,并能够应用这些递变规律分析未学的性质,如氧化性还原性、离子的氧化性和还原性、氢化物的稳定性、溶液的酸碱性等;
二是熟练掌握卤素和碱金属元素及其化合物的特殊性质,如Li与水、氧气的反应,F2与水的反应和没有正价的特性,溴易挥发、碘易升华以及遇淀粉溶液变蓝的特性等。
下一节课见
THANKS
第一单元
元素周期表
授课人:
02
元素周期表
意义:直观地反映了元素的性质随着核电荷数的递增呈现周期性的变化。
19世纪中叶,俄国化学家门捷列夫发现了元素周期律并编制出元素周期表。
门捷列夫
(1834-1907)
2019年是门捷列夫发现元素周期律150年,联合国将2019年定“国际化学元素周期表年”。
CONTENTS
内容
碱金属
04
卤素
05
编排原则
02
元素周期表的结构
03
元素周期表和元素性质
06
编排原则
横行
要点一:电子层数相同
要点二:按原子序数递增的顺序从左到右排成行
纵列
要点一:最外层电子数相同(氦除外)
要点二:按电子层数递增的顺序由上到下排成列
元素周期表的结构
(1)周期
①整体结构
元素周期表中共有7个横行,每一个横行称为一个周期,即7个周期(到目前为止)。
②具体情况
周期分为短周期和长周期,如下表:
行数(从上到下) 名称 元素种数 原子的电子层数 同周期内元素原子序数的变化规律 位置与结构的关系
按序数命名 按所含元素命名
1 第一周期 短周期 2 1 从左到右,依次增大 周期序数=电子层数
2 第二周期 8 2
3 第三周期 8 3
4 第四周期 长周期 18 4
5 第五周期 18 5
6 第六周期 32 6
7 第七周期 32 7
(1)周期
(2)族
①整体结构
元素周期表有18列,16个族。
列数 1 2 3 4 5 6 7 8 9 10 11 17 13 14 15 16 17 18
类别
名称
元素种数
位置与结构的关系
7
6
32
4
4
4
4
4
4
4
4
4
5
5
5
5
5
6
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
①主族元素的族序数=最外层电子数=最高正价数值(O、F除外)
主族
主族
副族
副族
0族
0族
Ⅷ
Ⅷ
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
②副族元素最外层电子数一般不等于族序数(ⅠB族、ⅡB族除外),最外层只有1~2电子。
归纳:
(1)两个等式关系
元素所在周期序数 =原子的电子层数;
元素所在主族序数=原子的最外层电子数。
(2)元素在周期表中的位置由周期和族确定,二者缺一不可。
(3)元素周期表中从IIIB族到IIB族,共10个纵列,包括7个副族和VIII族,全部都是金属元素,统称为过渡金属。
描述一下Al、Fe、Cu在周期表中的位置。
下列说法正确的是( )
A.第1列元素全部为金属元素;
B.短周期元素是指第一、二、三周期的元素;
C.原子的核外电子层数等周期数,最外层电子数等于族序数;
D.元素周期表有7个横行和18个纵列,即7个周期和18个族
B
碱金属和卤素
人们根据同一族中元素的性质特点,给一些族以特殊的名字,如IA族中除氢以外的元素称为碱金属。
同一主族的元素的最外层电子数相同,元素的性质具有相似性,但由于电子层数不同,他们的性质也呈现出一定的递变规律。
VIIA族的元素统称为卤素。
碱金属 Li Na K Rb Cs Fr
卤素 F Cl Br I At
碱金属 原子结构
Li
Na
K
Rb
Cs
碱金属
(1)原子的结构特征
①不同点:
②相同点:
原子核外电子层数逐渐增多,依次为2~6层。
原子核外的最外层上都只有1个电子。
碱金属
(2)物理性质
碱金属 原子结构
Li
Na
K
Rb
Cs
除了铯外,碱金属都是银白色的单质,硬度小,延展性好,密度比较小,熔点也比较低。
(3)化学性质
它们原子的最外层都只有1个电子,在化学反应中易失去1个电子,成为带一个单位正电荷的简单粒子。
(4)碱金属金属性强弱规律
规律:IA族元素金属性强弱规律为:
IA族元素(氢元素除外)金属性从上到下逐渐增强。
卤素
(1)原子的结构特征
卤素 原子结构
F
Cl
Br
I
①不同点:
原子核外电子层数逐渐增多,依次为2~6层。
②相同点:
原子核外的最外层上都只有7个电子。
卤素
(2)物理性质
卤素 F2 Cl2 Br2 I2
颜色 淡黄绿色 黄绿色 深红棕色 紫黑色
状态 气态 气态 液态 固态
密度 F2→I2逐渐增大
熔、沸点 F2→I2逐渐升高
(3)化学性质
卤素原子最外层有7个电子,在化学反应中易得到1个电子,生成带一个单位负电荷的简单粒子,因此卤素属于活泼的非金属性。
实验探究
实验操作 实验现象 化学方程式
1.将少量氯水分别加入盛有NaBr和KI溶液的试管中,振荡、静置
2.将少量溴水加入盛有KI溶液的试管中,振荡,加入少量四氯化碳,振荡,静置
(4)卤素非金属性强弱规律
盛NaBr溶液的试管中,溶液颜色逐渐变为橙色;盛NaI的试管中溶液颜色逐渐变为棕红色。
静置后,液体分层,上层接近无色,下层呈紫红色。
Cl2+2NaBr = 2NaCl+Br2
Cl2+2KI = 2KCl+I2
Br2+2KI = 2KBr+I2
结论:
①随着核电荷数的递增,卤素单质的氧化性强弱顺序为 。
②VIIA族元素非金属性强弱变化规律是
。
Cl2>Br2>I2
从上到下非金属性逐渐减弱
归纳1 元素周期表中元素的原子结构与性质的周期性变化规律
项目 同周期(左→右) 同主族(上→下)
原子结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小 逐渐增大
元素性质 化合价 最高化合价由+1→+7 负化合价=-(8-主族序数) 相同,最高化合价=族序数
元素原子得、失电子能力 得电子能力逐渐增强,失电子能力逐渐减弱 得电子能力逐渐减弱,失电子能力逐渐增强
离子的氧化性和还原性 阳离子的氧化性逐渐增强,阴离子的还原性逐渐减弱 阳离子的氧化性逐渐减弱,阴离子的还原性逐渐增强
气态氢化物的稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸碱性 碱性逐渐减弱,酸性逐渐增强 碱性逐渐增强,酸性逐渐减弱
归纳2 元素周期表中金属与非金属元素
金属元素
非金属元素
说明:
位于分界线附近的元素既能表现出一定的金属性,又能表现出一定的非金属性。
1、元素周期表共有18个纵行,从左到右排为1 ~ 18列,即H和碱金属元素为第1列,稀有气体元素为第18列。按这种规定,下列说法正确的是( )
A.第7列元素中没有非金属元素
B.只有第2列的元素原子最外层电子数都是2
C. CO2分子中的C、O元素分别位于第4列和第6列
D.同周期第1、11列的两种元素原子序数一定相差10
解析:B项,第18列中的氮元素的原子最外层只有2个电子,第3~ 12列中多数金属元素最外层电子数均为2,错误;C项,C元素位于第14列,0元素位于第16列,错误;D项,第六周期和第七周期的第1、11列的元素原子序数相差24,错误。
A
2、某同学对一些元素 进行排列(表中数字为原子序数),根据元素周期表,下列排列你认为合理的是( )
解析:A项,1、3同主族,不可能同周期,错误;B项,第一周期只有H、He两种元素,3、4应位于第二周期,错误;C项,5、6、7同在第二周期,6、14同在第IVA族,位置合理,正确;D项,10位于0族,9、17位于同主族,位置不合理,错误。
C
1 2 3
10
2 3 4
11
5 6 7
14
8 9 10
17
A
B
C
D
常见“元素周期表的结构“有两种题型:
一是纯文字形式;
二是给出元素周期表的部分结构。
考查点主要有两点:
一是元素周期表的结构;
二是特殊位置元素原子序数的关系。
要记住元素周期表的基本结构,每一列对应的族序数,要记住元素周期表结构的特殊性,如第一周期只有两种元素等;能够从周期和族两个角度梳理元素原子序数的关系,如同周期I A、II A族元素的序数差,I A、VI A族第二、三周期,第三、四周期以及第四、五周期和第五、六周期的序数差。
3.下列有关碱金属元素和卤素的说法中,错识的是( )
A.溴单质与H2的反应比碘单质与H2的反应更剧烈
B.碱金属元素中,锂原子失去最外层电子的能力最弱,卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.随核电荷数的增加,碱金属单质和卤素单质的熔、沸点都逐渐降低
解析:D项,随核电荷数的增加,碱金属单质的熔、沸点逐渐降低,卤素单质的熔、沸点逐渐升高,错误。
D
4、如图是卤素单质(F2、Cl2、Br2、I2)的佛点与相对分子质量的关系图,下列说法错误的是( )
A.单质①是最活泼的非金属单质
B.单质②能使品红溶液褪色
C.单质②能从盐溶液中置换出单质
D.单质④组成元素的氢化物最稳定
解析:D项,HI的稳定性最差,错误。答案D
D
常见“同主族元素及其化合物性质”有两种题型:
一是直接判断卤素和碱金属元素及其化合物性质的递支性;
二是根据同主族元素性质递变规律分析别斯题给元素及其化合物的性质。
学习时要注意两点:
一是熟练掌握同主族元素及其化合物性质递变规律,并能够应用这些递变规律分析未学的性质,如氧化性还原性、离子的氧化性和还原性、氢化物的稳定性、溶液的酸碱性等;
二是熟练掌握卤素和碱金属元素及其化合物的特殊性质,如Li与水、氧气的反应,F2与水的反应和没有正价的特性,溴易挥发、碘易升华以及遇淀粉溶液变蓝的特性等。
下一节课见
THANKS
