2019苏教版高中化学必修一专题5-5.2-微粒之间的相互作用
文档属性
| 名称 | 2019苏教版高中化学必修一专题5-5.2-微粒之间的相互作用 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 08:56:03 | ||
图片预览










文档简介
(共46张PPT)
第二单元
微粒之间的
相互作用力
授课人:xxx
CONTENTS
目录
分子间作用力
03
离子键
01
共价键
02
氢键
04
01
离子键
化学键
概念:通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫化学键
(1)“相邻”是指化学键存在范围小,只有相邻的两个或多个原子之间存在。
(2)“原子或离子之间”包括原子和原子间,离子和离子间以及原子和离子间三种情况。
(3)“强烈”表明化学键是原子间较强的相互作用,原子间较弱的相互作用不是化学键,破坏化学键需要较高能量。
(4)“相互作用”是静电作用包括吸引作用和排斥作用。
常见化学键类型:离子键、共价键。
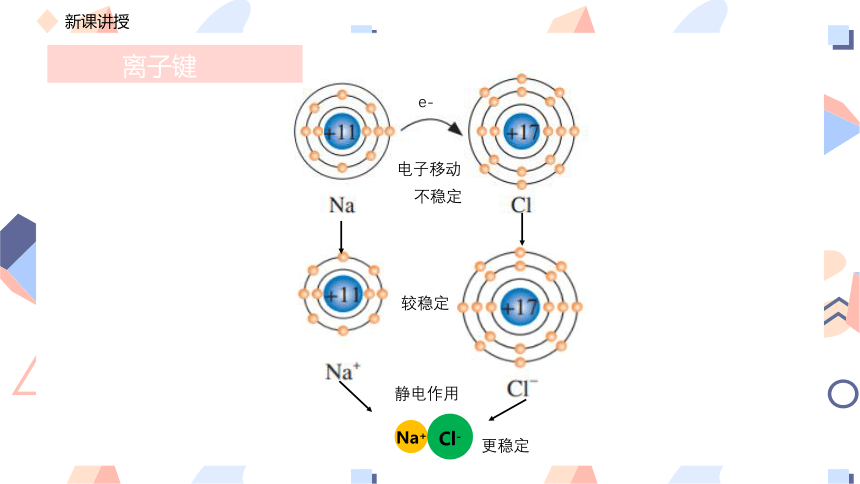
离子键
电子移动
较稳定
不稳定
静电作用
Na+
Cl-
更稳定
e-
离子键
(1)概念:阴、阳离子之间存在的强烈的相互作用,成为离子键
(2)成键微粒:阴离子、阳离子
(3)成键本质:阴离子、阳离子之间的相互作用,实质上是阴离子、阳离子之间的静电作用
(4)成键原因
①原子通过得失电子形成稳定的阴、阳离子;
②离子之间吸引作用和排斥作用处于平衡状态;
③使反应体系的总能量降低,趋于稳定。
(5)成键元素:活泼金属与活泼非金属化合时,一般形成离子键
离子化合物
(1)概念:阴、阳离子构成的化合物成为离子化合物
(2)组成微粒:阴离子、阳离子
(3)常见物质类型
①强碱:NaOH、KOH,Ca(OH)2、Ba(OH)2等;
②大多数盐:钠盐(NaCl,Na2CO3等)、钾盐(KNO3,K2SO4等)、铵盐(NH4Cl,NH4HCO3等)等;
③大多数碱性氧化物,如Na2O,CaO等;
④还有Na2O2,NaH等。
离子化合物
(4)离子化合物的性质
①离子键一般比较牢固,破坏它需要较高的能量,所以离子化合物的熔点一般比较高,常温下为固态。
②离子化合物在溶于水或熔化时离子键破坏,形成自由移动的阴阳离子,能够导电,故离子化合物都是电解质。
离子化合物中的“一定”和“不一定”
(1)三个“一定”
①离子化合物中一定含有离子键;
②含有离子键的物质一定是离子键化合物;
③离子化合物中一定含有阴离子和阳离子。
(2)两个“不一定”
①离子化合物中不一定含有金属元素,如NH4Cl,NH4NO3等;
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
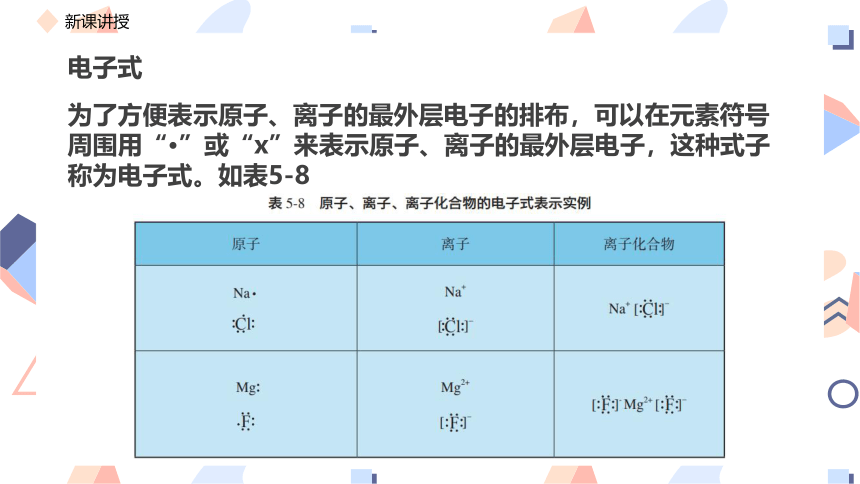
电子式
为了方便表示原子、离子的最外层电子的排布,可以在元素符号周围用“·”或“x”来表示原子、离子的最外层电子,这种式子称为电子式。如表5-8
下列有关离子了键和离子化合物的说法中正确的是( )
A.离子键就是阴、阳离子之间的吸引作用
B.在CaCl2中,Ca2+与Cl-、CI-与CI-之间均存在离子键
C.元素周期表中,第I A族和第VIIA族元素均形成离子键
D.离子化合物中一定含有离 子键,含有离子键的化合物一定是离子化合物
解析:A项,“吸引作用”是错的,应是“静电作用”,错误;B项,Cl-和Cl-都是阴离子,它们之间不可能有离子键,错误;C项,第IA族的H是非全属元素,它不可能与第VII A族的元素形成离子键,错误。
D
电子式的书写
原子的电子式
简单阳离子的电子式
书写方法:把元素符号的周围分为上、下、左、右四个区域,每个区域可以填充两个电子,我们把填进每个区域的第一电子定义为“填充”。把第二个电子定义为“填满”。根据能量最低原理的要求,电子的填充应符合“先填充,后填满”的原则。
实例:氧原子的电子式为 不能写成 。
书写要求:简单阳离子是原子失去最外层电子后形成的,因此阳离子的电子式可以直接用离子符号表示。
实例:如Na+、Mg2+等
电子式的书写
简单阴离子的电子式
复杂阴、阳离子的电子式
书写方法:阴离子由于在形成离子时得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[ ]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
实例:氧原子的电子式为 ;氯离子的电子式 。
书写要求:复杂阴、阳离子要在对应元素符号周围标明电子,用“[ ]”括上,并在[ ]右上角标明电性和所带电荷数。
实例:铵根离子 , 氢氧根离子
简单阴离子的电子式
书写要求:应先根据离子电子式的书写方法,分别写出阴、阳离子的电子式,然后让阴、阳离子间隔排列。
注意:相同离子不能合并,应写成夹心结构
实例:NaCl MgCl2 CaO K2S
下列化合物的电子式书写正确的是( )
A.
B.
C.
D.
D
解析:A项,两个Cl-应位于Ca2+两边,错误;B项,应为“-2”而不是“-2”,错误;C项,阳离子不能用“[ ]”,错误。
02
共价键
从原子结构角度认识Cl2和HCl的形成
(1)Cl2分子的形成
最外层有7个电子,两个氯原子之间难以发生电子的得失
2个电子各提供1个电子,形成1对共用电子对,2个氯原子就都形成了8个电子
稳定的Cl2分子
氯原子结构示意图
·
共价键
(1)HCl分子的形成
H原子最外层有1个电子,Cl原子最外层有7个电子,H、Cl原子之间难以发生得失。
2个原子各提供1个电子,形成1对共用电子对,2个原子就都能形成了稳定结构。
稳定的HCl分子
共价键
(1)概念:原子间通过共用电子对形成的强烈的相互作用成为共价键
(2)成键微粒:原子
(3)成键本质:共用电子对与两原子之间形成的静电作用
(4)成键原因:原子之间通过形成共用电子对,使原子核外价电子层形成稳定结构,使反应体系的总能量降低,趋于稳定。
(5)成键元素:
①同种非金属元素原子相互结合,如H2、Cl2;
②不同种非金属元素原子相互结合,如H2O、HCl;
③某些不活泼或不太活泼的金属元素的原子与非金属元素的原子相互结合,有可能形成共价键,如AlCl3
离子键和共价键的比较
类型 离子键 共价键
成键元素
成键粒子
粒子之间相互作用
活泼的金属元素与活泼的非金属元素
一般是非金属元素
阴、阳离子
原子
静电作用
共用电子对
共价分子
(1)概念:原子之间全部以共价键结合的分子叫作共价分子
NaOH中也存在共价键,但不全部是共价键因此NaOH不属于共价分子。
(2)形成过程
+
+
+
分子包括单质分子和化合物分子
(3)共价键的特殊性
以共价键结合的两个原子间形成的共用电子对,可能超过一对
如氮分子N2,电子式为:
如二氧化碳分子CO2,电子式为:
(4)除了电子式外,我们还可以用结构式表示共价分子。在结构式中,原子间的一条短线表示一对共用电子对,如
共价化合物
(1)概念:分子中直接相邻的原子间均以共用电子对形成分子的化合物叫作共价化合物。如:HCl、H2O、CO2、CH4等
(2)常见类型
类型 具体事例
非金属氢化物 NH3、H2S、H2O等
非金属 氧化物 CO、CO2、NO2、SO2等
含氧酸 HNO3、H2SO4、H3PO4等
大多数有机化合物 CH4、CH3CH2OH等
共价分子中各原子间有一定的连接方式,分子有一定的空间结构。可以用球棍模型、空间填充模型表示共价分子的空间结构。
(3)表示形式
共价化合物中的“一定”和“不一定”
(1)两个“一定”
①共价化合物中一定只含有共价键
②共价化合物中一定不含离子键
(2)两个“不一定”
①含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等
②含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O-H共价键,Na2O2中含有O-O共价键,NH4Cl中含有N-H共价键,但它们都是离子化合物。
活泼金属氢化物是火箭燃料的重要供氧剂,如NaH、CaH2等。例如,CaH2的供氧原理是CaH2+2H2O=Ca(OH)2+2H2↑。下列有关分析中正确的是( )
A.CaH2中含有共价键
B.H2O和H2均属于共价分子
C.H2O分子中的各个原子最外层均达到8个电子稳定结构
D.Ca(OH)2中含有共价键,因此属于共价化合物
解析:A错误,CaH2中H和Ca间形成的是离子键;C错误,H原子最外层只有2个电子;D项错误,Cal(OH)2中除含有共价键,还含有离子键,因此属于离子化合物。
B
碳原子成键的多样性
(1)成键类型
碳元素位于元素周期表第二周期IVA族,原子的最外层有4个电子。在化学反应中,碳原子既不易失去电子,也不易得到电子,通常与其他原子以共价键相结合。
(2)成键数目
一个碳原子之间可以和其他原子形成4个共价键。
碳原子成键的多样性
两个碳原子之间可以通过一对,两对或三对共用电子对相结合,分别构成碳碳单键、碳碳双键、碳碳三键。
(3)成键特点
碳原子成键的多样性
(4)碳链结构
碳原子之间可以通过共价键彼此结合形成链状,也可以连接形成环状。
03
分子间作用力
冰
水
干冰
思考:为什么物质在固态、液态、气态之间转化,需要吸收能量?
分子间作用力
(1)概念:分子间存在一种将分子聚集在一起的作用力,叫作分子间作用力
(2)分子间作用力比化学键弱的多
(3)由分子构成的物质,分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。例如,在常温下,氯、溴、碘单质分别呈气态、液态和固态,这与它们的分子间作用力大小有关。
分子间作用力与共价键异同
类型 分子间作用力 共价键
范围
作用力
性质影响
分子间
原子间
弱
强
由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定
物质的某些物理、化学性质
04
氢键
(1)概念:氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O F N等)接近,在X与Y之间以氢为媒介,生成X-H┄Y形式的一种特殊的分子间或分子内相互作用,称为氢键。
氢键
1.下列关于化学键及化合物的分类完全正确的( )
A.MgCl2与NaOH均既含离子健又含共价键,均属于离子化合物
B. BaCO3与H2SO4的化学键类型不完全相同,均属于电解质
C. CH4和CH3COOH均只含共价键,均属于非电解质
D. Cl2和O2均只含共价键,均只能做氧化剂
解析:A项,MgCl2不含共价键,错误;B项,前者含共价键和离子键,后者只含共价键,正确;C项,CH3COOH是电解质,错误;D项,Cl2既能做氧化剂,又能做还原剂,错误。答案B
B
2.下列关于化学键的叙述正确的是( )
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物中可能含共价键
⑥共价化合 物中可能含离子键
⑦离子化合物中只含离子键
⑧共价化合物中不含离子键
A.②③④⑦ B.②③⑤⑧ C.②④⑤⑥ D.①③⑤⑧
解析:①原子间也存在化学键,错误;④相互作用包括相互吸引和相互排斥,错误;⑥共价化合物中一定不含离子键,错误;⑦离子化合物中一定含有离子键,也可能含有共价键,错误。
B
要注意普遍规律中的“一定”和特殊情况下的“不一定”,基本关系如下所示:
总结提升 化学键类型与化合物类型的相互关系的判断
化学键
离子键
共价键
离子化合物
只存在于
共价化合物
存在于
非极性键
极性键
不同种原子之间
存在于
同种原子之间
非金属单质
3、氮化钠( Na3N )是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答下列问题。
(1)Na3N的电子式是 ,该化合物由 键形成。
(2)Na3N与盐酸反应生成 种盐,其电子式是 、 。
(3 )比较Na3N中两种微粒的半径大小:r (Na+) r(N3-)。
两
<
离子
解析:(2)氮化钠和水反应生成氨气和氢氧化钠,Na3N+3H2O = NH3↑+3NaOH,氨气和盐酸反应生成氯化铵NH3+HCl= NH4CI, 氢氧化钠和盐酸反应生成氯化钠和水NaOH + HCI= NaCl+H2O,根据反应方程式知,生成的盐有NaCl、NH4Cl两种
4、下列化合物的电子式书写正确的是( )
A.
B.
C. [Na+] S [Na+]
D.H S H
H+
Ca2+
D
项目 内容 实例
错误1
错误2
错误3
错误4
错误5
总结提升 电子式书写常见错误
漏写未参与成键的电子
N2误写为 ,应写为
化合物类型不清楚,漏写或多写“[ ]”及写错核电荷数
NaCl误写为Na+ ,应写为
HCl误写为H+ ,应写为
不考虑原子间的结合顺序
HClO误写为 ,应写为
不遵循成键规律,胡乱添加电子
CO2误写为 ,应写为
不考虑AB2型离子化合物中2个B是分来写的
CaCl2误写为 ,
应写为
5、下列说法正确的是( )
A.H2O的稳定性强于H2S,主要原因是H2O分子间作用力大
B. NaCl受热熔化和溶于水所克服的粒子间作用力不同
C.将Na在空气中点燃,形成了两种化学键
D.干冰( CO2晶体)是共价化合物,其升华为气体时破坏了所含的共价键
解析:A项,H2O的稳定性强于H2S的主要原因是H2O比H2S化学键强,错误。B项,都是离子键被破坏,克服的作用力相同,错误。C项,该反应中形成离子键和共价键两种化学键,正确。D项,干冰升华的过程中破坏的是分子间作用力,错误。
C
总结提升 判断化学键与化学反应的关系时要注意以下两种情况
(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2 = BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCI溶于水等,只有旧化学键的断裂而没有新化学键的形成,故不是化学变化。
下节课见!
THANKS
授课人:
第二单元
微粒之间的
相互作用力
授课人:xxx
CONTENTS
目录
分子间作用力
03
离子键
01
共价键
02
氢键
04
01
离子键
化学键
概念:通常我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫化学键
(1)“相邻”是指化学键存在范围小,只有相邻的两个或多个原子之间存在。
(2)“原子或离子之间”包括原子和原子间,离子和离子间以及原子和离子间三种情况。
(3)“强烈”表明化学键是原子间较强的相互作用,原子间较弱的相互作用不是化学键,破坏化学键需要较高能量。
(4)“相互作用”是静电作用包括吸引作用和排斥作用。
常见化学键类型:离子键、共价键。
离子键
电子移动
较稳定
不稳定
静电作用
Na+
Cl-
更稳定
e-
离子键
(1)概念:阴、阳离子之间存在的强烈的相互作用,成为离子键
(2)成键微粒:阴离子、阳离子
(3)成键本质:阴离子、阳离子之间的相互作用,实质上是阴离子、阳离子之间的静电作用
(4)成键原因
①原子通过得失电子形成稳定的阴、阳离子;
②离子之间吸引作用和排斥作用处于平衡状态;
③使反应体系的总能量降低,趋于稳定。
(5)成键元素:活泼金属与活泼非金属化合时,一般形成离子键
离子化合物
(1)概念:阴、阳离子构成的化合物成为离子化合物
(2)组成微粒:阴离子、阳离子
(3)常见物质类型
①强碱:NaOH、KOH,Ca(OH)2、Ba(OH)2等;
②大多数盐:钠盐(NaCl,Na2CO3等)、钾盐(KNO3,K2SO4等)、铵盐(NH4Cl,NH4HCO3等)等;
③大多数碱性氧化物,如Na2O,CaO等;
④还有Na2O2,NaH等。
离子化合物
(4)离子化合物的性质
①离子键一般比较牢固,破坏它需要较高的能量,所以离子化合物的熔点一般比较高,常温下为固态。
②离子化合物在溶于水或熔化时离子键破坏,形成自由移动的阴阳离子,能够导电,故离子化合物都是电解质。
离子化合物中的“一定”和“不一定”
(1)三个“一定”
①离子化合物中一定含有离子键;
②含有离子键的物质一定是离子键化合物;
③离子化合物中一定含有阴离子和阳离子。
(2)两个“不一定”
①离子化合物中不一定含有金属元素,如NH4Cl,NH4NO3等;
②含有金属元素的化合物不一定是离子化合物,如AlCl3。
电子式
为了方便表示原子、离子的最外层电子的排布,可以在元素符号周围用“·”或“x”来表示原子、离子的最外层电子,这种式子称为电子式。如表5-8
下列有关离子了键和离子化合物的说法中正确的是( )
A.离子键就是阴、阳离子之间的吸引作用
B.在CaCl2中,Ca2+与Cl-、CI-与CI-之间均存在离子键
C.元素周期表中,第I A族和第VIIA族元素均形成离子键
D.离子化合物中一定含有离 子键,含有离子键的化合物一定是离子化合物
解析:A项,“吸引作用”是错的,应是“静电作用”,错误;B项,Cl-和Cl-都是阴离子,它们之间不可能有离子键,错误;C项,第IA族的H是非全属元素,它不可能与第VII A族的元素形成离子键,错误。
D
电子式的书写
原子的电子式
简单阳离子的电子式
书写方法:把元素符号的周围分为上、下、左、右四个区域,每个区域可以填充两个电子,我们把填进每个区域的第一电子定义为“填充”。把第二个电子定义为“填满”。根据能量最低原理的要求,电子的填充应符合“先填充,后填满”的原则。
实例:氧原子的电子式为 不能写成 。
书写要求:简单阳离子是原子失去最外层电子后形成的,因此阳离子的电子式可以直接用离子符号表示。
实例:如Na+、Mg2+等
电子式的书写
简单阴离子的电子式
复杂阴、阳离子的电子式
书写方法:阴离子由于在形成离子时得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[ ]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号。
实例:氧原子的电子式为 ;氯离子的电子式 。
书写要求:复杂阴、阳离子要在对应元素符号周围标明电子,用“[ ]”括上,并在[ ]右上角标明电性和所带电荷数。
实例:铵根离子 , 氢氧根离子
简单阴离子的电子式
书写要求:应先根据离子电子式的书写方法,分别写出阴、阳离子的电子式,然后让阴、阳离子间隔排列。
注意:相同离子不能合并,应写成夹心结构
实例:NaCl MgCl2 CaO K2S
下列化合物的电子式书写正确的是( )
A.
B.
C.
D.
D
解析:A项,两个Cl-应位于Ca2+两边,错误;B项,应为“-2”而不是“-2”,错误;C项,阳离子不能用“[ ]”,错误。
02
共价键
从原子结构角度认识Cl2和HCl的形成
(1)Cl2分子的形成
最外层有7个电子,两个氯原子之间难以发生电子的得失
2个电子各提供1个电子,形成1对共用电子对,2个氯原子就都形成了8个电子
稳定的Cl2分子
氯原子结构示意图
·
共价键
(1)HCl分子的形成
H原子最外层有1个电子,Cl原子最外层有7个电子,H、Cl原子之间难以发生得失。
2个原子各提供1个电子,形成1对共用电子对,2个原子就都能形成了稳定结构。
稳定的HCl分子
共价键
(1)概念:原子间通过共用电子对形成的强烈的相互作用成为共价键
(2)成键微粒:原子
(3)成键本质:共用电子对与两原子之间形成的静电作用
(4)成键原因:原子之间通过形成共用电子对,使原子核外价电子层形成稳定结构,使反应体系的总能量降低,趋于稳定。
(5)成键元素:
①同种非金属元素原子相互结合,如H2、Cl2;
②不同种非金属元素原子相互结合,如H2O、HCl;
③某些不活泼或不太活泼的金属元素的原子与非金属元素的原子相互结合,有可能形成共价键,如AlCl3
离子键和共价键的比较
类型 离子键 共价键
成键元素
成键粒子
粒子之间相互作用
活泼的金属元素与活泼的非金属元素
一般是非金属元素
阴、阳离子
原子
静电作用
共用电子对
共价分子
(1)概念:原子之间全部以共价键结合的分子叫作共价分子
NaOH中也存在共价键,但不全部是共价键因此NaOH不属于共价分子。
(2)形成过程
+
+
+
分子包括单质分子和化合物分子
(3)共价键的特殊性
以共价键结合的两个原子间形成的共用电子对,可能超过一对
如氮分子N2,电子式为:
如二氧化碳分子CO2,电子式为:
(4)除了电子式外,我们还可以用结构式表示共价分子。在结构式中,原子间的一条短线表示一对共用电子对,如
共价化合物
(1)概念:分子中直接相邻的原子间均以共用电子对形成分子的化合物叫作共价化合物。如:HCl、H2O、CO2、CH4等
(2)常见类型
类型 具体事例
非金属氢化物 NH3、H2S、H2O等
非金属 氧化物 CO、CO2、NO2、SO2等
含氧酸 HNO3、H2SO4、H3PO4等
大多数有机化合物 CH4、CH3CH2OH等
共价分子中各原子间有一定的连接方式,分子有一定的空间结构。可以用球棍模型、空间填充模型表示共价分子的空间结构。
(3)表示形式
共价化合物中的“一定”和“不一定”
(1)两个“一定”
①共价化合物中一定只含有共价键
②共价化合物中一定不含离子键
(2)两个“不一定”
①含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等
②含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O-H共价键,Na2O2中含有O-O共价键,NH4Cl中含有N-H共价键,但它们都是离子化合物。
活泼金属氢化物是火箭燃料的重要供氧剂,如NaH、CaH2等。例如,CaH2的供氧原理是CaH2+2H2O=Ca(OH)2+2H2↑。下列有关分析中正确的是( )
A.CaH2中含有共价键
B.H2O和H2均属于共价分子
C.H2O分子中的各个原子最外层均达到8个电子稳定结构
D.Ca(OH)2中含有共价键,因此属于共价化合物
解析:A错误,CaH2中H和Ca间形成的是离子键;C错误,H原子最外层只有2个电子;D项错误,Cal(OH)2中除含有共价键,还含有离子键,因此属于离子化合物。
B
碳原子成键的多样性
(1)成键类型
碳元素位于元素周期表第二周期IVA族,原子的最外层有4个电子。在化学反应中,碳原子既不易失去电子,也不易得到电子,通常与其他原子以共价键相结合。
(2)成键数目
一个碳原子之间可以和其他原子形成4个共价键。
碳原子成键的多样性
两个碳原子之间可以通过一对,两对或三对共用电子对相结合,分别构成碳碳单键、碳碳双键、碳碳三键。
(3)成键特点
碳原子成键的多样性
(4)碳链结构
碳原子之间可以通过共价键彼此结合形成链状,也可以连接形成环状。
03
分子间作用力
冰
水
干冰
思考:为什么物质在固态、液态、气态之间转化,需要吸收能量?
分子间作用力
(1)概念:分子间存在一种将分子聚集在一起的作用力,叫作分子间作用力
(2)分子间作用力比化学键弱的多
(3)由分子构成的物质,分子间作用力是影响物质熔、沸点和溶解性的重要因素之一。例如,在常温下,氯、溴、碘单质分别呈气态、液态和固态,这与它们的分子间作用力大小有关。
分子间作用力与共价键异同
类型 分子间作用力 共价键
范围
作用力
性质影响
分子间
原子间
弱
强
由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定
物质的某些物理、化学性质
04
氢键
(1)概念:氢原子与电负性大的原子X以共价键结合,若与电负性大、半径小的原子Y(O F N等)接近,在X与Y之间以氢为媒介,生成X-H┄Y形式的一种特殊的分子间或分子内相互作用,称为氢键。
氢键
1.下列关于化学键及化合物的分类完全正确的( )
A.MgCl2与NaOH均既含离子健又含共价键,均属于离子化合物
B. BaCO3与H2SO4的化学键类型不完全相同,均属于电解质
C. CH4和CH3COOH均只含共价键,均属于非电解质
D. Cl2和O2均只含共价键,均只能做氧化剂
解析:A项,MgCl2不含共价键,错误;B项,前者含共价键和离子键,后者只含共价键,正确;C项,CH3COOH是电解质,错误;D项,Cl2既能做氧化剂,又能做还原剂,错误。答案B
B
2.下列关于化学键的叙述正确的是( )
①化学键只存在于分子之间
②化学键是相邻原子之间强烈的相互作用
③化学键是一种静电作用
④化学键是相邻分子之间强烈的相互吸引
⑤离子化合物中可能含共价键
⑥共价化合 物中可能含离子键
⑦离子化合物中只含离子键
⑧共价化合物中不含离子键
A.②③④⑦ B.②③⑤⑧ C.②④⑤⑥ D.①③⑤⑧
解析:①原子间也存在化学键,错误;④相互作用包括相互吸引和相互排斥,错误;⑥共价化合物中一定不含离子键,错误;⑦离子化合物中一定含有离子键,也可能含有共价键,错误。
B
要注意普遍规律中的“一定”和特殊情况下的“不一定”,基本关系如下所示:
总结提升 化学键类型与化合物类型的相互关系的判断
化学键
离子键
共价键
离子化合物
只存在于
共价化合物
存在于
非极性键
极性键
不同种原子之间
存在于
同种原子之间
非金属单质
3、氮化钠( Na3N )是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答下列问题。
(1)Na3N的电子式是 ,该化合物由 键形成。
(2)Na3N与盐酸反应生成 种盐,其电子式是 、 。
(3 )比较Na3N中两种微粒的半径大小:r (Na+) r(N3-)。
两
<
离子
解析:(2)氮化钠和水反应生成氨气和氢氧化钠,Na3N+3H2O = NH3↑+3NaOH,氨气和盐酸反应生成氯化铵NH3+HCl= NH4CI, 氢氧化钠和盐酸反应生成氯化钠和水NaOH + HCI= NaCl+H2O,根据反应方程式知,生成的盐有NaCl、NH4Cl两种
4、下列化合物的电子式书写正确的是( )
A.
B.
C. [Na+] S [Na+]
D.H S H
H+
Ca2+
D
项目 内容 实例
错误1
错误2
错误3
错误4
错误5
总结提升 电子式书写常见错误
漏写未参与成键的电子
N2误写为 ,应写为
化合物类型不清楚,漏写或多写“[ ]”及写错核电荷数
NaCl误写为Na+ ,应写为
HCl误写为H+ ,应写为
不考虑原子间的结合顺序
HClO误写为 ,应写为
不遵循成键规律,胡乱添加电子
CO2误写为 ,应写为
不考虑AB2型离子化合物中2个B是分来写的
CaCl2误写为 ,
应写为
5、下列说法正确的是( )
A.H2O的稳定性强于H2S,主要原因是H2O分子间作用力大
B. NaCl受热熔化和溶于水所克服的粒子间作用力不同
C.将Na在空气中点燃,形成了两种化学键
D.干冰( CO2晶体)是共价化合物,其升华为气体时破坏了所含的共价键
解析:A项,H2O的稳定性强于H2S的主要原因是H2O比H2S化学键强,错误。B项,都是离子键被破坏,克服的作用力相同,错误。C项,该反应中形成离子键和共价键两种化学键,正确。D项,干冰升华的过程中破坏的是分子间作用力,错误。
C
总结提升 判断化学键与化学反应的关系时要注意以下两种情况
(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2 = BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCI溶于水等,只有旧化学键的断裂而没有新化学键的形成,故不是化学变化。
下节课见!
THANKS
授课人:
