化学人教版(2019)必修第一册2.3.1物质的量(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.1物质的量(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:46:25 | ||
图片预览



文档简介
(共18张PPT)
物质的量
人教版化学必修一 第二章 第三节
概念引入
1994年美国俄亥俄州丹佛市的路易斯·史丹佛决定将他收藏了65年共40桶硬币存入银行,可是,他的财富对于银行的工作人员来说却意味着繁重的工作。
先数出1000个硬币称出质量,以1000为一个集合体,用硬币的总质量除以这1000个硬币集合体的质量,就求得了硬币的总数。
硬币的总质量÷1000枚硬币的质量 = a
硬币的总数量 = 1000a
质量
数量
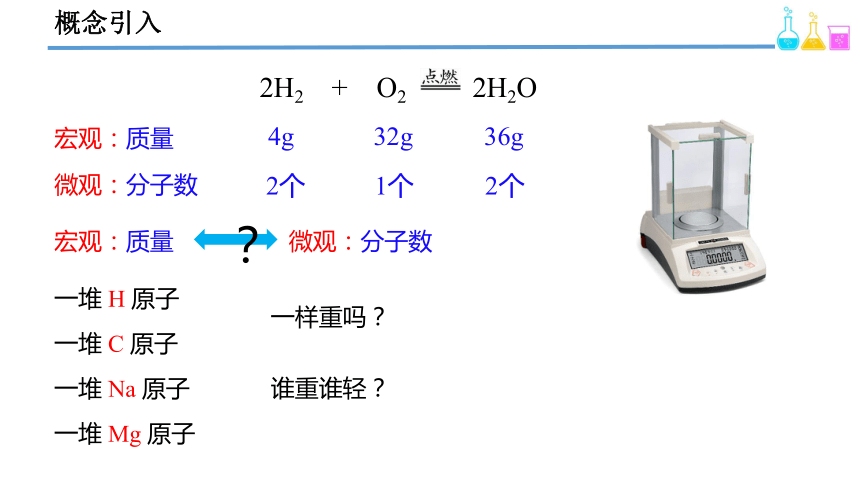
概念引入
宏观:质量
2H2 + O2
2H2O
4g
32g
36g
微观:分子数
2个
1个
2个
宏观:质量
微观:分子数
?
一堆 H 原子
一堆 C 原子
一堆 Na 原子
一堆 Mg 原子
一样重吗?
谁重谁轻?
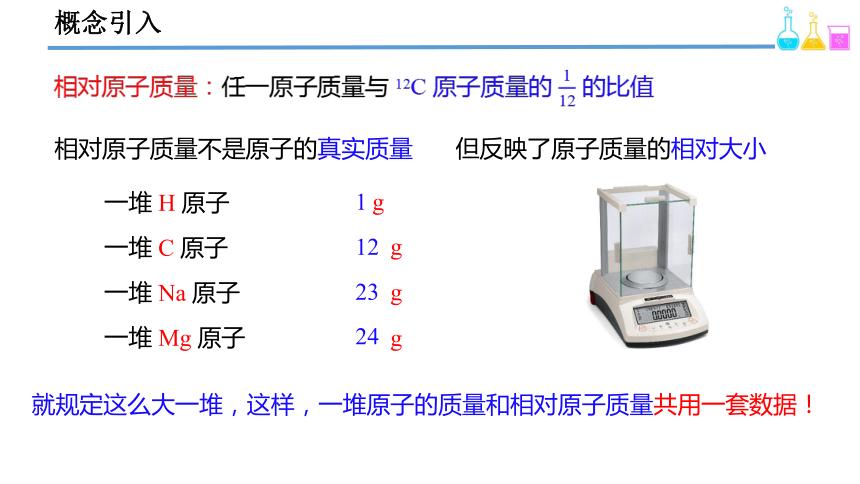
概念引入
相对原子质量:任一原子质量与 12C 原子质量的 的比值
相对原子质量不是原子的真实质量
但反映了原子质量的相对大小
一堆 H 原子
一堆 C 原子
一堆 Na 原子
一堆 Mg 原子
1
12
23
24
g
g
g
g
就规定这么大一堆,这样,一堆原子的质量和相对原子质量共用一套数据!
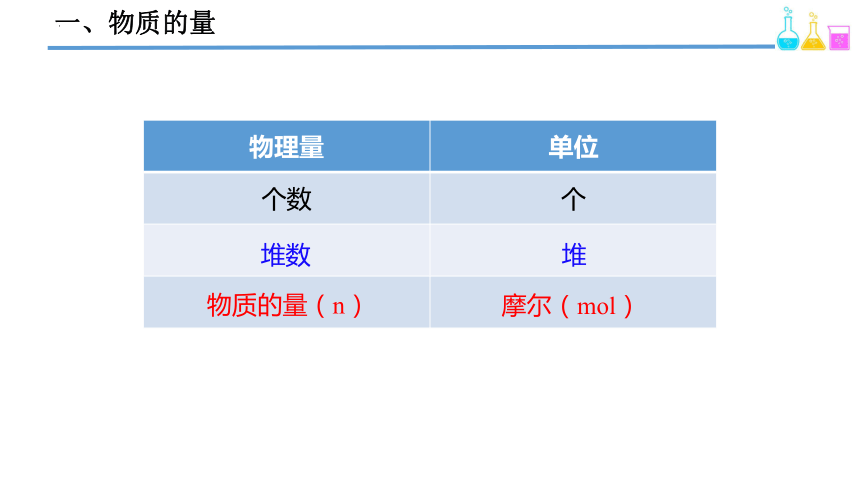
一、物质的量
物理量 单位
个数 个
堆数
堆
物质的量(n)
摩尔(mol)
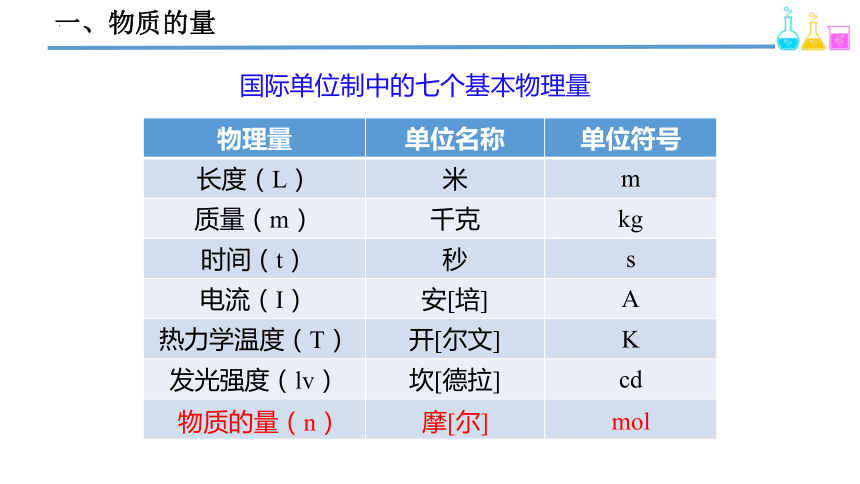
一、物质的量
国际单位制中的七个基本物理量
物理量 单位名称 单位符号
长度(L) 米 m
质量(m) 千克 kg
时间(t) 秒 s
电流(I) 安[培] A
热力学温度(T) 开[尔文] K
发光强度(lv) 坎[德拉] cd
物质的量(n)
摩[尔]
mol
一、物质的量
1. 概念:表示含有一定数目粒子的集合体。
2. 符号与单位:符号:n 单位:摩尔,简称摩,符号为mol
3. 注意点:
(1)“物质的量”是专用名词,缺一不可
物质的质量(×) 物质的数量(×) 物质量(×)
(2)计量对象:所有微观粒子,包括原子、分子、离子、质子、电子、中子、原子团等,粒子种类的指代需明确
如:1 mol Fe、1 mol O2、2 mol Na+、3 mol e- 、4 mol NaCl
一、物质的量
判断下列说法是否正确,并说明理由:
1 mol 苹果
1 mol 氧
1 mol O原子
1 mol CO2
1 mol 质子
1 mol SO42-
1 mol 钠元素
0.1 mol CH4中含有______mol H
含有0.12 mol O的SO3的物质的量为______mol
0.1 mol CuSO4·5H2O中含有______mol H2O
0.4
0.04
0.5
1 mol 氢气
二、阿伏加德罗常数
国际上规定,1 mol 粒子集合体所含的粒子数约为6.02×1023
1. 概念:1 mol 任何粒子的粒子数叫做阿伏加德罗常数
3. 数值:1 mol 任何粒子数 = NA ≈ 6.02×1023
2. 符号:NA
4. 单位:mol-1
用NA表示阿伏加德罗常数的值
二、阿伏加德罗常数
物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)之间存在什么关系?
n = 或 N = n · NA 或 NA =
粒子数(N)
物质的量(n)
÷ NA
× NA
两种物质的粒子数之比=物质的量之比
=
二、阿伏加德罗常数
602 000 000 000 000 000 000 000 有多大?
舍罕王与国际象棋的发明者萨·班·达依尔:
“陛下,请您在这张棋盘的第一个格子内,赏给我1粒麦子;在第二个格子内给2粒,第三格内给4粒,照这样下去,每一个小格内都比前一小格加一倍。陛下啊,把这样摆满棋盘上所有64格的麦粒都赏给您的仆人我吧!”
二、阿伏加德罗常数
麦粒的总数 = 1+2+4+8+······+263 = 264 - 1 = 1.845×1019
这是全世界在两千年内所生产的全部小麦!
金原子的总数 = 1+2+4+8+······+263 = 264 - 1 = 1.845×1019
金原子的总质量 = 3.27×10-22 g×1.85×1019
= 6.05×10-3 g
原子太小,NA太大!
二、阿伏加德罗常数
1 mol任何微粒的粒子数相同,质量相同吗?
1 mol H 原子
1 mol C 原子
1 mol Na 原子
1 mol Mg 原子
1
12
23
24
g
g
g
g
1 mol原子的质量和相对原子质量共用一套数据!
质量与物质的量之间的换算,需要什么转换因子?
三、摩尔质量
1. 概念:单位物质的量的物质所具有的质量叫做摩尔质量
2. 符号与单位:符号:M 单位:g·mol-1 或 g/mol
3. 摩尔质量与相对原子(分子)质量的关系:
联系:任何粒子或物质的摩尔质量以g·mol-1为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等
区别:① 概念不同;
② 单位不同:相对原子(分子)质量无单位
4. 表示方法:
如:M(S)= 32 g·mol-1 M(H2O)= 18 g·mol-1
三、摩尔质量
1 mol O 的质量是多少?摩尔质量是多少?
2 mol CO2 的质量是多少?摩尔质量是多少?
1 mol Cl- 的质量是多少?摩尔质量是多少?
1 mol Al3+ 的质量是多少?摩尔质量是多少?
三、摩尔质量
物质的量(n)、质量(m)与摩尔质量(M)之间存在什么关系?
n = 或 m = n · M 或 M =
物质的量是联系微观粒子和宏观物质的桥梁
宏观物质
(可见、可称量)
微观物质
(难见、难称量)
物质的量
质量(m)
物质的量(n)
÷ M
× M
粒子数(N)
÷ NA
× NA
四、巩固提升
微粒数之比:
2H2 + O2
2H2O
扩大 6.02×1023倍
2个
1个
2个
物质的量应用于化学方程式的计算
2×6.02×1023
1×6.02×1023
2×6.02×1023
物质的量之比:
2 mol
2 mol
1 mol
结论:在化学反应中,各反应物和生成物的微粒数之比等于各物质的物质的量之比等于各物质的系数之比
四、巩固提升
判断下列说法中正确的是:
A、O2的相对分子质量为32 g
B、1 mol O2 的质量为 32 g
C、O2的摩尔质量为32 g
D、O2的摩尔质量为32 g/mol
E、1 mol任何物质的摩尔质量就等于该物质的式量
F、一个氧原子的实际质量为16/(6.02×1023) g
G、 1mol SO42-的质量为96
H、 Na+的质量为23 g
物质的量
人教版化学必修一 第二章 第三节
概念引入
1994年美国俄亥俄州丹佛市的路易斯·史丹佛决定将他收藏了65年共40桶硬币存入银行,可是,他的财富对于银行的工作人员来说却意味着繁重的工作。
先数出1000个硬币称出质量,以1000为一个集合体,用硬币的总质量除以这1000个硬币集合体的质量,就求得了硬币的总数。
硬币的总质量÷1000枚硬币的质量 = a
硬币的总数量 = 1000a
质量
数量
概念引入
宏观:质量
2H2 + O2
2H2O
4g
32g
36g
微观:分子数
2个
1个
2个
宏观:质量
微观:分子数
?
一堆 H 原子
一堆 C 原子
一堆 Na 原子
一堆 Mg 原子
一样重吗?
谁重谁轻?
概念引入
相对原子质量:任一原子质量与 12C 原子质量的 的比值
相对原子质量不是原子的真实质量
但反映了原子质量的相对大小
一堆 H 原子
一堆 C 原子
一堆 Na 原子
一堆 Mg 原子
1
12
23
24
g
g
g
g
就规定这么大一堆,这样,一堆原子的质量和相对原子质量共用一套数据!
一、物质的量
物理量 单位
个数 个
堆数
堆
物质的量(n)
摩尔(mol)
一、物质的量
国际单位制中的七个基本物理量
物理量 单位名称 单位符号
长度(L) 米 m
质量(m) 千克 kg
时间(t) 秒 s
电流(I) 安[培] A
热力学温度(T) 开[尔文] K
发光强度(lv) 坎[德拉] cd
物质的量(n)
摩[尔]
mol
一、物质的量
1. 概念:表示含有一定数目粒子的集合体。
2. 符号与单位:符号:n 单位:摩尔,简称摩,符号为mol
3. 注意点:
(1)“物质的量”是专用名词,缺一不可
物质的质量(×) 物质的数量(×) 物质量(×)
(2)计量对象:所有微观粒子,包括原子、分子、离子、质子、电子、中子、原子团等,粒子种类的指代需明确
如:1 mol Fe、1 mol O2、2 mol Na+、3 mol e- 、4 mol NaCl
一、物质的量
判断下列说法是否正确,并说明理由:
1 mol 苹果
1 mol 氧
1 mol O原子
1 mol CO2
1 mol 质子
1 mol SO42-
1 mol 钠元素
0.1 mol CH4中含有______mol H
含有0.12 mol O的SO3的物质的量为______mol
0.1 mol CuSO4·5H2O中含有______mol H2O
0.4
0.04
0.5
1 mol 氢气
二、阿伏加德罗常数
国际上规定,1 mol 粒子集合体所含的粒子数约为6.02×1023
1. 概念:1 mol 任何粒子的粒子数叫做阿伏加德罗常数
3. 数值:1 mol 任何粒子数 = NA ≈ 6.02×1023
2. 符号:NA
4. 单位:mol-1
用NA表示阿伏加德罗常数的值
二、阿伏加德罗常数
物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)之间存在什么关系?
n = 或 N = n · NA 或 NA =
粒子数(N)
物质的量(n)
÷ NA
× NA
两种物质的粒子数之比=物质的量之比
=
二、阿伏加德罗常数
602 000 000 000 000 000 000 000 有多大?
舍罕王与国际象棋的发明者萨·班·达依尔:
“陛下,请您在这张棋盘的第一个格子内,赏给我1粒麦子;在第二个格子内给2粒,第三格内给4粒,照这样下去,每一个小格内都比前一小格加一倍。陛下啊,把这样摆满棋盘上所有64格的麦粒都赏给您的仆人我吧!”
二、阿伏加德罗常数
麦粒的总数 = 1+2+4+8+······+263 = 264 - 1 = 1.845×1019
这是全世界在两千年内所生产的全部小麦!
金原子的总数 = 1+2+4+8+······+263 = 264 - 1 = 1.845×1019
金原子的总质量 = 3.27×10-22 g×1.85×1019
= 6.05×10-3 g
原子太小,NA太大!
二、阿伏加德罗常数
1 mol任何微粒的粒子数相同,质量相同吗?
1 mol H 原子
1 mol C 原子
1 mol Na 原子
1 mol Mg 原子
1
12
23
24
g
g
g
g
1 mol原子的质量和相对原子质量共用一套数据!
质量与物质的量之间的换算,需要什么转换因子?
三、摩尔质量
1. 概念:单位物质的量的物质所具有的质量叫做摩尔质量
2. 符号与单位:符号:M 单位:g·mol-1 或 g/mol
3. 摩尔质量与相对原子(分子)质量的关系:
联系:任何粒子或物质的摩尔质量以g·mol-1为单位时,其数值都与该粒子的相对原子质量或相对分子质量相等
区别:① 概念不同;
② 单位不同:相对原子(分子)质量无单位
4. 表示方法:
如:M(S)= 32 g·mol-1 M(H2O)= 18 g·mol-1
三、摩尔质量
1 mol O 的质量是多少?摩尔质量是多少?
2 mol CO2 的质量是多少?摩尔质量是多少?
1 mol Cl- 的质量是多少?摩尔质量是多少?
1 mol Al3+ 的质量是多少?摩尔质量是多少?
三、摩尔质量
物质的量(n)、质量(m)与摩尔质量(M)之间存在什么关系?
n = 或 m = n · M 或 M =
物质的量是联系微观粒子和宏观物质的桥梁
宏观物质
(可见、可称量)
微观物质
(难见、难称量)
物质的量
质量(m)
物质的量(n)
÷ M
× M
粒子数(N)
÷ NA
× NA
四、巩固提升
微粒数之比:
2H2 + O2
2H2O
扩大 6.02×1023倍
2个
1个
2个
物质的量应用于化学方程式的计算
2×6.02×1023
1×6.02×1023
2×6.02×1023
物质的量之比:
2 mol
2 mol
1 mol
结论:在化学反应中,各反应物和生成物的微粒数之比等于各物质的物质的量之比等于各物质的系数之比
四、巩固提升
判断下列说法中正确的是:
A、O2的相对分子质量为32 g
B、1 mol O2 的质量为 32 g
C、O2的摩尔质量为32 g
D、O2的摩尔质量为32 g/mol
E、1 mol任何物质的摩尔质量就等于该物质的式量
F、一个氧原子的实际质量为16/(6.02×1023) g
G、 1mol SO42-的质量为96
H、 Na+的质量为23 g
