4.2.1 含硫物质之间的转化 课件(共12张PPT) 高中化学苏教版(2019)必修第一册
文档属性
| 名称 | 4.2.1 含硫物质之间的转化 课件(共12张PPT) 高中化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 367.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 22:06:34 | ||
图片预览





文档简介
(共12张PPT)
4.2.1 含硫物质之间的转化
-2价:H2S、Na2S、NaHS、FeS等
0价:S
+4价:SO2、H2SO3、CuSO4、FeSO4、Na2SO4、
CaSO4、BaSO4等
+6价:SO3、H2SO4、硫酸盐等
硫元素的化合价及常见含硫物质
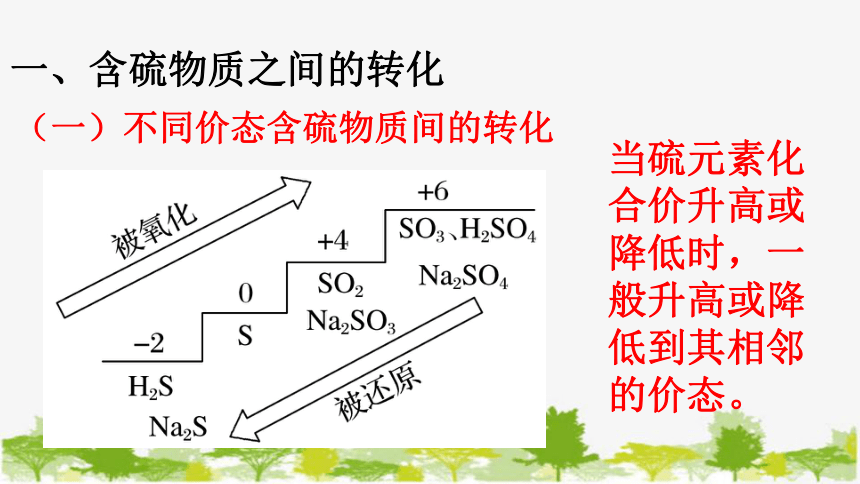
一、含硫物质之间的转化
(一)不同价态含硫物质间的转化
当硫元素化合价升高或降低时,一般升高或降低到其相邻的价态。
1、硫单质与金属反应:
(1)与钠反应:____________________
(2)与铜在加热条件下反应:_______________
(3)与铁在加热条件下反应: ______________
2Na + S == Na2S
2、硫单质与非金属反应:
(1)与氢气反应:_________________________
化合价变化:0价→ -2价,发生还原反应,表现弱氧化性。
化合价变化:0价→ +4价,发生氧化反应,表现还原性。
(2)与氧气反应:__________________________
3、在常温下,硫单质能与汞化合生成硫化汞(HgS)。因此,为了除去不慎洒落的汞,人们常将硫黄粉撒在汞的表面。
4、长期暴露在空气中的亚硫酸钠会慢慢变成硫酸钠
5、实验室中用过量氢氧化钠溶液吸收二氧化硫生成亚硫酸钠。
6、二氧化硫在催化剂、加热的条件下与氧气反应生成三氧化硫
Hg + S == HgS
2Na2SO3 + O2 == 2Na2SO4
SO2 + 2NaOH== Na2SO3 + H2O
2SO2 + O2 2SO3
(二)同种价态含硫物质间的转化
图中物质之间的转化可以通过不同的化学反应来实现。可以是元素化合价发生改变的氧化还原反应(图中横向箭头表示的转化),也可以是元素化合价不变的非氧化还原反应(图中纵向箭头表示的转化)
写出上表中①-④表示的物质间转化的化学方程式
①___________________________________________
②___________________________________________
③___________________________________________
④___________________________________________
SO2 + H2O H2SO3
2H2SO3 + O2 == H2SO4
SO3 + H2O == H2SO4
SO3 + 2NaOH == Na2SO4 + H2O
课堂小结
1、邻位价态转化规律
(1)-2价是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态。如:H2S+2FeCl3===2HCl+2FeCl2+S↓。
(2)能发生自身氧化还原反应,在反应时分别升至和降至与其相邻的价态。如:3S+6KOH===2K2S+K2SO3+3H2O。
(3)中间价态的0和+4价硫,既可以被氧化,也可以被还原。
(4)最高价+6价,只有氧化性,在化学反应中得到电子,化合价降低,一般降到相邻价态。
硫元素价态的转化规律
有多种价态的元素,其高价态的化合物可能具有氧化性,在氧化还原反应中可作氧化剂;其低价态的化合物可能具有还原性,在氧化还原反应中可作还原齐;其中间价态的化合物,在不同的化学反应中可能表现出氧化性,也可能表现出还原性。
2、氧化剂和还原剂的判断
1、下列关于硫的说法不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在过量纯氧中的燃烧产物是三氧化硫
D
2、下列化合物能由两种单质直接化合生成的是( )
A.Fe2S3 B.CuS C.SO3 D.SO2
D
3、下列物质能与SO2在一定条件下发生反应的是( )
①NaOH ②氯气 ③空气 ④氢硫酸 ⑤Na2SO3 ⑥Na2CO3
A.①②④⑤
B.②③⑤⑥
C.②
D.①②③④⑤⑥
D
4.2.1 含硫物质之间的转化
-2价:H2S、Na2S、NaHS、FeS等
0价:S
+4价:SO2、H2SO3、CuSO4、FeSO4、Na2SO4、
CaSO4、BaSO4等
+6价:SO3、H2SO4、硫酸盐等
硫元素的化合价及常见含硫物质
一、含硫物质之间的转化
(一)不同价态含硫物质间的转化
当硫元素化合价升高或降低时,一般升高或降低到其相邻的价态。
1、硫单质与金属反应:
(1)与钠反应:____________________
(2)与铜在加热条件下反应:_______________
(3)与铁在加热条件下反应: ______________
2Na + S == Na2S
2、硫单质与非金属反应:
(1)与氢气反应:_________________________
化合价变化:0价→ -2价,发生还原反应,表现弱氧化性。
化合价变化:0价→ +4价,发生氧化反应,表现还原性。
(2)与氧气反应:__________________________
3、在常温下,硫单质能与汞化合生成硫化汞(HgS)。因此,为了除去不慎洒落的汞,人们常将硫黄粉撒在汞的表面。
4、长期暴露在空气中的亚硫酸钠会慢慢变成硫酸钠
5、实验室中用过量氢氧化钠溶液吸收二氧化硫生成亚硫酸钠。
6、二氧化硫在催化剂、加热的条件下与氧气反应生成三氧化硫
Hg + S == HgS
2Na2SO3 + O2 == 2Na2SO4
SO2 + 2NaOH== Na2SO3 + H2O
2SO2 + O2 2SO3
(二)同种价态含硫物质间的转化
图中物质之间的转化可以通过不同的化学反应来实现。可以是元素化合价发生改变的氧化还原反应(图中横向箭头表示的转化),也可以是元素化合价不变的非氧化还原反应(图中纵向箭头表示的转化)
写出上表中①-④表示的物质间转化的化学方程式
①___________________________________________
②___________________________________________
③___________________________________________
④___________________________________________
SO2 + H2O H2SO3
2H2SO3 + O2 == H2SO4
SO3 + H2O == H2SO4
SO3 + 2NaOH == Na2SO4 + H2O
课堂小结
1、邻位价态转化规律
(1)-2价是硫元素的最低价态,只有还原性。它与氧化剂反应,其价态一般会升至相邻的价态。如:H2S+2FeCl3===2HCl+2FeCl2+S↓。
(2)能发生自身氧化还原反应,在反应时分别升至和降至与其相邻的价态。如:3S+6KOH===2K2S+K2SO3+3H2O。
(3)中间价态的0和+4价硫,既可以被氧化,也可以被还原。
(4)最高价+6价,只有氧化性,在化学反应中得到电子,化合价降低,一般降到相邻价态。
硫元素价态的转化规律
有多种价态的元素,其高价态的化合物可能具有氧化性,在氧化还原反应中可作氧化剂;其低价态的化合物可能具有还原性,在氧化还原反应中可作还原齐;其中间价态的化合物,在不同的化学反应中可能表现出氧化性,也可能表现出还原性。
2、氧化剂和还原剂的判断
1、下列关于硫的说法不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在过量纯氧中的燃烧产物是三氧化硫
D
2、下列化合物能由两种单质直接化合生成的是( )
A.Fe2S3 B.CuS C.SO3 D.SO2
D
3、下列物质能与SO2在一定条件下发生反应的是( )
①NaOH ②氯气 ③空气 ④氢硫酸 ⑤Na2SO3 ⑥Na2CO3
A.①②④⑤
B.②③⑤⑥
C.②
D.①②③④⑤⑥
D
