2.1.1 化学反应速率 影响化学反应速率的因素(共28张PPT).pptx
文档属性
| 名称 | 2.1.1 化学反应速率 影响化学反应速率的因素(共28张PPT).pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:24:58 | ||
图片预览






文档简介
(共28张PPT)
第二章 化学反应速率和化学平衡
第一节 化学反应速率
第1课时 化学反应速率及影响因素
在化学实验和日常生活中,我们经常观察到有些反应进行得快,有些反应进行得慢。
爆炸
牛奶变质
橡胶老化
溶洞形成
【思考与讨论】
只能粗略地估计化学反应进行的快慢 (定性角度)
准确表示化学
反应的快慢
需要统一的定量标准
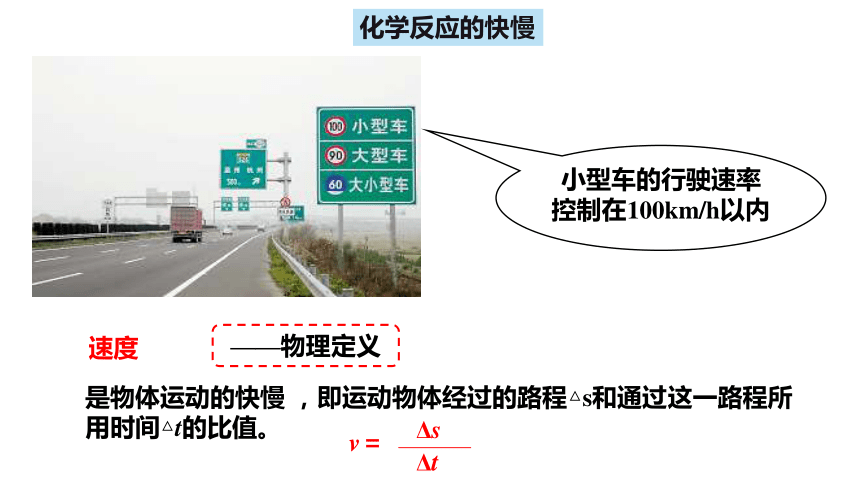
是物体运动的快慢 ,即运动物体经过的路程△s和通过这一路程所用时间△t的比值。
——物理定义
小型车的行驶速率控制在100km/h以内
v=
Δs
Δt
速度
化学反应的快慢
1.定义:
3.公式:
4.常用单位:
用单位时间内反应物浓度的减小量或生成物浓度的增加量来表示。(反应体系的体积恒定)
2.表示方法:
一、化学反应速率
1mol/(L·s)= 60 mol/(L·min)
mol·L-1·s-1 或 mol/(L·s),mol·L-1·min-1 或 mol/(L·min)
v(B) = —— = —— (v只为正值)
Δc(B)
Δt
Δn(B)
V.Δt
表示化学反应进行快慢的物理量。
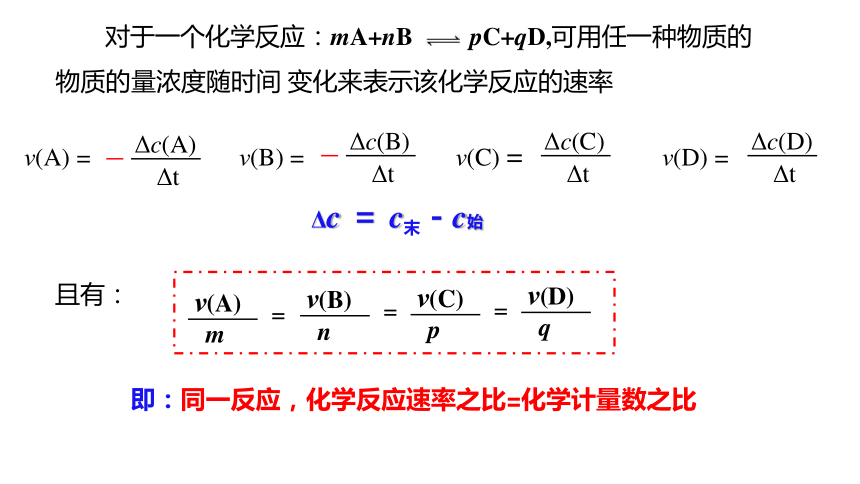
对于一个化学反应:mA+nB pC+qD,可用任一种物质的物质的量浓度随时间 变化来表示该化学反应的速率
ν(A) =
Δc(A)
Δt
ν(B) =
Δc(B)
Δt
ν(C) =
Δc(C)
Δt
ν(D) =
Δc(D)
Δt
且有:
ν(A)
m
=
ν(B)
n
=
ν(C)
p
=
ν(D)
q
即:同一反应,化学反应速率之比=化学计量数之比
Δc = c末-c始
(4) 同一反应用不同物质表示的化学反应速率,其值不一定相同,但其表示反应的快慢程度相同——指明具体物质v(A)
(5) 用不同物质表示的:化学反应速率之比=化学计量数之比
反应:mA + nB == pC + qD
v(A): v(B): v(C): v(D)==m:n:p:q
(2) 反应速率为平均速率,不是瞬时速率
(3) 不用固体或纯液体表示化学反应速率
(1) 反应速率都为正数
化学反应速率的正确理解
知识拓展:
1、公式法
化学反应速率的计算
【例1】某一反应物的浓度是1.0 mol·L-1,经过20s后,它的浓度变成了0.2 mol·L-1,在这20 s内用该物质浓度变化表示的化学反应速率为( )
A.0.04 B.0.04 mol·L-1·s-1 C.0.08 mol·L-1·s-1 D.0.04 mol·L-1
B
【例2】反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1 ,则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
C
[例1]在2 L的密闭容器中,加入1 mol N2和3 mol H2,发生 N2+3H2 2NH3 ,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的化学反应速率及N2的转化率?
C起始
C2 s末
△C
0.5
1.5
0
0.2
0.3
0.1
0.2
0.4
1.2
2、三段式法
N2转化率=100%
=×100%=20%
①化学反应速率之比
=化学计量数之比
=变量之比
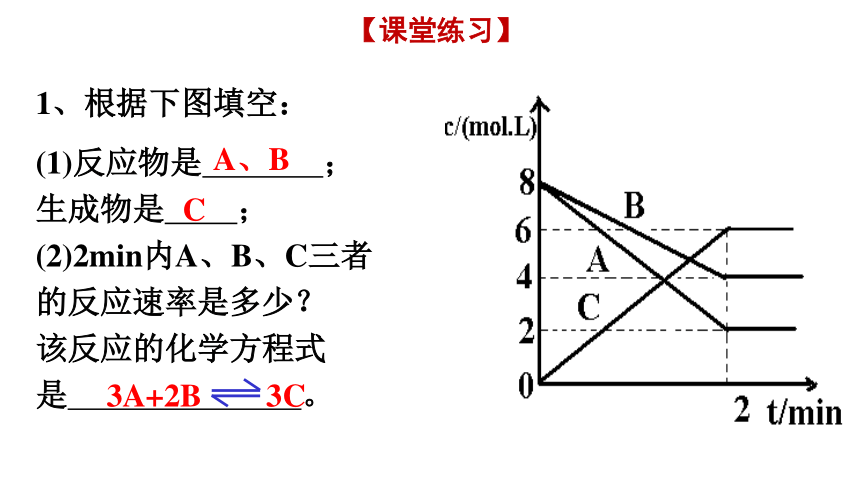
1、根据下图填空:
(1)反应物是 ;
生成物是 ;
(2)2min内A、B、C三者的反应速率是多少?
该反应的化学方程式是 。
A、B
C
【课堂练习】
3A+2B 3C
1、已知 4NH3+5O2=4NO+6H2O,则下列关系式正确的是( )
A. 4v(NH3)=5v(O2) B. 4v(NO)=6v(H2O)
C. 5v(O2)=6v(H2O) D. 4v (O2)=5v(NO)
D
2.在反应4A(s)+ 3B(g)=2C(g) + D(g)中,经2min,B的浓度减少0.6mol L-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率为0.4mol L-1 min-1
B.分别用B、C、D表示的反应速率其比值为3:2:1
C.B在2min末的反应速率是0.3mol L-1 min-1
D.B在2min内的平均反应速率是3mol L-1 min-1
B
3、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应开始到10 s时,Y的转化率为79.0%
C. t1 s时Z和X的浓度相等,达到了化学平衡状态
D. 反应的化学方程式为X(g)+Y(g) Z(g)
B
4.反应 A + 3B = 2C + 2D 在四种不同条件下的化学反应速率为:
(1) v(A) = 0.3 mol/(L·s) (2) v(B) = 0.6 mol/(L·s)
(3) v(C) = 2.4 mol/(L·min) (4) v(D) = 0.45 mol/(L·s)
则该反应速率的快慢顺序为 。
(1) > (4) > (2) > (3)
归一法
比值法
用同一物质来表示化学反应速率
比较反应速率与化学计量数的比值大小
应换算成同一物质,并统一单位,再比较
若: > ,则 >
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
化学反应速率的测定
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
离子浓度检测仪
思考讨论
对于下列这些反应,我们希望它反应速率快还是慢呢?
食物变质
橡胶老化
金属生锈
炼铁
工业制氨
反应速率可人为调控?
1、内因
二、影响化学反应速率的因素
相同温度下,相同形状、大小的锌片和铁片与等浓度的盐酸反应,锌片反应进行的更快其原因是?
等体积等浓度的盐酸
等体积等浓度的盐酸
(决定因素:反应物自身的性质——反应物的组成、结构和性质等)
2、外因
(1)温度对化学反应速率影响的探究
结论1:温度越高,反应速率越快。
a、其他条件不变,温度升高,反应速率加快
b、温度对反应速率影响的规律,对吸热反应,放热反应都适用。
c、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2-4倍,表明温度对速率的影响非常显著。
(2)浓度对化学反应速率影响的探究
实验结论2:浓度越大,反应速率越快。
a、此规律只适用于气体或溶液的反应,对于固体或纯液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。
c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
注意:
b、一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。
(3)催化剂对化学反应速率影响的探究
实验结论3:加入催化剂可以改变反应速率
1.催化剂有选择性和高效性,若无特别指明指增大反应速率的正催化剂。
2.催化剂可同等程度增大正逆反应速率,不改变转化率和反应热。
3.催化剂参与反应,改变反应历程,反应前后质量、化学性质不变,物理性质改变。
4.选择催化剂所需要的适宜温度,要防止催化剂失效
5.催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
(3)压强对化学反应速率影响的探究
有气体参加的反应,增大压强,若使反应物的浓度增大,则可以加快反应速率
注意:
(1)只适用于有气体参加的反应,对固体或液体的浓度影响
忽略不计。
(2)压强的变化只有引起浓度的变化,才能使化学反应速率改变
讨论1:取一个容积固定的密闭容器,充入He气后,对速率如何影响?
N2 H2
He
总压强增大
N2、H2浓度不变
速率不变
恒容时,充入不反应气体,虽总压增加,但各反应物浓度不变,反应速率不变
讨论2:向一个容积可变的容器中充入He气后,分析速率变化情况?
N2 H2
He
活塞
容器体积增大
N2、H2浓度减小
速率减小
恒压时,充入不反应气体,容器体积增加,各反应物浓度减小,反应速率减慢
N2+3H2 2NH3
高温、高压
催化剂
①在相同温度下,对于有气体参加的反应
a.增大压强→容器体积 →反应物浓度 →化学反应速率 。
b.减小压强→容器体积 →反应物浓度 →化学反应速率 。
减小
增大
增大
增大
减小
减小
②在相同温度下,充入非反应物气体对化学反应速率的影响
a.恒容时:充入非反应物气体→压强 ,但各物质浓度 →化学反应速率 。
增大
不变
不变
b.恒压时:充入非反应物气体 → 压强 → 体系体积 → 各物质浓度 → 化学反应速率 。
不变
减小
减小
增大
③对于没有气体参加的反应,改变压强时,各物质的浓度 ,化学反应速率 。
不变
不变
内因 反应物本身的性质 反应物的化学性质越活泼,化学反应速率越快
外因 温度 温度越高,化学反应速率越快
浓度 增大反应物的浓度,可以加快化学反应速率
催化剂 催化剂可以改变化学反应速率
压强 有气体参加的反应,增大压强(减小容器容积),反应速率加快
其他 ①增大固体反应物的表面积(即粉碎成小颗粒),反应速率加快
②形成原电池,通常能加快反应速率
③超声波、电磁波、光照等也能影响反应速率
归纳总结——影响化学反应速率的因素
1、下列关于化学反应速率的说法,不正确的是( )
A、化学反应速率是衡量化学反应进行快慢程度的物理量
B、化学反应速率的大小主要取决于反应物的性质
C、化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D、化学反应速率常用单位有 mol·L-1·s-1 和 mol·L-1·min-1
C
课堂练习
3.把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液
B
1
2
3
4
4.一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行,下列措施不能改变化学反应速率的是( )
A.缩小容积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
C
4.对于反应4NH3+5O2 4NO+6H2O,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)=0.2 mol·L-1·s-1 B.v(O2)=0.24 mol·L-1·s-1
C.v(H2O)=15 mol·L-1·min-1 D.v(NO)=9 mol·L-1·min-1
A
5、一定条件下,分别对反应 C(s)+CO2(g) 2CO(g) 进行如下操作(只改变该条件):
① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量
上述措施中一定能使反应速率显著变大的是( )
A、①②③④ B、①③④
C、①② D、①③
高温
D
6.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率为0.1 mol/(L·min)。
(1)x的值是 。
(2)A在5min末的浓度是 。
(3)5min内B的平均反应速率是 ,D的平均反应速率是 。
2
0.75mol/L
0.05mol/(L.min)
0.1mol/(L.min)
第二章 化学反应速率和化学平衡
第一节 化学反应速率
第1课时 化学反应速率及影响因素
在化学实验和日常生活中,我们经常观察到有些反应进行得快,有些反应进行得慢。
爆炸
牛奶变质
橡胶老化
溶洞形成
【思考与讨论】
只能粗略地估计化学反应进行的快慢 (定性角度)
准确表示化学
反应的快慢
需要统一的定量标准
是物体运动的快慢 ,即运动物体经过的路程△s和通过这一路程所用时间△t的比值。
——物理定义
小型车的行驶速率控制在100km/h以内
v=
Δs
Δt
速度
化学反应的快慢
1.定义:
3.公式:
4.常用单位:
用单位时间内反应物浓度的减小量或生成物浓度的增加量来表示。(反应体系的体积恒定)
2.表示方法:
一、化学反应速率
1mol/(L·s)= 60 mol/(L·min)
mol·L-1·s-1 或 mol/(L·s),mol·L-1·min-1 或 mol/(L·min)
v(B) = —— = —— (v只为正值)
Δc(B)
Δt
Δn(B)
V.Δt
表示化学反应进行快慢的物理量。
对于一个化学反应:mA+nB pC+qD,可用任一种物质的物质的量浓度随时间 变化来表示该化学反应的速率
ν(A) =
Δc(A)
Δt
ν(B) =
Δc(B)
Δt
ν(C) =
Δc(C)
Δt
ν(D) =
Δc(D)
Δt
且有:
ν(A)
m
=
ν(B)
n
=
ν(C)
p
=
ν(D)
q
即:同一反应,化学反应速率之比=化学计量数之比
Δc = c末-c始
(4) 同一反应用不同物质表示的化学反应速率,其值不一定相同,但其表示反应的快慢程度相同——指明具体物质v(A)
(5) 用不同物质表示的:化学反应速率之比=化学计量数之比
反应:mA + nB == pC + qD
v(A): v(B): v(C): v(D)==m:n:p:q
(2) 反应速率为平均速率,不是瞬时速率
(3) 不用固体或纯液体表示化学反应速率
(1) 反应速率都为正数
化学反应速率的正确理解
知识拓展:
1、公式法
化学反应速率的计算
【例1】某一反应物的浓度是1.0 mol·L-1,经过20s后,它的浓度变成了0.2 mol·L-1,在这20 s内用该物质浓度变化表示的化学反应速率为( )
A.0.04 B.0.04 mol·L-1·s-1 C.0.08 mol·L-1·s-1 D.0.04 mol·L-1
B
【例2】反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1 ,则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
C
[例1]在2 L的密闭容器中,加入1 mol N2和3 mol H2,发生 N2+3H2 2NH3 ,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的化学反应速率及N2的转化率?
C起始
C2 s末
△C
0.5
1.5
0
0.2
0.3
0.1
0.2
0.4
1.2
2、三段式法
N2转化率=100%
=×100%=20%
①化学反应速率之比
=化学计量数之比
=变量之比
1、根据下图填空:
(1)反应物是 ;
生成物是 ;
(2)2min内A、B、C三者的反应速率是多少?
该反应的化学方程式是 。
A、B
C
【课堂练习】
3A+2B 3C
1、已知 4NH3+5O2=4NO+6H2O,则下列关系式正确的是( )
A. 4v(NH3)=5v(O2) B. 4v(NO)=6v(H2O)
C. 5v(O2)=6v(H2O) D. 4v (O2)=5v(NO)
D
2.在反应4A(s)+ 3B(g)=2C(g) + D(g)中,经2min,B的浓度减少0.6mol L-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率为0.4mol L-1 min-1
B.分别用B、C、D表示的反应速率其比值为3:2:1
C.B在2min末的反应速率是0.3mol L-1 min-1
D.B在2min内的平均反应速率是3mol L-1 min-1
B
3、一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
A. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
B. 反应开始到10 s时,Y的转化率为79.0%
C. t1 s时Z和X的浓度相等,达到了化学平衡状态
D. 反应的化学方程式为X(g)+Y(g) Z(g)
B
4.反应 A + 3B = 2C + 2D 在四种不同条件下的化学反应速率为:
(1) v(A) = 0.3 mol/(L·s) (2) v(B) = 0.6 mol/(L·s)
(3) v(C) = 2.4 mol/(L·min) (4) v(D) = 0.45 mol/(L·s)
则该反应速率的快慢顺序为 。
(1) > (4) > (2) > (3)
归一法
比值法
用同一物质来表示化学反应速率
比较反应速率与化学计量数的比值大小
应换算成同一物质,并统一单位,再比较
若: > ,则 >
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
化学反应速率的测定
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
离子浓度检测仪
思考讨论
对于下列这些反应,我们希望它反应速率快还是慢呢?
食物变质
橡胶老化
金属生锈
炼铁
工业制氨
反应速率可人为调控?
1、内因
二、影响化学反应速率的因素
相同温度下,相同形状、大小的锌片和铁片与等浓度的盐酸反应,锌片反应进行的更快其原因是?
等体积等浓度的盐酸
等体积等浓度的盐酸
(决定因素:反应物自身的性质——反应物的组成、结构和性质等)
2、外因
(1)温度对化学反应速率影响的探究
结论1:温度越高,反应速率越快。
a、其他条件不变,温度升高,反应速率加快
b、温度对反应速率影响的规律,对吸热反应,放热反应都适用。
c、反应若是可逆反应,升高温度,正、逆反应速率都加快,降低温度,正、逆反应速率都减小。
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2-4倍,表明温度对速率的影响非常显著。
(2)浓度对化学反应速率影响的探究
实验结论2:浓度越大,反应速率越快。
a、此规律只适用于气体或溶液的反应,对于固体或纯液体的反应物,一般情况下其浓度是常数,因此改变它们的量一般不会改变化学反应速率。
c、随着化学反应的进行,反应物的浓度会逐渐减小,因此一般反应速率也会逐渐减小。
注意:
b、一般来说,固体反应物表面积越大,反应速率越大,固体反应物表面积越小,反应速率越小。
(3)催化剂对化学反应速率影响的探究
实验结论3:加入催化剂可以改变反应速率
1.催化剂有选择性和高效性,若无特别指明指增大反应速率的正催化剂。
2.催化剂可同等程度增大正逆反应速率,不改变转化率和反应热。
3.催化剂参与反应,改变反应历程,反应前后质量、化学性质不变,物理性质改变。
4.选择催化剂所需要的适宜温度,要防止催化剂失效
5.催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
(3)压强对化学反应速率影响的探究
有气体参加的反应,增大压强,若使反应物的浓度增大,则可以加快反应速率
注意:
(1)只适用于有气体参加的反应,对固体或液体的浓度影响
忽略不计。
(2)压强的变化只有引起浓度的变化,才能使化学反应速率改变
讨论1:取一个容积固定的密闭容器,充入He气后,对速率如何影响?
N2 H2
He
总压强增大
N2、H2浓度不变
速率不变
恒容时,充入不反应气体,虽总压增加,但各反应物浓度不变,反应速率不变
讨论2:向一个容积可变的容器中充入He气后,分析速率变化情况?
N2 H2
He
活塞
容器体积增大
N2、H2浓度减小
速率减小
恒压时,充入不反应气体,容器体积增加,各反应物浓度减小,反应速率减慢
N2+3H2 2NH3
高温、高压
催化剂
①在相同温度下,对于有气体参加的反应
a.增大压强→容器体积 →反应物浓度 →化学反应速率 。
b.减小压强→容器体积 →反应物浓度 →化学反应速率 。
减小
增大
增大
增大
减小
减小
②在相同温度下,充入非反应物气体对化学反应速率的影响
a.恒容时:充入非反应物气体→压强 ,但各物质浓度 →化学反应速率 。
增大
不变
不变
b.恒压时:充入非反应物气体 → 压强 → 体系体积 → 各物质浓度 → 化学反应速率 。
不变
减小
减小
增大
③对于没有气体参加的反应,改变压强时,各物质的浓度 ,化学反应速率 。
不变
不变
内因 反应物本身的性质 反应物的化学性质越活泼,化学反应速率越快
外因 温度 温度越高,化学反应速率越快
浓度 增大反应物的浓度,可以加快化学反应速率
催化剂 催化剂可以改变化学反应速率
压强 有气体参加的反应,增大压强(减小容器容积),反应速率加快
其他 ①增大固体反应物的表面积(即粉碎成小颗粒),反应速率加快
②形成原电池,通常能加快反应速率
③超声波、电磁波、光照等也能影响反应速率
归纳总结——影响化学反应速率的因素
1、下列关于化学反应速率的说法,不正确的是( )
A、化学反应速率是衡量化学反应进行快慢程度的物理量
B、化学反应速率的大小主要取决于反应物的性质
C、化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D、化学反应速率常用单位有 mol·L-1·s-1 和 mol·L-1·min-1
C
课堂练习
3.把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液
B
1
2
3
4
4.一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行,下列措施不能改变化学反应速率的是( )
A.缩小容积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
C
4.对于反应4NH3+5O2 4NO+6H2O,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A.v(NH3)=0.2 mol·L-1·s-1 B.v(O2)=0.24 mol·L-1·s-1
C.v(H2O)=15 mol·L-1·min-1 D.v(NO)=9 mol·L-1·min-1
A
5、一定条件下,分别对反应 C(s)+CO2(g) 2CO(g) 进行如下操作(只改变该条件):
① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量
上述措施中一定能使反应速率显著变大的是( )
A、①②③④ B、①③④
C、①② D、①③
高温
D
6.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5 min后测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的反应速率为0.1 mol/(L·min)。
(1)x的值是 。
(2)A在5min末的浓度是 。
(3)5min内B的平均反应速率是 ,D的平均反应速率是 。
2
0.75mol/L
0.05mol/(L.min)
0.1mol/(L.min)
