2.1.2 活化能.(共24张PPT)pptx
文档属性
| 名称 | 2.1.2 活化能.(共24张PPT)pptx |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:25:41 | ||
图片预览




文档简介
(共24张PPT)
第二章 化学反应速率和化学平衡
第一节 化学反应速率
第2课时 活化能
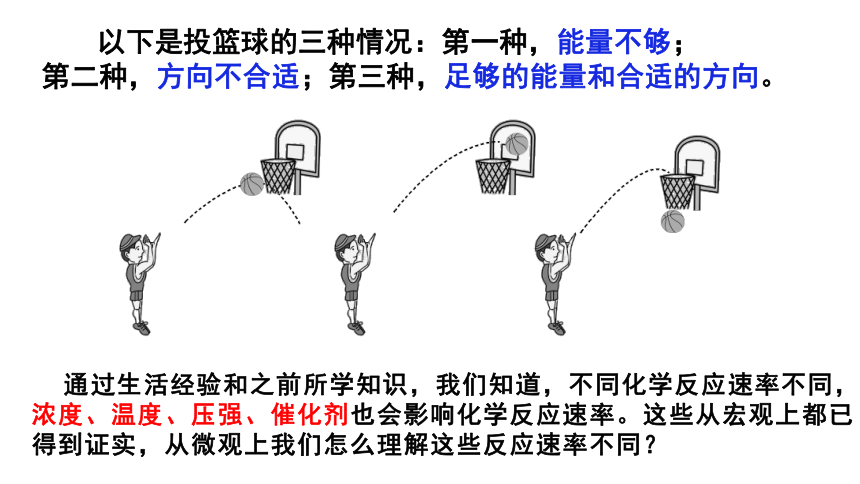
以下是投篮球的三种情况:第一种,能量不够;
第二种,方向不合适;第三种,足够的能量和合适的方向。
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么理解这些反应速率不同?
思考与交流
分子相互碰撞是引发反应的先决条件。
2.分子间发生化学反应的必要条件是什么?
1.化学反应的本质是什么?
反应物中旧化学键的断裂;生成物中新化学键的形成
研究发现大多数化学反应不是经过简单碰撞完成的,而是经过多个反应步骤才能实现。
一、有效碰撞理论
1.基元反应和反应历程
例如: 2HI= H2 + I2
第一步: 2HI → H2+2 I
第二步: 2I → I2
自由基:带有单电子的原子或原子团。自由基的反应活性很强,寿命极短。
①每一步反应称为基元反应
②多步基元反应反映了反应历程,又称反应机理
③基元反应发生的先决条件是反应物的分子必须发生碰撞
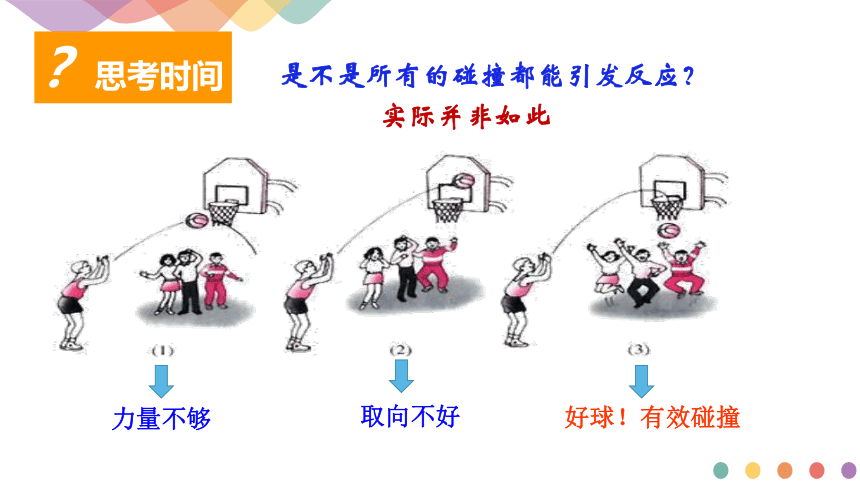
是不是所有的碰撞都能引发反应?
?思考时间
实际并非如此
力量不够
取向不好
好球!有效碰撞
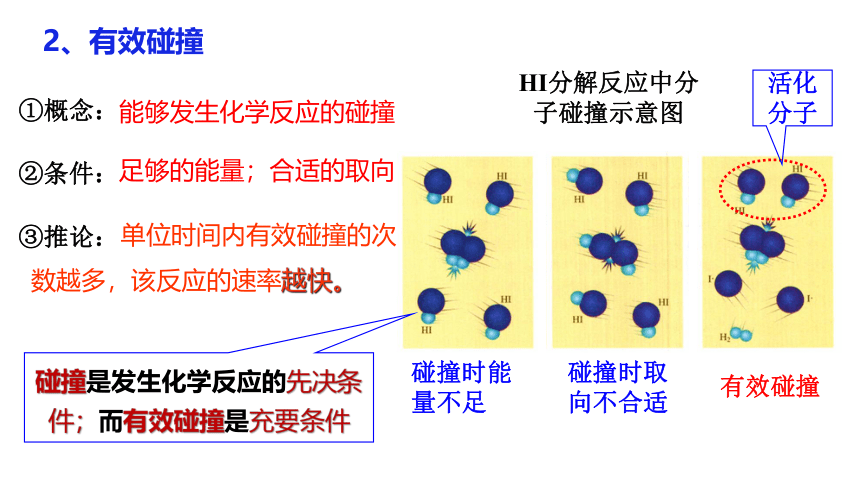
HI分解反应中分子碰撞示意图
2、有效碰撞
碰撞时能量不足
碰撞时取向不合适
有效碰撞
①概念:
②条件:
③推论:
活化分子
碰撞是发生化学反应的先决条件;而有效碰撞是充要条件
能够发生化学反应的碰撞
足够的能量;合适的取向
单位时间内有效碰撞的次数越多,该反应的速率越快。
3、活化分子和活化能
①活化分子:能够发生有效碰撞的分子,必须具有足够能量
活化分子百分数=
活化分子数
反应物分子数
×100%
其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
发生有效碰撞的分子一定是活化分子;
活化分子不一定发生有效碰撞
注意:
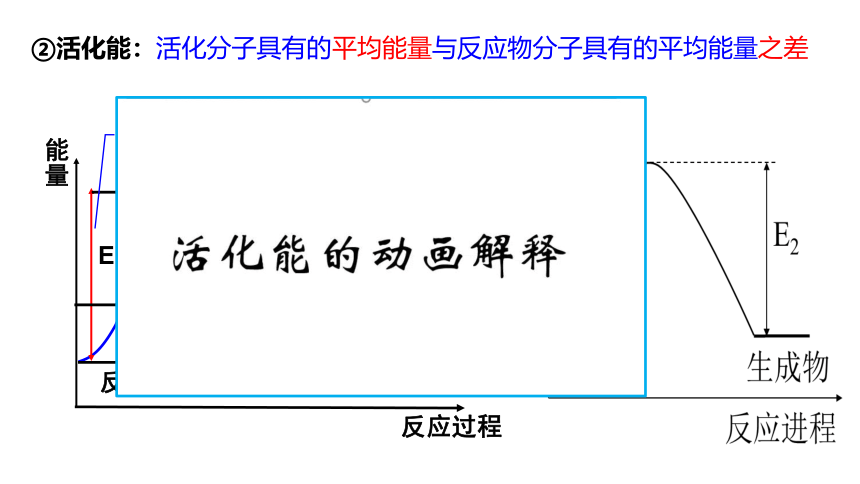
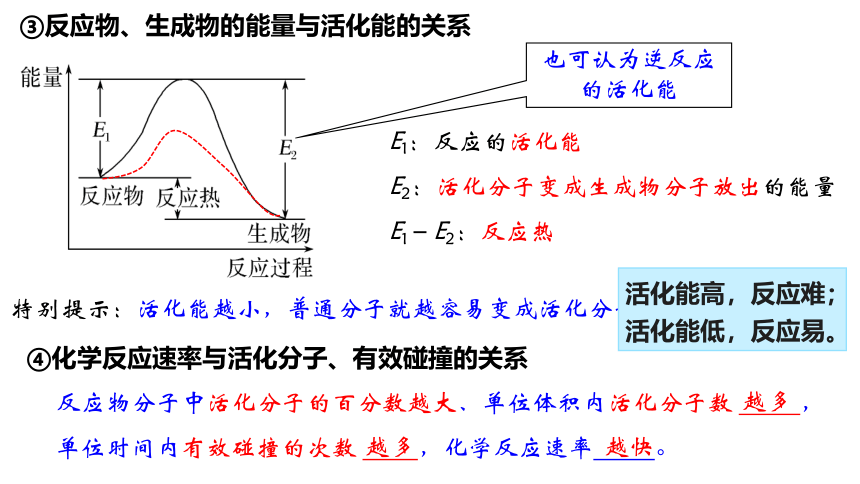
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
反应热
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热
③反应物、生成物的能量与活化能的关系
特别提示:活化能越小,普通分子就越容易变成活化分子。
也可认为逆反应的活化能
④化学反应速率与活化分子、有效碰撞的关系
反应物分子中活化分子的百分数越大、单位体积内活化分子数 ,
单位时间内有效碰撞的次数 ,化学反应速率 。
活化能高,反应难;
活化能低,反应易。
越多
越多
越快
小结一:有效碰撞理论
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
碰撞频率越高,反应速率越快
普通分子
活化能
【例1】下列说法错误的是( )
①具有较高能量的分子发生有适当取向的碰撞,才能发生化学反应。②发生有效碰撞的分子都是活化分子。
③活化分子间的碰撞都是有效碰撞。
④水溶液中的化学反应的活化能都接近于0。
⑤反应热△H=正反应的活化能—逆反应的活化能。
⑥活化能指活化分子多出反应物分子平均能量的那部分能量。
⑦普通分子间的碰撞有时候也能发生化学反应。
A.①④ B.③④⑦ C.④⑤⑥ D.②⑤
B
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
内 因
外 因
二.有效碰撞理论对影响化学反应速率因素的解释
结合碰撞理论,探讨外因的改变影响化学反应速率的原因:
反应物浓度增大→单位体积内活化分子数 → 单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
1、浓度对反应速率的影响
分子总数:10
活化分子数:3
活化分子百分数:30%
分子总数:20
活化分子数:6
活化分子百分数:30%
增多
增大
减小
增加
2、温度对反应速率的影响
分子总数:10
活化分子数:3
活化分子百分数:30%
分子总数:10
活化分子数:7
活化分子百分数:70%
温度升高→活化分子的百分数 → 单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
减小
增加
增大
增加
3、压强对反应速率的影响
增大压强→气体体积 →反应物浓度 →单位体积内活化分子数 → 单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
减小
增加
增大
增加
增大
减小
即压强对化学反应速率的影响,可转化成 对化学反应速率的影响。
浓度
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
4、催化剂对反应速率的影响
使用催化剂→反应的活化能 →活化分子的百分数 → 单位时间内有效碰撞的次数 →反应速率 。
增大
增加
增加
降低
能量
反应过程
E1
E2
ΔH
无催化反应
催化反应
(1)使用适当的催化剂能减少过程中的能耗。
(2)使用催化剂能改变反应速率,但反应热没变。
小结:影响化学反应速率的外因
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数 增大反应物浓度
增大压强
升高温度
加催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
催化剂 >>温度>浓度=压强(体积变化引起的)
1.增大反应物的浓度使反应速率加快的主要原因( )
2.对于气体参与体系增大压强使反应速率加快的主要
原因是( )
3.升高温度使反应速率加快的主要原因是( )
4.使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
2、下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
3、设NO+CO2 2CO(正反应吸热)反应速率为v1;
N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
4.在一氧化碳变换反应CO + H2O CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
D
5.已知反应:2NO(g)+Br2(g) 2NOBr(g) ΔH= a kJ mol 1(a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2 是该反应的催化剂
C.正反应的活化能比逆反应的活化能小 a kJ/mol
D.增大 Br2(g) 浓度能增大活化分子百分数,加快反应速率
C
6.某反应的反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
C
第二章 化学反应速率和化学平衡
第一节 化学反应速率
第2课时 活化能
以下是投篮球的三种情况:第一种,能量不够;
第二种,方向不合适;第三种,足够的能量和合适的方向。
通过生活经验和之前所学知识,我们知道,不同化学反应速率不同,浓度、温度、压强、催化剂也会影响化学反应速率。这些从宏观上都已得到证实,从微观上我们怎么理解这些反应速率不同?
思考与交流
分子相互碰撞是引发反应的先决条件。
2.分子间发生化学反应的必要条件是什么?
1.化学反应的本质是什么?
反应物中旧化学键的断裂;生成物中新化学键的形成
研究发现大多数化学反应不是经过简单碰撞完成的,而是经过多个反应步骤才能实现。
一、有效碰撞理论
1.基元反应和反应历程
例如: 2HI= H2 + I2
第一步: 2HI → H2+2 I
第二步: 2I → I2
自由基:带有单电子的原子或原子团。自由基的反应活性很强,寿命极短。
①每一步反应称为基元反应
②多步基元反应反映了反应历程,又称反应机理
③基元反应发生的先决条件是反应物的分子必须发生碰撞
是不是所有的碰撞都能引发反应?
?思考时间
实际并非如此
力量不够
取向不好
好球!有效碰撞
HI分解反应中分子碰撞示意图
2、有效碰撞
碰撞时能量不足
碰撞时取向不合适
有效碰撞
①概念:
②条件:
③推论:
活化分子
碰撞是发生化学反应的先决条件;而有效碰撞是充要条件
能够发生化学反应的碰撞
足够的能量;合适的取向
单位时间内有效碰撞的次数越多,该反应的速率越快。
3、活化分子和活化能
①活化分子:能够发生有效碰撞的分子,必须具有足够能量
活化分子百分数=
活化分子数
反应物分子数
×100%
其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
发生有效碰撞的分子一定是活化分子;
活化分子不一定发生有效碰撞
注意:
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
反应热
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热
③反应物、生成物的能量与活化能的关系
特别提示:活化能越小,普通分子就越容易变成活化分子。
也可认为逆反应的活化能
④化学反应速率与活化分子、有效碰撞的关系
反应物分子中活化分子的百分数越大、单位体积内活化分子数 ,
单位时间内有效碰撞的次数 ,化学反应速率 。
活化能高,反应难;
活化能低,反应易。
越多
越多
越快
小结一:有效碰撞理论
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
碰撞频率越高,反应速率越快
普通分子
活化能
【例1】下列说法错误的是( )
①具有较高能量的分子发生有适当取向的碰撞,才能发生化学反应。②发生有效碰撞的分子都是活化分子。
③活化分子间的碰撞都是有效碰撞。
④水溶液中的化学反应的活化能都接近于0。
⑤反应热△H=正反应的活化能—逆反应的活化能。
⑥活化能指活化分子多出反应物分子平均能量的那部分能量。
⑦普通分子间的碰撞有时候也能发生化学反应。
A.①④ B.③④⑦ C.④⑤⑥ D.②⑤
B
反应物本身的性质
活化能的大小
单位体积内活化分子的多少
单位时间内有效碰撞次数的多少
化学反应速率的快慢
决定
决定
决定
决定
内 因
外 因
二.有效碰撞理论对影响化学反应速率因素的解释
结合碰撞理论,探讨外因的改变影响化学反应速率的原因:
反应物浓度增大→单位体积内活化分子数 → 单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
1、浓度对反应速率的影响
分子总数:10
活化分子数:3
活化分子百分数:30%
分子总数:20
活化分子数:6
活化分子百分数:30%
增多
增大
减小
增加
2、温度对反应速率的影响
分子总数:10
活化分子数:3
活化分子百分数:30%
分子总数:10
活化分子数:7
活化分子百分数:70%
温度升高→活化分子的百分数 → 单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
减小
增加
增大
增加
3、压强对反应速率的影响
增大压强→气体体积 →反应物浓度 →单位体积内活化分子数 → 单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
减小
增加
增大
增加
增大
减小
即压强对化学反应速率的影响,可转化成 对化学反应速率的影响。
浓度
活化分子能量
反应物平均能量
生成物平均能量
有催化剂
4、催化剂对反应速率的影响
使用催化剂→反应的活化能 →活化分子的百分数 → 单位时间内有效碰撞的次数 →反应速率 。
增大
增加
增加
降低
能量
反应过程
E1
E2
ΔH
无催化反应
催化反应
(1)使用适当的催化剂能减少过程中的能耗。
(2)使用催化剂能改变反应速率,但反应热没变。
小结:影响化学反应速率的外因
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数 增大反应物浓度
增大压强
升高温度
加催化剂
增加
增加
不变
增加
加快
增加
增加
不变
增加
加快
不变
增加
增加
增加
加快
不变
增加
增加
增加
加快
催化剂 >>温度>浓度=压强(体积变化引起的)
1.增大反应物的浓度使反应速率加快的主要原因( )
2.对于气体参与体系增大压强使反应速率加快的主要
原因是( )
3.升高温度使反应速率加快的主要原因是( )
4.使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
2、下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( )
A、增大浓度 B、增大压强
C、升高温度 D、使用催化剂
D
3、设NO+CO2 2CO(正反应吸热)反应速率为v1;
N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( )
A、同时增大 B、 同时减小
C、v1减少,v2增大 D、v1增大,v2减小
A
4.在一氧化碳变换反应CO + H2O CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是( )
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
D
5.已知反应:2NO(g)+Br2(g) 2NOBr(g) ΔH= a kJ mol 1(a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2(g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A.该反应的速率主要取决于①的快慢
B.NOBr2 是该反应的催化剂
C.正反应的活化能比逆反应的活化能小 a kJ/mol
D.增大 Br2(g) 浓度能增大活化分子百分数,加快反应速率
C
6.某反应的反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.催化剂能改变反应的焓变
C.催化剂能降低反应的活化能
D.逆反应的活化能大于正反应的活化能
C
