3.3.1 盐类的水解.pptx
文档属性
| 名称 | 3.3.1 盐类的水解.pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:31:49 | ||
图片预览






文档简介
(共33张PPT)
第1课时 盐类的水解
第三节 盐类的水解
第三章 水溶液中的离子反应与平衡
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸并使食品松软或酥脆,为什么 Na2CO3可被当作“碱”使用呢
【思考与讨论】
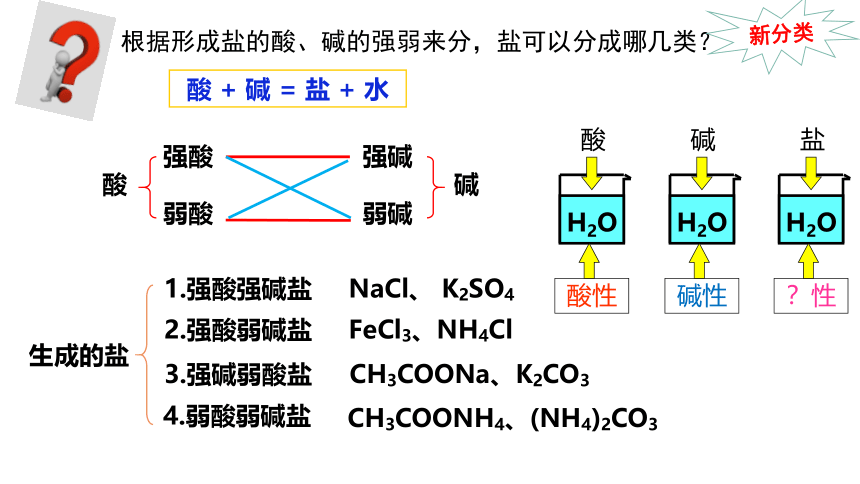
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
H2O
酸性
酸
新分类
H2O
碱性
碱
H2O
?性
盐
酸 + 碱 = 盐 + 水
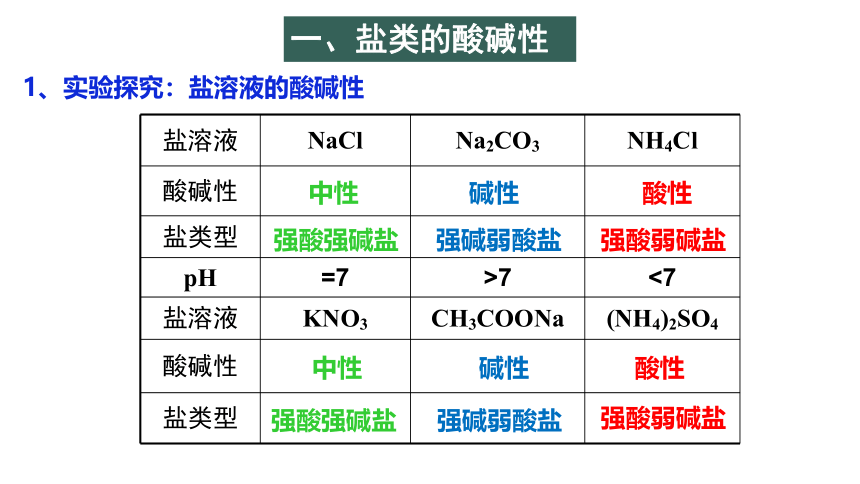
盐溶液 NaCl Na2CO3 NH4Cl
酸碱性
盐类型
pH =7 >7 <7
盐溶液 KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类型
1、实验探究:盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强酸弱碱盐
一、盐类的酸碱性
2.实验结论:盐的类型与盐溶液酸碱性的关系:
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
谁强显谁性,同强呈中性
记住啦!
活学活用
【练1】①NaClO ②CaI2 ③(NH4)2SO4 ④CuSO4 ⑤CH3COOK
⑥Na2S ⑦FeCl3 ⑧Al(NO3)3 ⑨CsBr ⑩RbF
以上溶液中,呈酸性的有 ,碱性的有 ,中性的有 。
③④⑦⑧
①⑤⑥⑩
②⑨
【练2】等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是( )
A、酸性 B、中性 C、碱性 D、碱性或中性
D
常见弱酸、弱碱:
H2SO3>H3PO4>HF>HNO2>CH3COOH>H2CO3>H2S>HClO>H2SiO3
NH3·H2O、Al(OH)3、Fe(OH)2、Fe(OH)3、Zn(OH)2、Mg(OH)2、Cu(OH)2
3.盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
当分别加入 NaCl、NH4Cl、CH3COONa 形成溶液后,请思考:
(1) 相关的电离方程式?
(2) 盐溶液中存在哪些粒子?
(3) 哪些粒子间可能结合(生成弱电解质)?
(4) 对水的电离平衡有何影响?
(5) 相关的化学方程式?
分析后,填写书 P70 表格
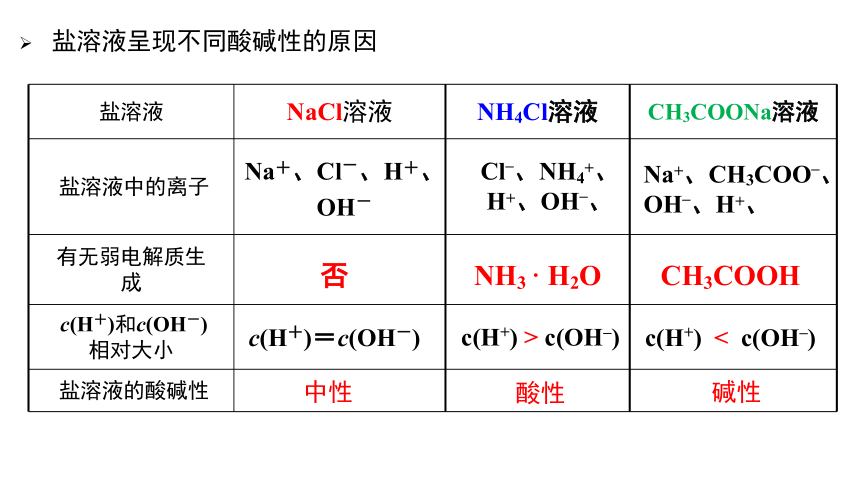
盐溶液呈现不同酸碱性的原因
盐溶液 NaCl溶液 NH4Cl溶液 CH3COONa溶液
盐溶液中的离子
有无弱电解质生成
c(H+)和c(OH-)相对大小
盐溶液的酸碱性
Na+、Cl-、H+、
OH-
否
c(H+)=c(OH-)
中性
Cl–、NH4+、H+、OH–、
NH3 · H2O
c(H+) > c(OH–)
酸性
Na+、CH3COO–、OH–、H+、
CH3COOH
c(H+) < c(OH–)
碱性
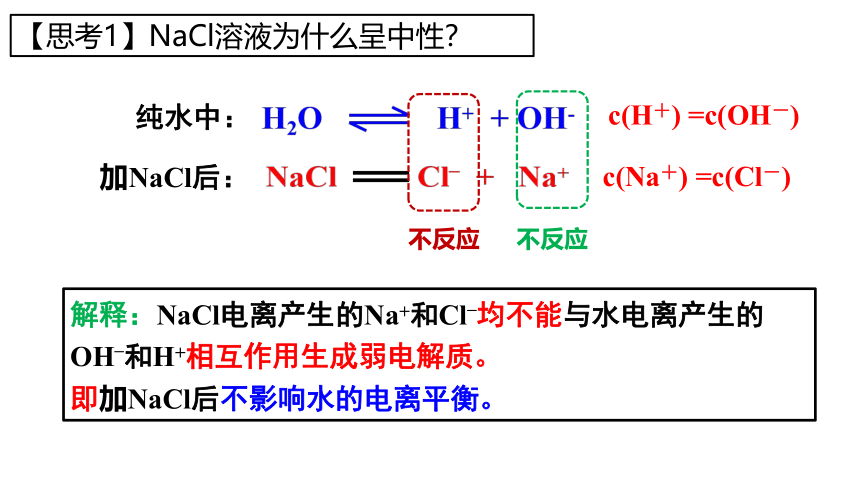
【思考1】NaCl溶液为什么呈中性?
纯水中:
加NaCl后:
c(H+) =c(OH-)
c(Na+) =c(Cl-)
解释:NaCl电离产生的Na+和Cl–均不能与水电离产生的OH–和H+相互作用生成弱电解质。
即加NaCl后不影响水的电离平衡。
不反应
不反应
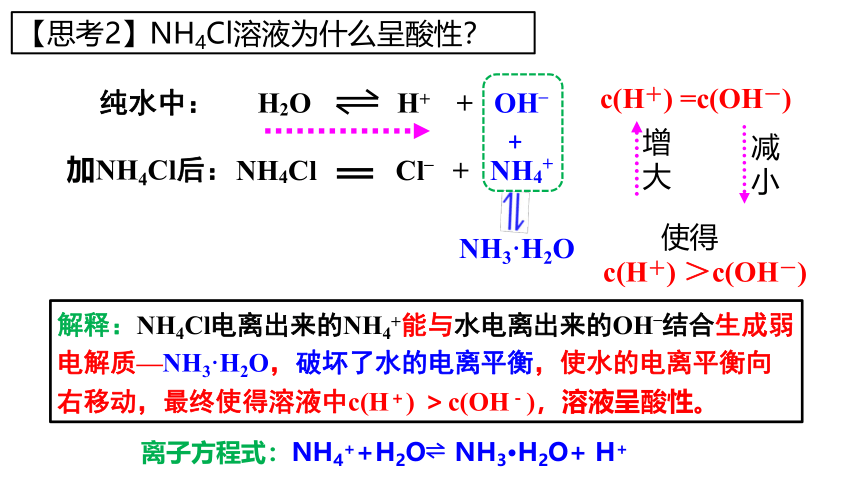
【思考2】NH4Cl溶液为什么呈酸性?
H2O H+ + OH–
纯水中:
c(H+) =c(OH-)
加NH4Cl后:
NH4Cl Cl– + NH4+
NH3·H2O
减小
增大
+
c(H+) >c(OH-)
使得
解释:NH4Cl电离出来的NH4+能与水电离出来的OH–结合生成弱电解质—NH3·H2O,破坏了水的电离平衡,使水的电离平衡向右移动,最终使得溶液中c(H+) >c(OH-),溶液呈酸性。
离子方程式:NH4++H2O NH3·H2O+ H+
【思考3】CH3COONa溶液为什么呈碱性?
H2O H+ + OH–
纯水中:
c(H+) =c(OH-)
CH3COONa = CH3COO_ + Na+
加醋酸钠:
+
CH3COOH
减小
增大
c(H+) <c(OH-)
使得
解释:CH3COONa电离出来的CH3COO-能与水电离出来的H+结合生成弱电解质—CH3COOH,破坏了水的电离平衡,使水的电离平衡向右移动,最终使得溶液中c(H+) <c(OH-),溶液呈碱性。
离子方程式:CH3COO-+H2O CH3COOH+ OH-
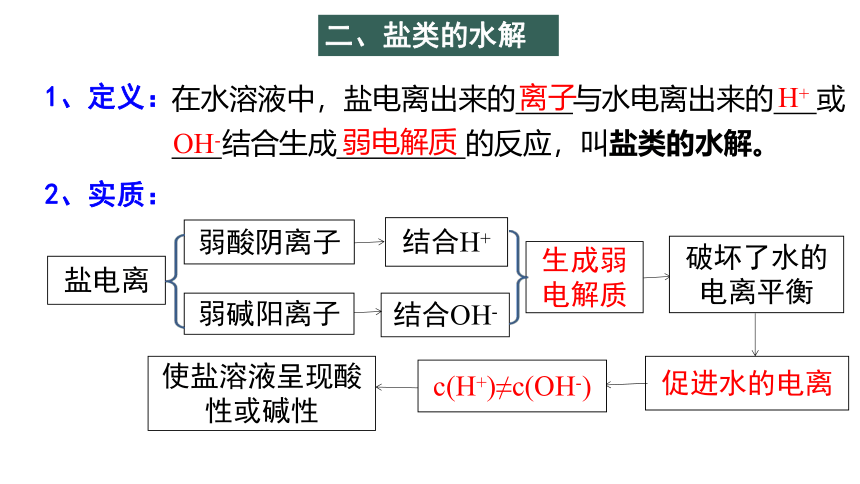
二、盐类的水解
1、定义:
在水溶液中,盐电离出来的 与水电离出来的 或
结合生成 的反应,叫盐类的水解。
2、实质:
弱酸阴离子
弱碱阳离子
结合H+
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现酸性或碱性
盐电离
结合OH-
生成弱电解质
离子
H+
OH-
弱电解质
3、表示
①用化学方程式表示:
如AlCl3的水解:
②用离子方程式表示:
如NH4NO3的水解:
(1)盐必须溶于水中。
(2)盐中必须有弱酸根阴离子或弱碱阳离子
可溶才水解,不溶不水解
无弱不水解,有弱才水解
记住啦!
4、条件
盐+水 酸+碱
AlCl3+3H2O Al(OH)3+3HCl
盐的弱离子+水 酸(或碱)+OH-(或H+)
NH4++H2O NH3·H2O+H+
5、盐类水解反应的特征
(1)可逆:是酸碱中和反应的逆反应
(2)吸热:△H>0,酸碱中和是放热反应
(3)微弱
(4)水解平衡(动态)
例1.下列哪些盐能发生水解?溶液显什么性?
FeCl3
Na2SiO3
NaClO
Na2S
NaF
KNO3
酸性
碱性
碱性
碱性
碱性
中性
FeCl2
酸性
CuSO4
酸性
谁弱谁水解,谁强显谁性
记住啦!
深度思考
1.pH均为4的H2SO4溶液和NH4Cl溶液中,水电离产生的c(H+)相等吗?
2.某盐溶液显中性,该盐一定是强酸强碱盐吗?
提示:不相等。H2SO4抑制水的电离,而NH4Cl促进水的电离
NH4Cl溶液中水的电离程度更大。
提示:不一定,也有可能是弱酸弱碱盐,
如CH3COONH4显中性。
第一步
HCO3-
H2O OH-+ H+
Na2CO3=2Na++ CO32-
+
CO32-+H2O OH-+HCO3-(主)
HCO3-+H2O OH-+H2CO3(次)
第二步
生成的HCO3-进一步发生水解:
Na2CO3第二步水解的程度很小,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
【思考】Na2CO3中的CO32-也水解,碳酸根水解分几步进行 与碳酸的元数有何对应关系
盐类 溶液酸碱性 规律
强酸强碱盐
强酸弱碱盐
强碱弱酸盐 弱酸弱碱盐 中性
酸性
碱性
无弱不水解,同强显中性
谁弱谁水解,谁强显谁性
都弱都水解,同弱显中性,谁强显谁性
问题1:查阅资料可知,CH3COOH和NH3·H2O的电离平衡常数几乎相等,请问CH3COONH4溶液显啥性?为什么?
中性
越弱越水解,同弱的情况,水解产生的c(H+)=c(OH-),故显中性
有弱才水解,无弱不水解;
越弱越水解,都弱都水解;
谁强显谁性,同强显中性,
5.盐类水解规律
【练3】下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H + 或OH-与盐中弱离子结合,造成盐溶液呈酸碱性
C
(1)用“ ”符号;
(2)一般水解程度很小,水解产物很少,通常不用“↓”、“↑”符号,生成物(如H2CO3、NH3·H2O等)也不写分解产物;
NH4++H2O NH3·H2O+H+
(为主)
(3)多元弱酸根离子水解是分步进行的,水解程度取决于第一步。
CO32-+H2O HCO3-+OH-
HCO3-+H2O H2CO3+OH-
(4)多元弱碱阳离子的水解方程式一步写完
Fe3++3H2O Fe(OH)3+3H+
(5)多元弱酸的酸式根离子,水解和电离同步进行。
5.盐类水解离子方程式的书写
例:请写出下列盐溶液的水解离子方程式
(1)NaClO溶液
(2)(NH4)2SO4溶液
(3)Na2S溶液
(5)FeCl3溶液
(4)Na2SO3溶液
图示泡沫灭火器(标准型)。里面是装有硫酸铝溶液的塑料内筒。外筒装着发泡剂和碳酸氢钠的混合溶液。
泡沫灭火器
为什么Al2(SO4)3溶液与NaHCO3溶液混合会产生CO2气体和Al(OH)3沉淀呢?
H2O
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
Al3++3H2O Al(OH)3+3H+
HCO3-+H2O H2CO3+OH-
=
+
(6)双水解:
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
CH3COONH4
有两种离子同时发生水解
①微弱的双水解:
没有同时生成气体和沉淀、或者相互抑制
没有同时生成气体、沉淀,程度微弱
相互抑制型: (NH4)2Fe(SO4)2
NH4+:
Fe2+:
NH4+ + H2O NH3·H2O + H+
Fe2+ + 2H2O Fe(OH)2 + 2H+
例:NH4HCO3
(NH4)2CO3
②完全双水解:
水解进行完全,阴阳离子不能在溶液中大量共存的:
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
完全双水解的条件:
①一种弱离子水解呈碱性,另一种弱离子水解呈酸性;
②水解产物必须是沉淀和气体或都是沉淀。
离子方程式的书写:
①写出发生双水解的离子、水及水解产物;
②根据电荷守恒和质量守恒配平;
③沉淀或气体书写“↓”和“↑”符号,且用“=”连接,一步到位。
①Al3+与AlO2-、CO32-、HCO3-、 HS-、S2-、SiO32-
② Fe3+与AlO2-、CO32-、HCO3- 、SiO32-
③ NH4+与SiO32-、AlO2-
说明:(Fe3+与 S2-、HS-)主要发生氧化还原反应
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
例题:双水解的离子方程式的书写:
(1) Al3+与 CO32- (2) Al3+与 HCO3- (3) Al3+与 S2-
完全双水解例子:
【练5】下列离子方程式属于盐的水解,且书写正确的是( )
A.FeCl3溶液:Fe3++3H2O=Fe(OH)3↓+3H+
B.Na2S溶液:S2-+2H2O H2S+2OH-
C.NaHCO3溶液:HCO3-+2H2O H2O+CO2↑+OH-
D.NH4Cl溶液:NH4++H2O=NH3·H2O+H+
【练6】下列离子方程式中,属于水解反应的是( )
A.CH3COOH+H2O CH3COO-+H3O+
B.CO32-+H2O HCO3-+OH-
C.CO2+H2O HCO3-+H+
D.HS-+H2O S2-+H3O+
D
B
归纳整理
水解的对象
水解的本质
水解的结果
盐的水解
有弱就水解,
无弱不水解!
促进水的电离
谁强显谁性,
都强显中性。
1.下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.Na2CO3溶液显碱性,是因为溶液中c(OH-)>c(H+)
D.NaHCO3溶液显酸性
2.下列物质的水溶液中,呈碱性的是( )
A.CH3COONa B.Na2SO4 C.NH4Cl D.KAl (SO4)2
C
A
3.下列物质的水溶液中,除了水分子外,不存在其他分子的是( )
A. HCl B. NH4NO3 C. Na2S D. HClO
4.下列离子方程式书写正确的是( )
A. Na2S溶液的水解:S2-+2H2O H2S+2OH-
B. NaHCO3在水溶液中的电离:HCO3-+H2O H2CO3+OH-
C. NH4Cl的水解:NH4++H2O NH3 H2O+OH-
D. 硫酸铝溶液和碳酸氢钠溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
A
D
5.实验测定NaHCO3溶液显碱性,下列说法中正确的是( )
A. 在水溶液中,HCO3-仅仅发生水解
B. 在水溶液中,HCO3-仅仅发生电离
C. 在水溶液中,HCO3-的电离程度要大于水解程度
D. 在水溶液中,HCO3-的水解程度要大于电离程度
6.将浓度和体积均相同的一元酸HA溶液与一元碱BOH溶液混合,所得溶液呈酸性。下列判断正确的是( )
A.HA一定不是弱酸 B.BOH一定不是强碱
C.HA一定是强酸 D.BOH一定是强碱
D
B
7.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题。
(1)该氯化铵溶液中含氮的粒子有 。
(2)该溶液中c(Cl-) (填“>”“<”“=”)c(NH4+)。
(3)该氯化铵溶液中水电离的氢离子浓度 (填“>”“<”“=”)pH=4盐酸中水电离的氢离子浓度。
(4)该氯化铵溶液中c水(H+)与pH=4盐酸中c水(H+)的比值为 。
NH4+、NH3·H2O
>
>
106
【能力提升】有25 ℃时浓度都是 1 mol/L 的四种正盐溶液: AX 、 BX 、 AY 、 BY 。 AX 的溶液 pH=7 且溶液中 c(X-)=1mol/L,BX的溶液 pH=4 ,BY 的溶液 pH=6 。下列说法正确的是( )
A. 电离平衡常数 K( BOH )< K (HY )
B.AY 溶液的 pH 小于 BY 的 pH 值
C. 稀释相同倍数,溶液 pH 变化 BX 等于 BY
D.将浓度均为1mol/L的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY
A
第1课时 盐类的水解
第三节 盐类的水解
第三章 水溶液中的离子反应与平衡
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸并使食品松软或酥脆,为什么 Na2CO3可被当作“碱”使用呢
【思考与讨论】
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
H2O
酸性
酸
新分类
H2O
碱性
碱
H2O
?性
盐
酸 + 碱 = 盐 + 水
盐溶液 NaCl Na2CO3 NH4Cl
酸碱性
盐类型
pH =7 >7 <7
盐溶液 KNO3 CH3COONa (NH4)2SO4
酸碱性
盐类型
1、实验探究:盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强酸弱碱盐
一、盐类的酸碱性
2.实验结论:盐的类型与盐溶液酸碱性的关系:
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
谁强显谁性,同强呈中性
记住啦!
活学活用
【练1】①NaClO ②CaI2 ③(NH4)2SO4 ④CuSO4 ⑤CH3COOK
⑥Na2S ⑦FeCl3 ⑧Al(NO3)3 ⑨CsBr ⑩RbF
以上溶液中,呈酸性的有 ,碱性的有 ,中性的有 。
③④⑦⑧
①⑤⑥⑩
②⑨
【练2】等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是( )
A、酸性 B、中性 C、碱性 D、碱性或中性
D
常见弱酸、弱碱:
H2SO3>H3PO4>HF>HNO2>CH3COOH>H2CO3>H2S>HClO>H2SiO3
NH3·H2O、Al(OH)3、Fe(OH)2、Fe(OH)3、Zn(OH)2、Mg(OH)2、Cu(OH)2
3.盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
当分别加入 NaCl、NH4Cl、CH3COONa 形成溶液后,请思考:
(1) 相关的电离方程式?
(2) 盐溶液中存在哪些粒子?
(3) 哪些粒子间可能结合(生成弱电解质)?
(4) 对水的电离平衡有何影响?
(5) 相关的化学方程式?
分析后,填写书 P70 表格
盐溶液呈现不同酸碱性的原因
盐溶液 NaCl溶液 NH4Cl溶液 CH3COONa溶液
盐溶液中的离子
有无弱电解质生成
c(H+)和c(OH-)相对大小
盐溶液的酸碱性
Na+、Cl-、H+、
OH-
否
c(H+)=c(OH-)
中性
Cl–、NH4+、H+、OH–、
NH3 · H2O
c(H+) > c(OH–)
酸性
Na+、CH3COO–、OH–、H+、
CH3COOH
c(H+) < c(OH–)
碱性
【思考1】NaCl溶液为什么呈中性?
纯水中:
加NaCl后:
c(H+) =c(OH-)
c(Na+) =c(Cl-)
解释:NaCl电离产生的Na+和Cl–均不能与水电离产生的OH–和H+相互作用生成弱电解质。
即加NaCl后不影响水的电离平衡。
不反应
不反应
【思考2】NH4Cl溶液为什么呈酸性?
H2O H+ + OH–
纯水中:
c(H+) =c(OH-)
加NH4Cl后:
NH4Cl Cl– + NH4+
NH3·H2O
减小
增大
+
c(H+) >c(OH-)
使得
解释:NH4Cl电离出来的NH4+能与水电离出来的OH–结合生成弱电解质—NH3·H2O,破坏了水的电离平衡,使水的电离平衡向右移动,最终使得溶液中c(H+) >c(OH-),溶液呈酸性。
离子方程式:NH4++H2O NH3·H2O+ H+
【思考3】CH3COONa溶液为什么呈碱性?
H2O H+ + OH–
纯水中:
c(H+) =c(OH-)
CH3COONa = CH3COO_ + Na+
加醋酸钠:
+
CH3COOH
减小
增大
c(H+) <c(OH-)
使得
解释:CH3COONa电离出来的CH3COO-能与水电离出来的H+结合生成弱电解质—CH3COOH,破坏了水的电离平衡,使水的电离平衡向右移动,最终使得溶液中c(H+) <c(OH-),溶液呈碱性。
离子方程式:CH3COO-+H2O CH3COOH+ OH-
二、盐类的水解
1、定义:
在水溶液中,盐电离出来的 与水电离出来的 或
结合生成 的反应,叫盐类的水解。
2、实质:
弱酸阴离子
弱碱阳离子
结合H+
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现酸性或碱性
盐电离
结合OH-
生成弱电解质
离子
H+
OH-
弱电解质
3、表示
①用化学方程式表示:
如AlCl3的水解:
②用离子方程式表示:
如NH4NO3的水解:
(1)盐必须溶于水中。
(2)盐中必须有弱酸根阴离子或弱碱阳离子
可溶才水解,不溶不水解
无弱不水解,有弱才水解
记住啦!
4、条件
盐+水 酸+碱
AlCl3+3H2O Al(OH)3+3HCl
盐的弱离子+水 酸(或碱)+OH-(或H+)
NH4++H2O NH3·H2O+H+
5、盐类水解反应的特征
(1)可逆:是酸碱中和反应的逆反应
(2)吸热:△H>0,酸碱中和是放热反应
(3)微弱
(4)水解平衡(动态)
例1.下列哪些盐能发生水解?溶液显什么性?
FeCl3
Na2SiO3
NaClO
Na2S
NaF
KNO3
酸性
碱性
碱性
碱性
碱性
中性
FeCl2
酸性
CuSO4
酸性
谁弱谁水解,谁强显谁性
记住啦!
深度思考
1.pH均为4的H2SO4溶液和NH4Cl溶液中,水电离产生的c(H+)相等吗?
2.某盐溶液显中性,该盐一定是强酸强碱盐吗?
提示:不相等。H2SO4抑制水的电离,而NH4Cl促进水的电离
NH4Cl溶液中水的电离程度更大。
提示:不一定,也有可能是弱酸弱碱盐,
如CH3COONH4显中性。
第一步
HCO3-
H2O OH-+ H+
Na2CO3=2Na++ CO32-
+
CO32-+H2O OH-+HCO3-(主)
HCO3-+H2O OH-+H2CO3(次)
第二步
生成的HCO3-进一步发生水解:
Na2CO3第二步水解的程度很小,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
【思考】Na2CO3中的CO32-也水解,碳酸根水解分几步进行 与碳酸的元数有何对应关系
盐类 溶液酸碱性 规律
强酸强碱盐
强酸弱碱盐
强碱弱酸盐 弱酸弱碱盐 中性
酸性
碱性
无弱不水解,同强显中性
谁弱谁水解,谁强显谁性
都弱都水解,同弱显中性,谁强显谁性
问题1:查阅资料可知,CH3COOH和NH3·H2O的电离平衡常数几乎相等,请问CH3COONH4溶液显啥性?为什么?
中性
越弱越水解,同弱的情况,水解产生的c(H+)=c(OH-),故显中性
有弱才水解,无弱不水解;
越弱越水解,都弱都水解;
谁强显谁性,同强显中性,
5.盐类水解规律
【练3】下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H + 或OH-与盐中弱离子结合,造成盐溶液呈酸碱性
C
(1)用“ ”符号;
(2)一般水解程度很小,水解产物很少,通常不用“↓”、“↑”符号,生成物(如H2CO3、NH3·H2O等)也不写分解产物;
NH4++H2O NH3·H2O+H+
(为主)
(3)多元弱酸根离子水解是分步进行的,水解程度取决于第一步。
CO32-+H2O HCO3-+OH-
HCO3-+H2O H2CO3+OH-
(4)多元弱碱阳离子的水解方程式一步写完
Fe3++3H2O Fe(OH)3+3H+
(5)多元弱酸的酸式根离子,水解和电离同步进行。
5.盐类水解离子方程式的书写
例:请写出下列盐溶液的水解离子方程式
(1)NaClO溶液
(2)(NH4)2SO4溶液
(3)Na2S溶液
(5)FeCl3溶液
(4)Na2SO3溶液
图示泡沫灭火器(标准型)。里面是装有硫酸铝溶液的塑料内筒。外筒装着发泡剂和碳酸氢钠的混合溶液。
泡沫灭火器
为什么Al2(SO4)3溶液与NaHCO3溶液混合会产生CO2气体和Al(OH)3沉淀呢?
H2O
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
Al3++3H2O Al(OH)3+3H+
HCO3-+H2O H2CO3+OH-
=
+
(6)双水解:
CH3COO– + NH4+ + H2O CH3COOH + NH3·H2O
CH3COONH4
有两种离子同时发生水解
①微弱的双水解:
没有同时生成气体和沉淀、或者相互抑制
没有同时生成气体、沉淀,程度微弱
相互抑制型: (NH4)2Fe(SO4)2
NH4+:
Fe2+:
NH4+ + H2O NH3·H2O + H+
Fe2+ + 2H2O Fe(OH)2 + 2H+
例:NH4HCO3
(NH4)2CO3
②完全双水解:
水解进行完全,阴阳离子不能在溶液中大量共存的:
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
完全双水解的条件:
①一种弱离子水解呈碱性,另一种弱离子水解呈酸性;
②水解产物必须是沉淀和气体或都是沉淀。
离子方程式的书写:
①写出发生双水解的离子、水及水解产物;
②根据电荷守恒和质量守恒配平;
③沉淀或气体书写“↓”和“↑”符号,且用“=”连接,一步到位。
①Al3+与AlO2-、CO32-、HCO3-、 HS-、S2-、SiO32-
② Fe3+与AlO2-、CO32-、HCO3- 、SiO32-
③ NH4+与SiO32-、AlO2-
说明:(Fe3+与 S2-、HS-)主要发生氧化还原反应
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
例题:双水解的离子方程式的书写:
(1) Al3+与 CO32- (2) Al3+与 HCO3- (3) Al3+与 S2-
完全双水解例子:
【练5】下列离子方程式属于盐的水解,且书写正确的是( )
A.FeCl3溶液:Fe3++3H2O=Fe(OH)3↓+3H+
B.Na2S溶液:S2-+2H2O H2S+2OH-
C.NaHCO3溶液:HCO3-+2H2O H2O+CO2↑+OH-
D.NH4Cl溶液:NH4++H2O=NH3·H2O+H+
【练6】下列离子方程式中,属于水解反应的是( )
A.CH3COOH+H2O CH3COO-+H3O+
B.CO32-+H2O HCO3-+OH-
C.CO2+H2O HCO3-+H+
D.HS-+H2O S2-+H3O+
D
B
归纳整理
水解的对象
水解的本质
水解的结果
盐的水解
有弱就水解,
无弱不水解!
促进水的电离
谁强显谁性,
都强显中性。
1.下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.Na2CO3溶液显碱性,是因为溶液中c(OH-)>c(H+)
D.NaHCO3溶液显酸性
2.下列物质的水溶液中,呈碱性的是( )
A.CH3COONa B.Na2SO4 C.NH4Cl D.KAl (SO4)2
C
A
3.下列物质的水溶液中,除了水分子外,不存在其他分子的是( )
A. HCl B. NH4NO3 C. Na2S D. HClO
4.下列离子方程式书写正确的是( )
A. Na2S溶液的水解:S2-+2H2O H2S+2OH-
B. NaHCO3在水溶液中的电离:HCO3-+H2O H2CO3+OH-
C. NH4Cl的水解:NH4++H2O NH3 H2O+OH-
D. 硫酸铝溶液和碳酸氢钠溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2 ↑
A
D
5.实验测定NaHCO3溶液显碱性,下列说法中正确的是( )
A. 在水溶液中,HCO3-仅仅发生水解
B. 在水溶液中,HCO3-仅仅发生电离
C. 在水溶液中,HCO3-的电离程度要大于水解程度
D. 在水溶液中,HCO3-的水解程度要大于电离程度
6.将浓度和体积均相同的一元酸HA溶液与一元碱BOH溶液混合,所得溶液呈酸性。下列判断正确的是( )
A.HA一定不是弱酸 B.BOH一定不是强碱
C.HA一定是强酸 D.BOH一定是强碱
D
B
7.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题。
(1)该氯化铵溶液中含氮的粒子有 。
(2)该溶液中c(Cl-) (填“>”“<”“=”)c(NH4+)。
(3)该氯化铵溶液中水电离的氢离子浓度 (填“>”“<”“=”)pH=4盐酸中水电离的氢离子浓度。
(4)该氯化铵溶液中c水(H+)与pH=4盐酸中c水(H+)的比值为 。
NH4+、NH3·H2O
>
>
106
【能力提升】有25 ℃时浓度都是 1 mol/L 的四种正盐溶液: AX 、 BX 、 AY 、 BY 。 AX 的溶液 pH=7 且溶液中 c(X-)=1mol/L,BX的溶液 pH=4 ,BY 的溶液 pH=6 。下列说法正确的是( )
A. 电离平衡常数 K( BOH )< K (HY )
B.AY 溶液的 pH 小于 BY 的 pH 值
C. 稀释相同倍数,溶液 pH 变化 BX 等于 BY
D.将浓度均为1mol/L的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY
A
