3.4.2 沉淀溶解平衡的应用.pptx
文档属性
| 名称 | 3.4.2 沉淀溶解平衡的应用.pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:33:24 | ||
图片预览







文档简介
(共27张PPT)
第2课时 沉淀溶解平衡的应用
第四节 沉淀溶解平衡
第三章 水溶液中的离子反应与平衡
锅炉水垢CaSO4既会降低燃料的利用率,造成能源浪费,也会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。硫酸钙在硫酸、盐酸中的溶解度小,如何除去锅炉水垢呢?
工业废水的处理
工业废水
硫化物等
重金属离子(如Cu2+、Hg2+等)转化成沉淀
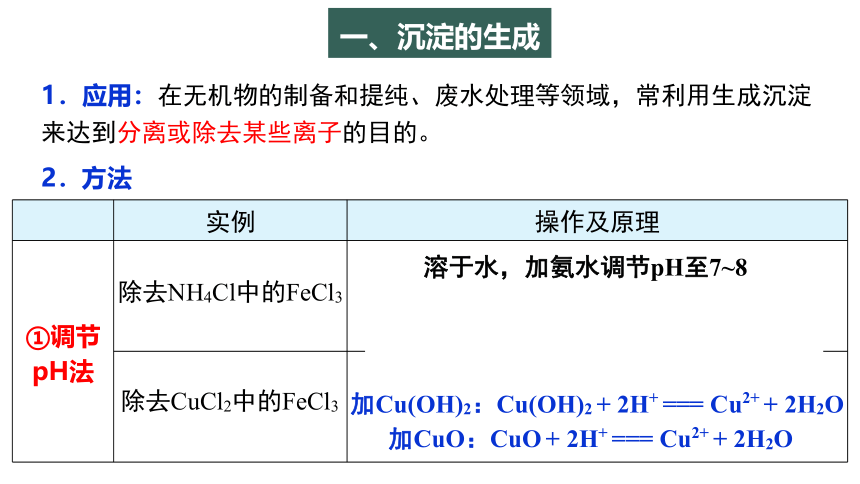
1.应用:在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
2.方法
实例 操作及原理
①调节 pH法
除去NH4Cl中的FeCl3
溶于水,加氨水调节pH至7~8
Fe3++3NH3·H2O === Fe(OH)3↓+3
除去CuCl2中的FeCl3
Fe3+ + 3H2O Fe(OH)3 + 3H+
加Cu(OH)2:Cu(OH)2 + 2H+ === Cu2+ + 2H2O
加CuO:CuO + 2H+ === Cu2+ + 2H2O
一、沉淀的生成
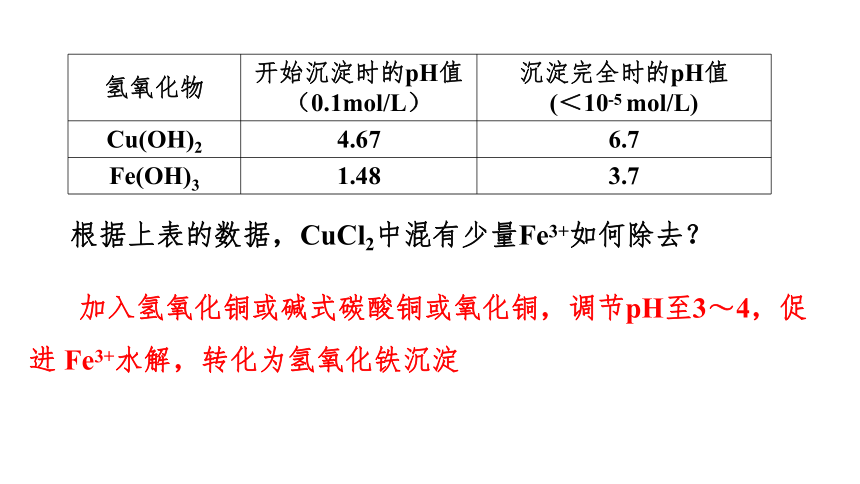
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值
(<10-5 mol/L)
Cu(OH)2 4.67 6.7
Fe(OH)3 1.48 3.7
根据上表的数据,CuCl2中混有少量Fe3+如何除去?
加入氢氧化铜或碱式碳酸铜或氧化铜,调节pH至3~4,促进 Fe3+水解,转化为氢氧化铁沉淀
【练1】若使Fe3+(当c(Fe3+) ≤ 10-5mol·L-1 时认为已完全沉淀,已知Fe (OH)3的Ksp=2.6×10-39 )完全沉淀,pH至少应为多少?
Fe (OH)3(S) Fe3+(aq)+3OH-(aq)
Ksp=c(Fe3+)c3(OH-)=2.6×10-39
pH=2.8
解:
②加沉淀剂法
如:沉淀Cu2+、Hg2+等,以Na2S或H2S做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
H2S + Cu2+=== CuS↓ + 2H+ H2S + Hg2+=== HgS↓ + 2H+
答:(1)加入钡盐。因为Ksp(BaSO4)(2)①选择沉淀物的溶度积尽量小的沉淀剂;②沉淀剂应适当过量
(1)要能除去溶液中指定的离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去,如沉淀NaNO3溶液中的Ag+,可用NaCl作沉淀剂。
(2)溶液中沉淀物的溶解度越小,离子沉淀越完全,例如,除去SO42-,选择Ba2+比Ca2+好。
(3)要注意沉淀剂的电离程度,如欲使Mg2+沉淀为Mg(OH)2,用NaOH作沉淀剂比用氨水的效果要好。
③同离子效应法
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
硫酸钡在硫酸中的溶解度比在纯水中小
例:将足量AgCl分别加入下列溶液中,AgCl溶解度由大到小的顺序是( )
①20ml0.01 mol L-1 KCl溶液 ②20ml0.02 mol L-1 CaCl2溶液 ③20ml蒸馏水
④20ml0.03 mol L-1 HCl溶液 ⑤20ml0.05 mol L-1 AgNO3溶液
A.①>②>④>③>⑤ B.③>①>④>②>⑤
C.⑤>③>②>①>④ D.③>④>⑤>②>①
B
BaSO4(s) Ba2+(aq)+SO42- (aq)
④氧化还原法
已知Fe3+在pH3~4之间开始沉淀,在pH7~8之间沉淀完全,Fe2+、Cu2+在8~9之间开始沉淀,11~12之间沉淀完全,CuCl2中混有少量Fe2+如何除去?
氧化剂可用:氯气、双氧水、氧气等(不引入杂质)
调pH可用:氧化铜,碳酸铜等(不引入杂质)
废铜(含杂质Fe)制备胆矾的流程
含铁废铜
氧化剂
H2SO4
CuSO4 (含Fe3+)
调节溶液
pH=3-4
CuSO4
Fe(OH)3
【练2】在NaCl溶液中含有少量的Na2S,欲将S2-除去,最好加入 ( )
A.HCl B.AgCl
C.NaOH D.CuCl2
A
HCO3-
+H+
+H+
H2CO3
H2O+CO2↑
例如:CaCO3为什么能溶于稀盐酸
1.原理
根据平衡移动原理,不断 溶解平衡体系中的相应离子,使平衡向 的方向移动,就达到使沉淀溶解的目的。
CaCO3(s) CO32-(aq)+Ca2+(aq)
二、沉淀的溶解
移去
沉淀溶解
Q < Ksp 时,沉淀发生溶解,要使Q减小
CaCO3+2H+=Ca2++CO2↑+H2O
①酸溶解法:
(1)医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3,什么?
BaCO3(s) Ba2+(aq)+ CO32-(aq)
HCO3-
+H+
+H+
H2CO3
→H2O+CO2↑
可见,胃酸消耗CO32-,使溶液中的CO32-浓度降低,则Q总反应BaCO3+2H+=Ba2++H2O+CO2↑
2.方法
类似可用强酸溶解的难溶电解质还有FeS、Al(OH)3、Cu(OH)2、Mg(OH)2等
3Ag2S+8H+ + 2NO3-=6Ag++3S+2NO↑+4H2O
AgCl + 2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
④盐溶液溶解法:
③氧化还原溶解法:
②生成配合物法:
如Mg(OH)2溶于NH4Cl溶液
如Ag2S溶于稀HNO3
如AgCl溶于氨水
Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3·H2O
滴加试剂 蒸馏水 盐酸
现象
实验3-3
无明显现象
固体逐渐溶解溶解
Mg(OH)2(s) Mg2+(aq)+ 2OH -(aq)
+ 2H +
2H2O
Mg(OH)2 +2HCl=MgCl2 +2 H2O
Mg(OH) 2 +2H+ =Mg2+ +2H2O
思考与交流
易错警示
(1)FeS、ZnS可溶解在稀盐酸和稀硫酸中,如FeS+2H+=Fe2++H2S↑;
CuS、Ag2S等不溶。
Ksp太小,无法发生离子反应
(2)将H2S通入FeCl2、ZnSO4溶液中不能产生FeS、ZnS沉淀;
通入CuSO4、(CH3COO)Pb溶液中,能产生CuS、PbS沉淀。
如H2S+CuSO4=CuS↓+H2SO4
(3)CuS等不溶与盐酸、硫酸(非氧化性酸)的金属硫化物能溶于硝
酸(氧化性酸);如3CuS+8HNO3(稀)=3Cu(NO3)2+2NO↑+3S+4H2O
【练3】
(1)洗涤沉淀时,洗涤次数越多越好( )
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用硫酸代替水( )
(3)CaCO3溶解时常用盐酸而不用稀硫酸,是因为稀硫酸不与CaCO3反应( )
(4)出去MgCl2溶液中的Fe2+,先加过氧化氢,再加MgO即可( )
×
×
√
√
【练3】下表是3种物质的溶解度(20℃),下列说法中正确的是( )
A.含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣)
B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
D.用石灰水处理含有Mg2+和HCO3﹣的硬水,发生的离子反应方程式为Mg2++2HCO3﹣+Ca2++2OH﹣═CaCO3↓+MgCO3↓+2H2O
物质 MgCl2 Mg(OH)2 MgCO3
溶解度/g 54.8 9×10-4 0.01
B
生成白色沉淀
黄色沉淀转变为黑色
实验3-4:
白色沉淀转变为黄色
三、沉淀的转化
Ag+ + Cl- =AgCl↓
AgCl (s) + I- (aq) AgI (s) + Cl- (aq)
2AgI (s) + S2-(aq) Ag2S (s) + 2I-(aq)
Ksp(Ag2S)向MgCl2溶液中滴加NaOH溶液
生成白色沉淀
向有白色沉淀的溶液中滴加FeCl3溶液
白色沉淀转变为红褐色
静置
红褐色沉淀析出溶液变无色
实验3-5
Mg2++ 2OH- =Mg(OH)2 ↓
3Mg(OH)2 (s) +2Fe3+(aq) 2Fe (OH)3 (s) +3Mg2+ (aq)
Ksp[Fe(OH)3]3Mg(OH)2 (s)== 3Mg2+ +6OH-
+
2Fe3+
2Fe (OH)3 ↓
1、沉淀转化的实质:
沉淀溶解平衡的移动
物质 溶解度/g
AgCl 1.5×10-4
AgI 9.6×10-9
Ag2S 1.3×10-16
2、一般规律:
一般来说,溶解度小的沉淀易转化为溶解度更小的沉淀。溶解度差别越大,转化越容易。
用盐酸或
饱和氯化铵液
用饱和Na2CO3
溶液浸泡数天
①锅炉除水垢
水垢成分CaCO3
Mg(OH)2 CaSO4
疏松的水垢CaCO3 Mg(OH)2
除去水垢
3、沉淀的转化在生活中的应用
难溶物 CaSO4 CaCO3
溶解度/g 2.1×10-1 1.5 ×10-3
CaSO4+ Na2CO3 CaCO3+ Na2SO4
CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
② 自然界中矿物的转化
③工业废水处理
工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。
用FeS除去Hg2+的离子方程式:
FeS(s)+Hg2+(aq)=HgS(s)+ Fe2+(aq)
CuSO4(aq)+ZnS(s)=CuS(s)+ZnSO4(aq)
CuSO4(aq)+PbS(s)=CuS(s)+PbSO4(s)
【练4】下列说法正确的是( )
A.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶
B.向浓度均为0.1 mol/L的MgCl2 和CuCl2 混合溶液中逐滴加入氨水,先生成蓝色Cu(OH)2 沉淀,则 Ksp [Mg(OH)2 ]< Ksp [Cu(OH)2 ]
C.BaSO4 饱和溶液中加入饱和Na2CO3 溶液有白色沉淀,说明 Ksp(BaSO4 )大于 Ksp(BaCO3 )
D.向1mL 0.2 mol/L NaOH溶液中滴入1 mL 0.1 mol/L MgCl2 溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3 溶液,又生成红褐色沉淀,证明在相同温度下,溶解度Mg(OH)2 >Fe(OH)3
D
【课堂总结】
【练4】已知ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,据此解答下列问:
(1)向等浓度的碳酸钠、硫酸钠的混合溶液中逐滴加入氯化钡溶液,最先出现的沉淀是 。
(2)某同学设想用下列流程得到BaCl2溶液:
则①的离子方程式为 ,
该反应的平衡常数K= 。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
饱和Na2CO3溶液
BaSO4 BaCO3 BaCl2
盐酸
①
②
硫酸钡
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
0.04
3×10-3
第2课时 沉淀溶解平衡的应用
第四节 沉淀溶解平衡
第三章 水溶液中的离子反应与平衡
锅炉水垢CaSO4既会降低燃料的利用率,造成能源浪费,也会影响锅炉的使用寿命,造成安全隐患,因此要定期清除。硫酸钙在硫酸、盐酸中的溶解度小,如何除去锅炉水垢呢?
工业废水的处理
工业废水
硫化物等
重金属离子(如Cu2+、Hg2+等)转化成沉淀
1.应用:在无机物的制备和提纯、废水处理等领域,常利用生成沉淀来达到分离或除去某些离子的目的。
2.方法
实例 操作及原理
①调节 pH法
除去NH4Cl中的FeCl3
溶于水,加氨水调节pH至7~8
Fe3++3NH3·H2O === Fe(OH)3↓+3
除去CuCl2中的FeCl3
Fe3+ + 3H2O Fe(OH)3 + 3H+
加Cu(OH)2:Cu(OH)2 + 2H+ === Cu2+ + 2H2O
加CuO:CuO + 2H+ === Cu2+ + 2H2O
一、沉淀的生成
氢氧化物 开始沉淀时的pH值(0.1mol/L) 沉淀完全时的pH值
(<10-5 mol/L)
Cu(OH)2 4.67 6.7
Fe(OH)3 1.48 3.7
根据上表的数据,CuCl2中混有少量Fe3+如何除去?
加入氢氧化铜或碱式碳酸铜或氧化铜,调节pH至3~4,促进 Fe3+水解,转化为氢氧化铁沉淀
【练1】若使Fe3+(当c(Fe3+) ≤ 10-5mol·L-1 时认为已完全沉淀,已知Fe (OH)3的Ksp=2.6×10-39 )完全沉淀,pH至少应为多少?
Fe (OH)3(S) Fe3+(aq)+3OH-(aq)
Ksp=c(Fe3+)c3(OH-)=2.6×10-39
pH=2.8
解:
②加沉淀剂法
如:沉淀Cu2+、Hg2+等,以Na2S或H2S做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
H2S + Cu2+=== CuS↓ + 2H+ H2S + Hg2+=== HgS↓ + 2H+
答:(1)加入钡盐。因为Ksp(BaSO4)
(1)要能除去溶液中指定的离子,又不能影响其他离子的存在,并且由沉淀剂引入溶液的杂质离子还要便于除去,如沉淀NaNO3溶液中的Ag+,可用NaCl作沉淀剂。
(2)溶液中沉淀物的溶解度越小,离子沉淀越完全,例如,除去SO42-,选择Ba2+比Ca2+好。
(3)要注意沉淀剂的电离程度,如欲使Mg2+沉淀为Mg(OH)2,用NaOH作沉淀剂比用氨水的效果要好。
③同离子效应法
硫酸中硫酸根浓度大,使平衡左移有利于沉淀生成。
硫酸钡在硫酸中的溶解度比在纯水中小
例:将足量AgCl分别加入下列溶液中,AgCl溶解度由大到小的顺序是( )
①20ml0.01 mol L-1 KCl溶液 ②20ml0.02 mol L-1 CaCl2溶液 ③20ml蒸馏水
④20ml0.03 mol L-1 HCl溶液 ⑤20ml0.05 mol L-1 AgNO3溶液
A.①>②>④>③>⑤ B.③>①>④>②>⑤
C.⑤>③>②>①>④ D.③>④>⑤>②>①
B
BaSO4(s) Ba2+(aq)+SO42- (aq)
④氧化还原法
已知Fe3+在pH3~4之间开始沉淀,在pH7~8之间沉淀完全,Fe2+、Cu2+在8~9之间开始沉淀,11~12之间沉淀完全,CuCl2中混有少量Fe2+如何除去?
氧化剂可用:氯气、双氧水、氧气等(不引入杂质)
调pH可用:氧化铜,碳酸铜等(不引入杂质)
废铜(含杂质Fe)制备胆矾的流程
含铁废铜
氧化剂
H2SO4
CuSO4 (含Fe3+)
调节溶液
pH=3-4
CuSO4
Fe(OH)3
【练2】在NaCl溶液中含有少量的Na2S,欲将S2-除去,最好加入 ( )
A.HCl B.AgCl
C.NaOH D.CuCl2
A
HCO3-
+H+
+H+
H2CO3
H2O+CO2↑
例如:CaCO3为什么能溶于稀盐酸
1.原理
根据平衡移动原理,不断 溶解平衡体系中的相应离子,使平衡向 的方向移动,就达到使沉淀溶解的目的。
CaCO3(s) CO32-(aq)+Ca2+(aq)
二、沉淀的溶解
移去
沉淀溶解
Q < Ksp 时,沉淀发生溶解,要使Q减小
CaCO3+2H+=Ca2++CO2↑+H2O
①酸溶解法:
(1)医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3,什么?
BaCO3(s) Ba2+(aq)+ CO32-(aq)
HCO3-
+H+
+H+
H2CO3
→H2O+CO2↑
可见,胃酸消耗CO32-,使溶液中的CO32-浓度降低,则Q
2.方法
类似可用强酸溶解的难溶电解质还有FeS、Al(OH)3、Cu(OH)2、Mg(OH)2等
3Ag2S+8H+ + 2NO3-=6Ag++3S+2NO↑+4H2O
AgCl + 2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O
④盐溶液溶解法:
③氧化还原溶解法:
②生成配合物法:
如Mg(OH)2溶于NH4Cl溶液
如Ag2S溶于稀HNO3
如AgCl溶于氨水
Mg(OH)2 + 2NH4+ = Mg2+ + 2NH3·H2O
滴加试剂 蒸馏水 盐酸
现象
实验3-3
无明显现象
固体逐渐溶解溶解
Mg(OH)2(s) Mg2+(aq)+ 2OH -(aq)
+ 2H +
2H2O
Mg(OH)2 +2HCl=MgCl2 +2 H2O
Mg(OH) 2 +2H+ =Mg2+ +2H2O
思考与交流
易错警示
(1)FeS、ZnS可溶解在稀盐酸和稀硫酸中,如FeS+2H+=Fe2++H2S↑;
CuS、Ag2S等不溶。
Ksp太小,无法发生离子反应
(2)将H2S通入FeCl2、ZnSO4溶液中不能产生FeS、ZnS沉淀;
通入CuSO4、(CH3COO)Pb溶液中,能产生CuS、PbS沉淀。
如H2S+CuSO4=CuS↓+H2SO4
(3)CuS等不溶与盐酸、硫酸(非氧化性酸)的金属硫化物能溶于硝
酸(氧化性酸);如3CuS+8HNO3(稀)=3Cu(NO3)2+2NO↑+3S+4H2O
【练3】
(1)洗涤沉淀时,洗涤次数越多越好( )
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用硫酸代替水( )
(3)CaCO3溶解时常用盐酸而不用稀硫酸,是因为稀硫酸不与CaCO3反应( )
(4)出去MgCl2溶液中的Fe2+,先加过氧化氢,再加MgO即可( )
×
×
√
√
【练3】下表是3种物质的溶解度(20℃),下列说法中正确的是( )
A.含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32﹣)
B.将表中三种物质与水混合,加热、灼烧,最终的固体产物相同
C.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
D.用石灰水处理含有Mg2+和HCO3﹣的硬水,发生的离子反应方程式为Mg2++2HCO3﹣+Ca2++2OH﹣═CaCO3↓+MgCO3↓+2H2O
物质 MgCl2 Mg(OH)2 MgCO3
溶解度/g 54.8 9×10-4 0.01
B
生成白色沉淀
黄色沉淀转变为黑色
实验3-4:
白色沉淀转变为黄色
三、沉淀的转化
Ag+ + Cl- =AgCl↓
AgCl (s) + I- (aq) AgI (s) + Cl- (aq)
2AgI (s) + S2-(aq) Ag2S (s) + 2I-(aq)
Ksp(Ag2S)
生成白色沉淀
向有白色沉淀的溶液中滴加FeCl3溶液
白色沉淀转变为红褐色
静置
红褐色沉淀析出溶液变无色
实验3-5
Mg2++ 2OH- =Mg(OH)2 ↓
3Mg(OH)2 (s) +2Fe3+(aq) 2Fe (OH)3 (s) +3Mg2+ (aq)
Ksp[Fe(OH)3]
+
2Fe3+
2Fe (OH)3 ↓
1、沉淀转化的实质:
沉淀溶解平衡的移动
物质 溶解度/g
AgCl 1.5×10-4
AgI 9.6×10-9
Ag2S 1.3×10-16
2、一般规律:
一般来说,溶解度小的沉淀易转化为溶解度更小的沉淀。溶解度差别越大,转化越容易。
用盐酸或
饱和氯化铵液
用饱和Na2CO3
溶液浸泡数天
①锅炉除水垢
水垢成分CaCO3
Mg(OH)2 CaSO4
疏松的水垢CaCO3 Mg(OH)2
除去水垢
3、沉淀的转化在生活中的应用
难溶物 CaSO4 CaCO3
溶解度/g 2.1×10-1 1.5 ×10-3
CaSO4+ Na2CO3 CaCO3+ Na2SO4
CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
② 自然界中矿物的转化
③工业废水处理
工业废水处理过程中,重金属离子可利用沉淀转化原理用FeS等难溶物转化为HgS、Ag2S、PbS等沉淀。
用FeS除去Hg2+的离子方程式:
FeS(s)+Hg2+(aq)=HgS(s)+ Fe2+(aq)
CuSO4(aq)+ZnS(s)=CuS(s)+ZnSO4(aq)
CuSO4(aq)+PbS(s)=CuS(s)+PbSO4(s)
【练4】下列说法正确的是( )
A.向AgI沉淀中加入饱和KCl溶液,有白色沉淀生成,说明AgCl比AgI更难溶
B.向浓度均为0.1 mol/L的MgCl2 和CuCl2 混合溶液中逐滴加入氨水,先生成蓝色Cu(OH)2 沉淀,则 Ksp [Mg(OH)2 ]< Ksp [Cu(OH)2 ]
C.BaSO4 饱和溶液中加入饱和Na2CO3 溶液有白色沉淀,说明 Ksp(BaSO4 )大于 Ksp(BaCO3 )
D.向1mL 0.2 mol/L NaOH溶液中滴入1 mL 0.1 mol/L MgCl2 溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3 溶液,又生成红褐色沉淀,证明在相同温度下,溶解度Mg(OH)2 >Fe(OH)3
D
【课堂总结】
【练4】已知ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,据此解答下列问:
(1)向等浓度的碳酸钠、硫酸钠的混合溶液中逐滴加入氯化钡溶液,最先出现的沉淀是 。
(2)某同学设想用下列流程得到BaCl2溶液:
则①的离子方程式为 ,
该反应的平衡常数K= 。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
饱和Na2CO3溶液
BaSO4 BaCO3 BaCl2
盐酸
①
②
硫酸钡
BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)
0.04
3×10-3
