4.2.1 电解原理(共33张PPT).pptx
文档属性
| 名称 | 4.2.1 电解原理(共33张PPT).pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 67.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:35:08 | ||
图片预览






文档简介
(共33张PPT)
第1课时 电解原理
第二节 电解池
第四章 化学反应与电能
Zn
Cu
CuCl2溶液
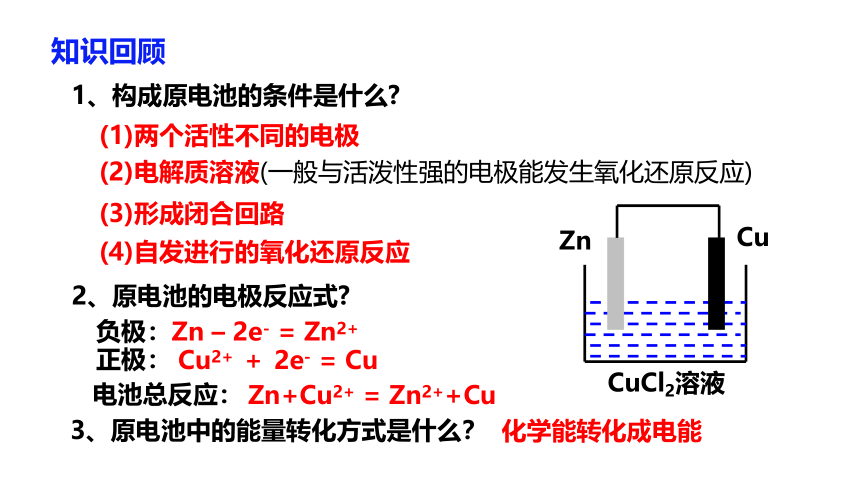
(1)两个活性不同的电极
(2)电解质溶液(一般与活泼性强的电极能发生氧化还原反应)
(3)形成闭合回路
(4)自发进行的氧化还原反应
1、构成原电池的条件是什么
负极:
正极:
电池总反应:
Zn – 2e- = Zn2+
Cu2+ + 2e- = Cu
Zn+Cu2+ = Zn2++Cu
2、原电池的电极反应式
3、原电池中的能量转化方式是什么?
化学能转化成电能
知识回顾
如果把两根石墨棒作电极插入CuCl2 溶液中,外接直流电源时,电能能能转化成化学能吗?
实验现象 实验结论
与直流电源负极相连的石墨棒上逐渐覆盖了一层红色物质
与直流电源正极相连的石墨棒上有气泡产生,气体能使湿润的碘化钾淀粉试纸变蓝
结论:实验表明,CuCl2溶液在通电条件下生成了Cu和Cl2
析出金属铜
产生了氯气
一、电解CuCl2溶液
1.实验探究
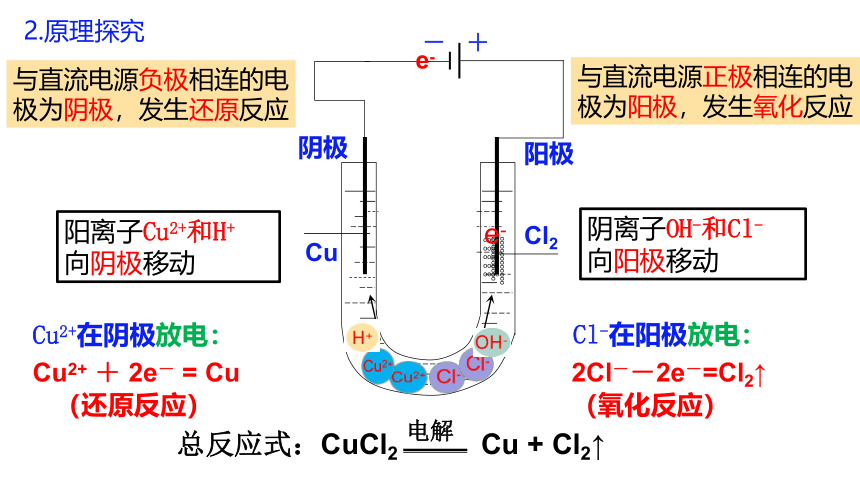
2.原理探究
与直流电源负极相连的电极为阴极,发生还原反应
与直流电源正极相连的电极为阳极,发生氧化反应
阳离子Cu2+和H+
向阴极移动
阴离子OH-和Cl-
向阳极移动
Cu2+在阴极放电:
Cl-在阳极放电:
2Cl--2e-=Cl2↑
(氧化反应)
Cu2+ + 2e- = Cu
(还原反应)
总反应式:CuCl2 Cu + Cl2↑
电解
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
深度思考:
1.在电解CuCl2溶液的过程中,闭合回路是如何形成的?
2.在氯化铜溶液中除了Cu2+和Cl-之外还有H+和OH-,这两种离子为什么没有得到或失去电子?
阳离子 阴极
阴离子 阳极
e-
溶液中离子定向移动
负极 阴极 阳极 正极
e-
电极名称_______
反应类型_______
电极反应______ _
实验现象_______
电极名称_______
反应类型_______
电极反应_______
实验现象_______
阴极
阳极
氧化
还原
氯化铜溶液
C
C
Cu2++2e-=Cu
红色固体
2Cl--2e-=Cl2↑
黄绿气体
你记住了吗?
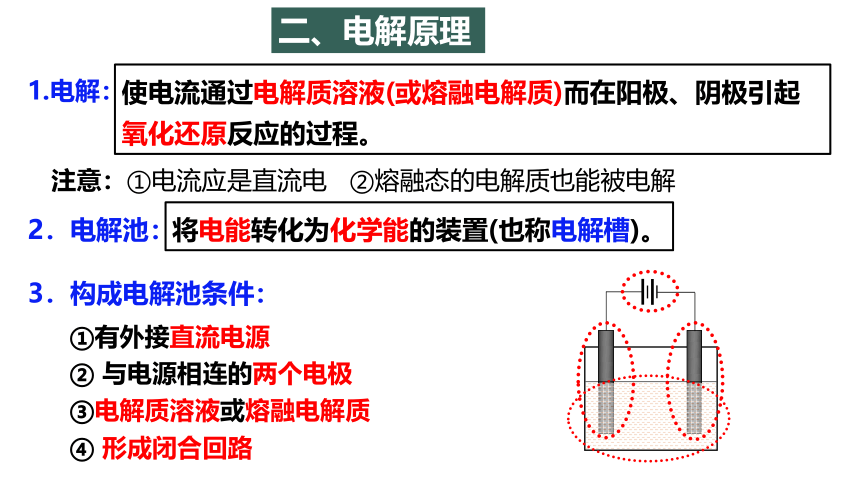
1.电解:
二、电解原理
注意:①电流应是直流电 ②熔融态的电解质也能被电解
2.电解池:
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起
氧化还原反应的过程。
将电能转化为化学能的装置(也称电解槽)。
3.构成电解池条件:
①有外接直流电源
② 与电源相连的两个电极
③电解质溶液或熔融电解质
④ 形成闭合回路
4.电解池的工作原理
电极 阳极 与电源_______相连,发生_______反应
阴极 与电源_______相连,发生_______反应 离子流向 阴离子移向______;阳离子移向______ 电子流向 电源____极流向电解池____极 电解池____极流向电源____极 电流流向
正极
氧化
负极
还原
阳极
阴极
负
阴
阳
正
(注:电子只在外电路定向移动,不能从溶液中移动)
正极→ 极,阴极→ 极
阳
负
【练1】下列说法错误的是( )
A、由电能转化为化学能的装置叫电解池
B、在电解池中跟直流电源的正极相连的电极是电解池的阳极
C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极
D、电解池中阴极发生还原反应,阳极发生氧化反应
C
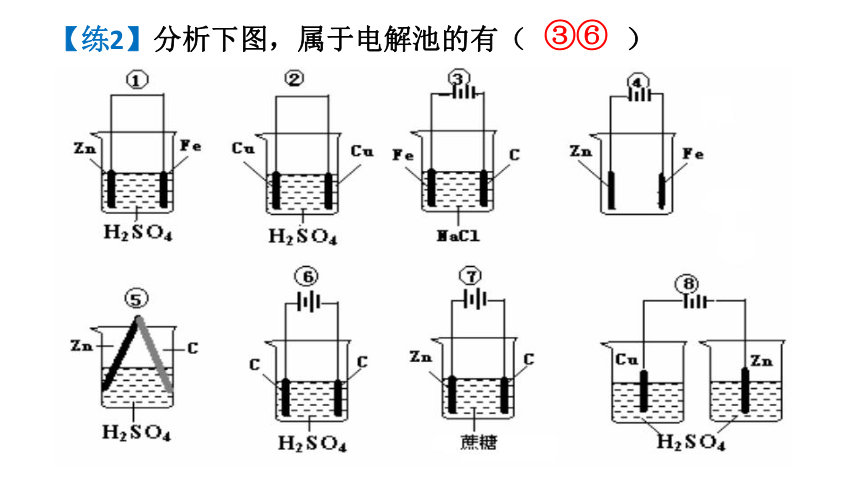
【练2】分析下图,属于电解池的有( )
③⑥
5.电解池阴、阳极判断方法
①正极→ ,负极 → 。
②电子流出→ ,电子流入→ 。
③阴离子→ ,阳离子→ 。
④氧化反应→ ,还原反应→ 。
⑤电极溶解或析出O2、Cl2→ ,析出金属或放出H2→ 。
⑥电解中性溶液,电极附近溶液使酚酞变红→ 。
阳极
阳极
阳极
阳极
阳极
阴极
阴极
阴极
阴极
阴极
阴极
【练3】下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极、b为正极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
C
阳极 阴极
+ -
4.阴、阳极放电顺序(即失或得电子的顺序)
①阳极放电顺序
阳极
活性电极
(除Pt、Au外的金属)
惰性电极
(Pt、Au、石墨等)
电极材料失电子溶解
溶液中阴离子按放电顺序失电子
阳极产物:
Mn+或非金属单质
活性阳极 >S 2- >SO32- >I- >Br- >Cl- >OH- >NO3- >SO42-(氧酸根) >F-
放电能力(还原性)减弱
在溶液中只考虑此部分
②阴极放电顺序
阴极上总是溶液(或熔融电解质)中的阳离子放电,与电极材料无关。
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)
>Al3+>Mg2+>Na+>Ca2+>K+
阴极
直接按阳离子放电顺序的电子
阴极产物:金属M或H2
放电能力(氧化性)减弱
水溶液中多考虑此部分
浓度很大时,先于H+放电
熔融状态下才放电
注意:金属离子放电通常生成相应金属,Fe3+则生成Fe2+。
【练4】右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
【练5】如图所示为用惰性电极电解CuCl2溶液的实验装置,则下列说法正确的是( )
A. a电极为负极
B. 溶液中的Cu2+向a极移动
C. 通电一段时间后溶液的颜色会变浅
D. 电极b上发生的电极反应式为2Cl- - 2e-=Cl2↑
A
c
5.电解类型及规律(用惰性电极电解时)
阳极
阴极
氧气
氢
气
KNO3溶液
①电解水型:
含氧酸(H2SO4)
可溶性强碱(NaOH)
活泼金属含氧酸盐(KNO3)
电解对象 电解质浓度
H2SO4
NaOH
KNO3
4H ++ 4e- = 2H2 ↑
4OH- - 4e- =2H2O+O2 ↑
电极反应特点
实例
复原
pH
水
浓度增大(饱和溶液除外)
加H2O
↓
↑
不变
总:2H2O 2H2 ↑ + O2 ↑
电解
阴极:
阳极:
②电解电解质型:
无氧酸(HCl)
不活泼金属无氧酸盐(CuCl2)
电解对象 电解质浓度
阴极: 阳极: 总:
阴极: 阳极: 总:
电极反应特点
实例
复原
pH
HCl
CuCl2
2H+ +2e- =H2↑
2Cl- -2e- = Cl2↑
2HCl ==== H2↑+ Cl2↑
电解
Cu2++2e- = Cu
2Cl- - 2e- = Cl2↑
CuCl2 ==== Cu + Cl2↑
电解
HCl
CuCl2
减小
通HCl
加CuCl2
↑
③放H2生碱型:
活泼金属无氧酸盐
(NaCl、K2S)
电解对象 电解质浓度
阴极: 阳极: 总:
电极反应特点
实例
复原
pH
水和NaCl
生成新电解质
通HCl
↑
阳极
阴极
氯气
氢
气
NaCl溶液
NaCl
2H2O+2e- = H2↑+2OH-
2Cl- - 2e- = Cl2↑
2NaCl + 2H2O ==== 2NaOH + H2↑+ Cl2↑
电解
④放O2生酸型:
不活泼金属含氧酸盐
(CuSO4、AgNO3)
电解对象 电解质浓度
阴极: 阳极: 总:
电极反应特点
实例
复原
pH
水和CuSO4
生成新电解质
加CuO或CuCO3
↓
CuSO4
阳极
阴极
氧
气
铜
CuSO4溶液
2Cu2++4e- =2Cu
2H2O- 4e- = O2↑+4H+
2CuSO4 + 2H2O === 2Cu + 2H2SO4 + O2↑
电解
【练7】下图所示装置中a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法正确的是(双选)( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
a
X Y
b
Pt
Cu
CuSO4溶液
NaCl和酚酞溶液
A C
【练6】用石墨电极电解硫酸铜溶液,一段时间后断开电路,要使溶液恢复到电解前的浓度应向其中加入( )
A.CuSO4 B.H2O C.CuO D.Cu(OH)2
C
【练8】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
(1)甲池是 装置,乙池中SO42- 移向 电极(填“石墨”或“Ag”)
通入O2的电极上的反应式为: 。
(2)当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化 mol,乙池若要恢复电解前的状态则需要加入 (填物质化学式及质量)。
(3)丙池中发生的电解反应的离子方程式为: 。
原电池
石墨
O2+ 4e- +2H2O= 4OH-
1.5
240gCuO
6.电解池中电极反应的书写
1.先判断电极材料
2.找全阴、阳离子
3.根据放电顺序写出电极反应式
4.阴、阳两极相加得总反应式,
条件写电解
(弱电解质写化学式)
C
C
H+
OH-
【练 9】(2021·宁夏·银川市第六中学高二月考)用情性电极电解下列溶液
(1)电解KNO3溶液阳极反应___________
(2)电解CuCl2溶液阴极反应___________
(3)电解氢氧化钠溶液的总反应___________
(4)电解CuSO4与NaCl混合溶液开始时阳极反应___________,阴极反应__ _________
【练10】1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时。下列判断(设电解按理论进行,溶液不蒸发)正确的是( )
A.溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标准状况)
C.转移的电子数是1.204×1022个
D.反应中有0.01mol的Ag被氧化
C
归纳总结
1.关于如图所示装置的叙述正确的是( )
A.甲、乙装置中的锌片都作负极
B.甲、乙装置中的溶液内的H+在铜片被还原
C.甲、乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片有气泡生成,乙装置中的铜片质量减小
D
2.如图所示的装置分别通电一段时间后,溶液的质量增加的是( )
3.用惰性电极电解某pH=a的电解质溶液,一段时间后,溶液的pH<a,则该电解质为( )
A.NaOH B.KI C.Na2SO4 D.AgNO3
A.稀H2 SO4 B.CuCl2 溶液 C.CuSO4 溶液 D.Cu(NO3 ) 2 溶液
D
D
4.某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
根据实验现象,下列说法正确的是( )
A. ①②中,阴极的电极反应式:3H2O 4e ═O2↑+4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32 有关
D
5.某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题所示。下列有关说法正确的是( )
A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为 4CO32-+2H2O- 4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
C
6.用石墨作电极电解1000mL 0.1mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4g。下列有关叙述正确的是(NA代表阿伏伽德罗常数)( )
A.电解过程中流经外电路的电子个数为0.1NA
B.在标准状况下,两极共产生3.92L气体
C.电解后溶液中H+浓度为0.01mol/L(溶液体积不变)
D.加入13.8g Ag2CO3可将溶液彻底复原
B
7. 25℃时,用石墨电极电解2.0L 0.5mol/L CuSO4溶液。5min后,在一个石墨电极上有6.4gCu生成。
试回答下列问题:
(1)发生氧化反应的是 极,电极反应为 。
(2)若电解后溶液的体积不变,则电解后溶液的pH为 。
(3)若将溶液恢复到与电解前一样,则需加入 mol的 。
(4)若用等质量的两块铜片代替石墨作电极,当析出6.4Cu时,两铜片的质量相差 g,电解液的pH (填“变小”、“变大”或“不变”)。
阳
2H2O-4e-=O2↑+4H+
1
0.1
CuO
12.8
不变
第1课时 电解原理
第二节 电解池
第四章 化学反应与电能
Zn
Cu
CuCl2溶液
(1)两个活性不同的电极
(2)电解质溶液(一般与活泼性强的电极能发生氧化还原反应)
(3)形成闭合回路
(4)自发进行的氧化还原反应
1、构成原电池的条件是什么
负极:
正极:
电池总反应:
Zn – 2e- = Zn2+
Cu2+ + 2e- = Cu
Zn+Cu2+ = Zn2++Cu
2、原电池的电极反应式
3、原电池中的能量转化方式是什么?
化学能转化成电能
知识回顾
如果把两根石墨棒作电极插入CuCl2 溶液中,外接直流电源时,电能能能转化成化学能吗?
实验现象 实验结论
与直流电源负极相连的石墨棒上逐渐覆盖了一层红色物质
与直流电源正极相连的石墨棒上有气泡产生,气体能使湿润的碘化钾淀粉试纸变蓝
结论:实验表明,CuCl2溶液在通电条件下生成了Cu和Cl2
析出金属铜
产生了氯气
一、电解CuCl2溶液
1.实验探究
2.原理探究
与直流电源负极相连的电极为阴极,发生还原反应
与直流电源正极相连的电极为阳极,发生氧化反应
阳离子Cu2+和H+
向阴极移动
阴离子OH-和Cl-
向阳极移动
Cu2+在阴极放电:
Cl-在阳极放电:
2Cl--2e-=Cl2↑
(氧化反应)
Cu2+ + 2e- = Cu
(还原反应)
总反应式:CuCl2 Cu + Cl2↑
电解
oooooooooooooooooooo
- +
阴极
阳极
Cu
Cl2
ooooooooooooooooooooooo
e-
e-
深度思考:
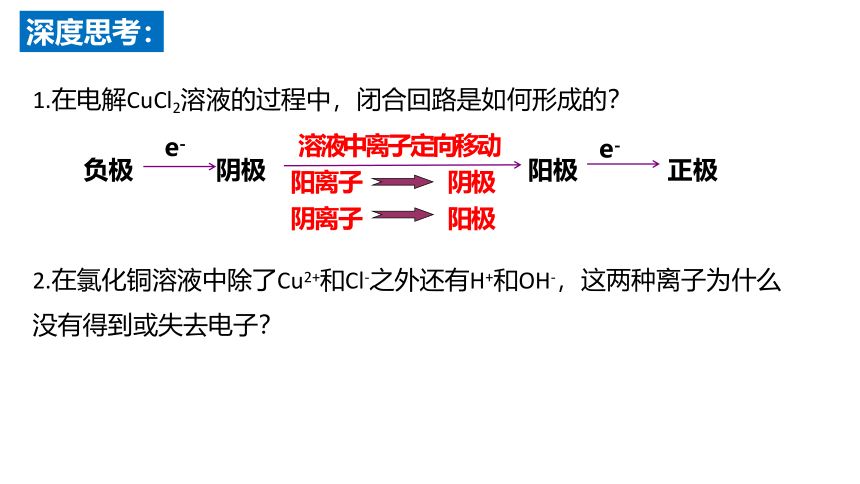
1.在电解CuCl2溶液的过程中,闭合回路是如何形成的?
2.在氯化铜溶液中除了Cu2+和Cl-之外还有H+和OH-,这两种离子为什么没有得到或失去电子?
阳离子 阴极
阴离子 阳极
e-
溶液中离子定向移动
负极 阴极 阳极 正极
e-
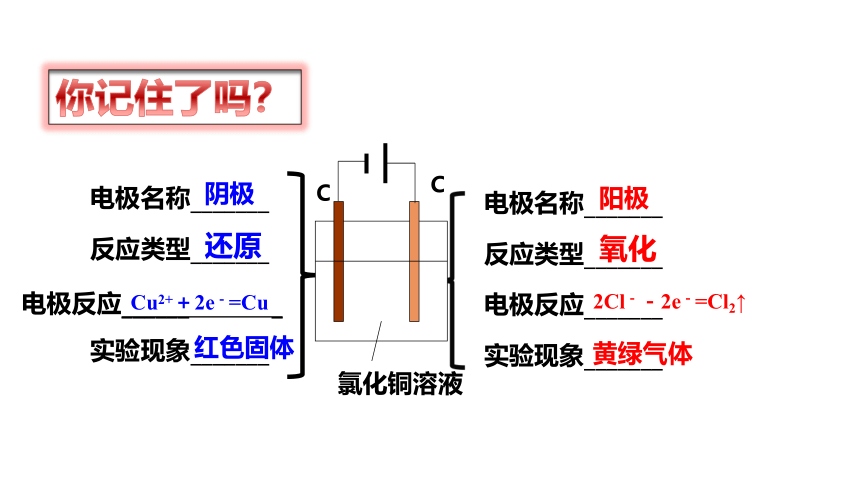
电极名称_______
反应类型_______
电极反应______ _
实验现象_______
电极名称_______
反应类型_______
电极反应_______
实验现象_______
阴极
阳极
氧化
还原
氯化铜溶液
C
C
Cu2++2e-=Cu
红色固体
2Cl--2e-=Cl2↑
黄绿气体
你记住了吗?
1.电解:
二、电解原理
注意:①电流应是直流电 ②熔融态的电解质也能被电解
2.电解池:
使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起
氧化还原反应的过程。
将电能转化为化学能的装置(也称电解槽)。
3.构成电解池条件:
①有外接直流电源
② 与电源相连的两个电极
③电解质溶液或熔融电解质
④ 形成闭合回路
4.电解池的工作原理
电极 阳极 与电源_______相连,发生_______反应
阴极 与电源_______相连,发生_______反应 离子流向 阴离子移向______;阳离子移向______ 电子流向 电源____极流向电解池____极 电解池____极流向电源____极 电流流向
正极
氧化
负极
还原
阳极
阴极
负
阴
阳
正
(注:电子只在外电路定向移动,不能从溶液中移动)
正极→ 极,阴极→ 极
阳
负
【练1】下列说法错误的是( )
A、由电能转化为化学能的装置叫电解池
B、在电解池中跟直流电源的正极相连的电极是电解池的阳极
C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极
D、电解池中阴极发生还原反应,阳极发生氧化反应
C
【练2】分析下图,属于电解池的有( )
③⑥
5.电解池阴、阳极判断方法
①正极→ ,负极 → 。
②电子流出→ ,电子流入→ 。
③阴离子→ ,阳离子→ 。
④氧化反应→ ,还原反应→ 。
⑤电极溶解或析出O2、Cl2→ ,析出金属或放出H2→ 。
⑥电解中性溶液,电极附近溶液使酚酞变红→ 。
阳极
阳极
阳极
阳极
阳极
阴极
阴极
阴极
阴极
阴极
阴极
【练3】下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A、a为负极、b为正极
B、a为阳极、b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
C
阳极 阴极
+ -
4.阴、阳极放电顺序(即失或得电子的顺序)
①阳极放电顺序
阳极
活性电极
(除Pt、Au外的金属)
惰性电极
(Pt、Au、石墨等)
电极材料失电子溶解
溶液中阴离子按放电顺序失电子
阳极产物:
Mn+或非金属单质
活性阳极 >S 2- >SO32- >I- >Br- >Cl- >OH- >NO3- >SO42-(氧酸根) >F-
放电能力(还原性)减弱
在溶液中只考虑此部分
②阴极放电顺序
阴极上总是溶液(或熔融电解质)中的阳离子放电,与电极材料无关。
Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)
>Al3+>Mg2+>Na+>Ca2+>K+
阴极
直接按阳离子放电顺序的电子
阴极产物:金属M或H2
放电能力(氧化性)减弱
水溶液中多考虑此部分
浓度很大时,先于H+放电
熔融状态下才放电
注意:金属离子放电通常生成相应金属,Fe3+则生成Fe2+。
【练4】右图为直流电源电解稀Na2SO4溶液的装置。通电一段时间后,在石墨电极a和b附近分别滴加一滴酚酞溶液。则下列有关说法中正确的是( )
A.a电极产生H2
B.两极产生的气体均有刺激性气味
C.通电一段时间后,稀Na2SO4溶液酸性增强
D.a电极附近呈无色,b电极附近呈红色
【练5】如图所示为用惰性电极电解CuCl2溶液的实验装置,则下列说法正确的是( )
A. a电极为负极
B. 溶液中的Cu2+向a极移动
C. 通电一段时间后溶液的颜色会变浅
D. 电极b上发生的电极反应式为2Cl- - 2e-=Cl2↑
A
c
5.电解类型及规律(用惰性电极电解时)
阳极
阴极
氧气
氢
气
KNO3溶液
①电解水型:
含氧酸(H2SO4)
可溶性强碱(NaOH)
活泼金属含氧酸盐(KNO3)
电解对象 电解质浓度
H2SO4
NaOH
KNO3
4H ++ 4e- = 2H2 ↑
4OH- - 4e- =2H2O+O2 ↑
电极反应特点
实例
复原
pH
水
浓度增大(饱和溶液除外)
加H2O
↓
↑
不变
总:2H2O 2H2 ↑ + O2 ↑
电解
阴极:
阳极:
②电解电解质型:
无氧酸(HCl)
不活泼金属无氧酸盐(CuCl2)
电解对象 电解质浓度
阴极: 阳极: 总:
阴极: 阳极: 总:
电极反应特点
实例
复原
pH
HCl
CuCl2
2H+ +2e- =H2↑
2Cl- -2e- = Cl2↑
2HCl ==== H2↑+ Cl2↑
电解
Cu2++2e- = Cu
2Cl- - 2e- = Cl2↑
CuCl2 ==== Cu + Cl2↑
电解
HCl
CuCl2
减小
通HCl
加CuCl2
↑
③放H2生碱型:
活泼金属无氧酸盐
(NaCl、K2S)
电解对象 电解质浓度
阴极: 阳极: 总:
电极反应特点
实例
复原
pH
水和NaCl
生成新电解质
通HCl
↑
阳极
阴极
氯气
氢
气
NaCl溶液
NaCl
2H2O+2e- = H2↑+2OH-
2Cl- - 2e- = Cl2↑
2NaCl + 2H2O ==== 2NaOH + H2↑+ Cl2↑
电解
④放O2生酸型:
不活泼金属含氧酸盐
(CuSO4、AgNO3)
电解对象 电解质浓度
阴极: 阳极: 总:
电极反应特点
实例
复原
pH
水和CuSO4
生成新电解质
加CuO或CuCO3
↓
CuSO4
阳极
阴极
氧
气
铜
CuSO4溶液
2Cu2++4e- =2Cu
2H2O- 4e- = O2↑+4H+
2CuSO4 + 2H2O === 2Cu + 2H2SO4 + O2↑
电解
【练7】下图所示装置中a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,下列说法正确的是(双选)( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
a
X Y
b
Pt
Cu
CuSO4溶液
NaCl和酚酞溶液
A C
【练6】用石墨电极电解硫酸铜溶液,一段时间后断开电路,要使溶液恢复到电解前的浓度应向其中加入( )
A.CuSO4 B.H2O C.CuO D.Cu(OH)2
C
【练8】能源是人类生存和发展的重要支柱,化学在能源的开发与利用方面起着十分重要的作用。某学习小组按如下图所示装置探究化学能与电能的相互转化:
(1)甲池是 装置,乙池中SO42- 移向 电极(填“石墨”或“Ag”)
通入O2的电极上的反应式为: 。
(2)当甲池消耗标况下33.6LO2时,电解质KOH的物质的量变化 mol,乙池若要恢复电解前的状态则需要加入 (填物质化学式及质量)。
(3)丙池中发生的电解反应的离子方程式为: 。
原电池
石墨
O2+ 4e- +2H2O= 4OH-
1.5
240gCuO
6.电解池中电极反应的书写
1.先判断电极材料
2.找全阴、阳离子
3.根据放电顺序写出电极反应式
4.阴、阳两极相加得总反应式,
条件写电解
(弱电解质写化学式)
C
C
H+
OH-
【练 9】(2021·宁夏·银川市第六中学高二月考)用情性电极电解下列溶液
(1)电解KNO3溶液阳极反应___________
(2)电解CuCl2溶液阴极反应___________
(3)电解氢氧化钠溶液的总反应___________
(4)电解CuSO4与NaCl混合溶液开始时阳极反应___________,阴极反应__ _________
【练10】1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时。下列判断(设电解按理论进行,溶液不蒸发)正确的是( )
A.溶液的浓度变为0.08mol/L
B.阳极上产生112mLO2(标准状况)
C.转移的电子数是1.204×1022个
D.反应中有0.01mol的Ag被氧化
C
归纳总结
1.关于如图所示装置的叙述正确的是( )
A.甲、乙装置中的锌片都作负极
B.甲、乙装置中的溶液内的H+在铜片被还原
C.甲、乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片有气泡生成,乙装置中的铜片质量减小
D
2.如图所示的装置分别通电一段时间后,溶液的质量增加的是( )
3.用惰性电极电解某pH=a的电解质溶液,一段时间后,溶液的pH<a,则该电解质为( )
A.NaOH B.KI C.Na2SO4 D.AgNO3
A.稀H2 SO4 B.CuCl2 溶液 C.CuSO4 溶液 D.Cu(NO3 ) 2 溶液
D
D
4.某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
根据实验现象,下列说法正确的是( )
A. ①②中,阴极的电极反应式:3H2O 4e ═O2↑+4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32 有关
D
5.某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如题所示。下列有关说法正确的是( )
A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为 4CO32-+2H2O- 4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
C
6.用石墨作电极电解1000mL 0.1mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4g。下列有关叙述正确的是(NA代表阿伏伽德罗常数)( )
A.电解过程中流经外电路的电子个数为0.1NA
B.在标准状况下,两极共产生3.92L气体
C.电解后溶液中H+浓度为0.01mol/L(溶液体积不变)
D.加入13.8g Ag2CO3可将溶液彻底复原
B
7. 25℃时,用石墨电极电解2.0L 0.5mol/L CuSO4溶液。5min后,在一个石墨电极上有6.4gCu生成。
试回答下列问题:
(1)发生氧化反应的是 极,电极反应为 。
(2)若电解后溶液的体积不变,则电解后溶液的pH为 。
(3)若将溶液恢复到与电解前一样,则需加入 mol的 。
(4)若用等质量的两块铜片代替石墨作电极,当析出6.4Cu时,两铜片的质量相差 g,电解液的pH (填“变小”、“变大”或“不变”)。
阳
2H2O-4e-=O2↑+4H+
1
0.1
CuO
12.8
不变
