4.3.1 金属的腐蚀(共22张PPT).pptx
文档属性
| 名称 | 4.3.1 金属的腐蚀(共22张PPT).pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-16 21:36:09 | ||
图片预览






文档简介
(共22张PPT)
第三节 金属的腐蚀与防护
——《青花瓷》方文山
金属腐蚀现象普遍
金属腐蚀危害严重
坍塌
不美观
管道泄露
船体损坏
仪器灵敏度降低
金属腐蚀
我国作为世界上钢铁产量最多的国家(2005年全国生产钢材37117.02万吨) ,每年被腐蚀的铁占到我国钢铁年产量的十分之一,因金属腐蚀而造成的损失占到国内生产总值的2%~4%;
据一份统计报告,全世界每年由于腐蚀而报废的金属设备和材料,约相当于金属年产量的1/3。在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。因此,了解金属腐蚀的原因,并采取有效措施防止金属腐蚀具有重要的意义。
阅读:
2. 实质:
1. 概念
一、金属腐蚀
指金属或合金与周围接触到的 或 发生 反应而
腐蚀损耗的过程。
是金属本身失去电子变成 的过程(发生______反应)。
M - ne- = Mn+
气体
液体
氧化还原
阳离子
氧化
铁发生腐蚀时,产物是Fe2+
3.金属腐蚀的分类——根据与金属接触的介质不同分
分类 化学腐蚀 电化学腐蚀
条件
现象
本质
影响因素
联系 金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应
不纯的金属或合金与电解质溶液接触,形成原电池
无电流产生
有微弱电流产生
金属被氧化
较活泼的金属被氧化
化学腐蚀和电化学腐蚀往往同时发生,但电化学腐蚀更普遍,速率更快
与氧化剂的氧化性及温度等有关
与电解质溶液的酸碱性及金属活动性等有关
(主)
升温可加快金属腐蚀
化学腐蚀:
家用燃气灶的中心部位很容易生锈
食品罐头放在南极80多年了,却很少生锈
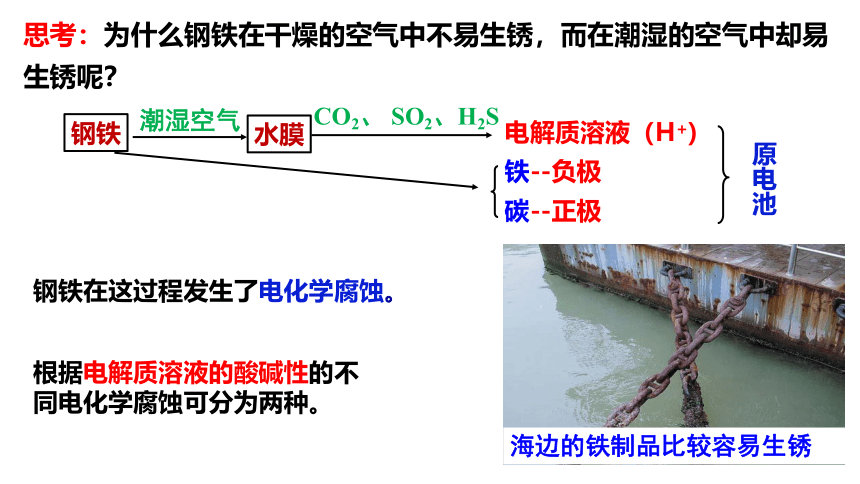
思考:为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?
钢铁在这过程发生了电化学腐蚀。
根据电解质溶液的酸碱性的不同电化学腐蚀可分为两种。
钢铁
潮湿空气
水膜
CO2、 SO2、H2S
电解质溶液(H+)
铁--负极
碳--正极
原电池
海边的铁制品比较容易生锈
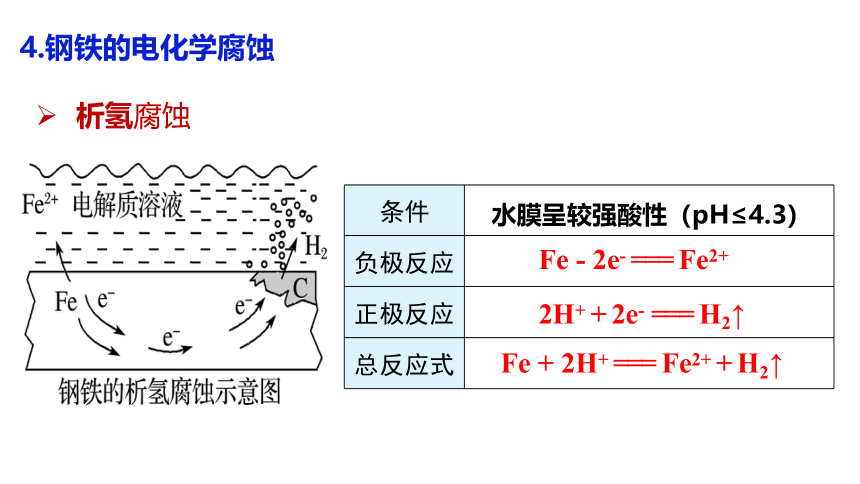
4.钢铁的电化学腐蚀
析氢腐蚀
条件
负极反应
正极反应
总反应式
水膜呈较强酸性(pH≤4.3)
Fe - 2e- === Fe2+
2H+ + 2e- === H2↑
Fe + 2H+ === Fe2+ + H2↑
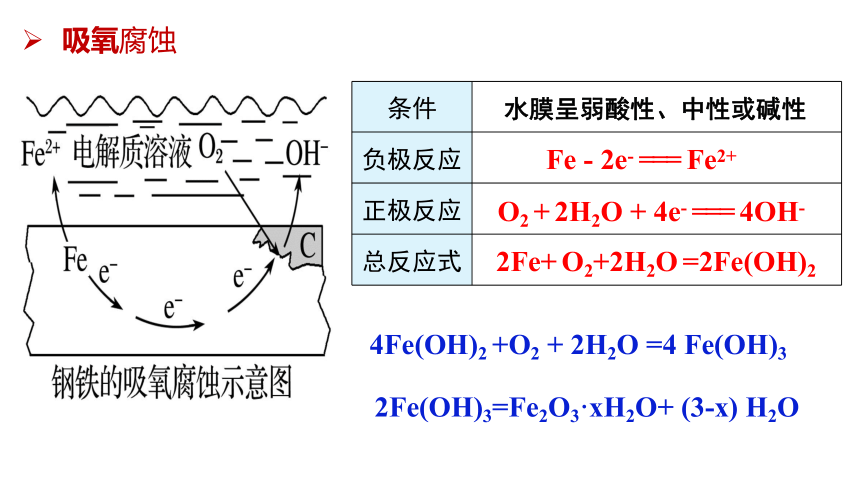
吸氧腐蚀
条件
负极反应
正极反应
总反应式
水膜呈弱酸性、中性或碱性
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe+ O2+2H2O =2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+ (3-x) H2O
联系:
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
注意:
电化学腐蚀中,只有金属活动性顺序位于H前面的金属才可能发生析氢腐蚀,位于H之后的金属只能发生吸氧腐蚀,吸氧腐蚀是金属腐蚀的主要形式。
金属腐蚀快慢的判断 :(学法p154)
①在同一电解质溶液中:
②同一种金属的腐蚀:
电解原理腐蚀>原电池原理腐蚀>化学腐蚀>有防腐措施的腐蚀
强电解质>弱电解质>非电解质
下列各情况下,其中Fe片腐蚀由快到慢的顺序是 。
(5)(2)(1)(3)(4)
注意:原电池正极、电解池阴极受到保护。
随堂练习
思考:
1.纯银器表面变黑和钢铁表面生锈腐蚀原理一样吗?
2.用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,这种腐蚀属于 ,反应的化学方程式为 。
3.若用铝制饭盒盛放食盐(含水时),一段时间后,饭盒被腐蚀,这种腐蚀属于 ,反应原理是(写电极反应式和总反应式):
。
化学腐蚀
电化学腐蚀
化学腐蚀
2Al+6CH3COOH=2(CH3COO)3Al+3H2↑
电化学腐蚀
实验4-3
现象:
(1)导管中水面_______,形成一段________。
在中性条件下,铁钉发生吸氧腐蚀,消耗具支试管中的氧气,使具支试管内气压减小,水被压入导管形成水柱。
上升
水柱
(2)加入CuSO4溶液的试管生成H2的速率______。
加快
被Zn置换出来的Cu与Zn、稀盐酸构成很多微小的原电池,发生原电池反应,使生成H2的速率加快。
你能说出下列金属防护方法么
二、金属的防护
1.改变金属材料的组成
在金属中添加其他金属或非金属可以制成生能优异的合金。
如:①把铬、镍加入普通钢中制成不锈钢产品;②钛合金不仅具有优异的抗腐蚀性,不具有良好的生物相溶性。
2.在金属表面覆盖保护层
在金属表面覆盖致密的保护层,将金属物品与周围物质隔开是一种普遍采用的防护方法。
如:①在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷等;②用电镀等方法在钢铁表面镀上一层锌、锡、铬、镍等金属;③用化学方法在钢铁部件表面进行发蓝处理(烤蓝,生成一层致密的四氧化三铁薄膜);④利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化等。⑤采用离子注入、表面渗透镀等方式在金属表面也可以形成稳定的钝化膜等。
3.电化学保护法
牺牲阳极保护法
原理 ________原理
电极 要求 被保护的金属作______极,
活泼性更强的金属作______极
应用
原电池
正
负
锅炉内壁、船舶外壳安装镁合金或锌块
用牺牲锌块的方法来保护船身,锌块必须定期更换
用牺牲锌板的方法来保护钢闸门,锌板必须定期更换
实验4-4
实验装置 电流表 阳极(-) 阴极(+)
现象
有关反应
(1) 现象:
偏转
溶解
无明显现象
验证牺牲阳极法实验(1)
Zn-2e-=Zn2+
锌片、铁片酸化的氯化钠溶液构成原电池,锌为阳极(负极)失电子,被腐蚀,
铁为阴极(正极)被保护。
结论:
Fe2+的检验:
Fe2++K3[Fe(CN)6]=KFe [Fe(CN)6]↓+2K+
蓝色沉淀
黄色溶液
2H++2e=H2↑
赤血盐固体
验证牺牲阳极法实验(2)
(2) 现象:
缠有锌片的铁钉周周围只出现红色,缠有铜片的铁钉铜片周围出现红色,
同时铁钉周围出现蓝色沉淀。
Zn-2e-=Zn2+
O2 + 2H2O + 4e-= 4OH-
锌片(阳极):
铁钉(阴极):
铜片(阴极):
铁钉(阳极):
Fe-2e-=Fe2+
O2 + 2H2O + 4e-= 4OH-
结论:不同金属构成原电池发生电化学腐蚀时,较活泼金属的被腐蚀,相对不活泼的金属被保护。
锌被腐蚀,铁被保护
铁被腐蚀,铜被保护
外加电流法
原理 ________原理
电极 要求 被保护的金属作为_____极,
与电源的____极相连
应用
电解池
阴
负
钢铁闸门,地下管道连接电源负极
牺牲阳极法:
外加电流法:
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,本身不被腐蚀)
相同
一般而言,外加电流法比牺牲阳极法保护效果更好。
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的负极
同一金属在相同电解质溶液中,腐蚀快慢如下:
三、金属腐蚀快慢规律
知识总结
第三节 金属的腐蚀与防护
——《青花瓷》方文山
金属腐蚀现象普遍
金属腐蚀危害严重
坍塌
不美观
管道泄露
船体损坏
仪器灵敏度降低
金属腐蚀
我国作为世界上钢铁产量最多的国家(2005年全国生产钢材37117.02万吨) ,每年被腐蚀的铁占到我国钢铁年产量的十分之一,因金属腐蚀而造成的损失占到国内生产总值的2%~4%;
据一份统计报告,全世界每年由于腐蚀而报废的金属设备和材料,约相当于金属年产量的1/3。在这里还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。因此,了解金属腐蚀的原因,并采取有效措施防止金属腐蚀具有重要的意义。
阅读:
2. 实质:
1. 概念
一、金属腐蚀
指金属或合金与周围接触到的 或 发生 反应而
腐蚀损耗的过程。
是金属本身失去电子变成 的过程(发生______反应)。
M - ne- = Mn+
气体
液体
氧化还原
阳离子
氧化
铁发生腐蚀时,产物是Fe2+
3.金属腐蚀的分类——根据与金属接触的介质不同分
分类 化学腐蚀 电化学腐蚀
条件
现象
本质
影响因素
联系 金属与其表面接触的一些物质(如O2、Cl2、SO2等)直接反应
不纯的金属或合金与电解质溶液接触,形成原电池
无电流产生
有微弱电流产生
金属被氧化
较活泼的金属被氧化
化学腐蚀和电化学腐蚀往往同时发生,但电化学腐蚀更普遍,速率更快
与氧化剂的氧化性及温度等有关
与电解质溶液的酸碱性及金属活动性等有关
(主)
升温可加快金属腐蚀
化学腐蚀:
家用燃气灶的中心部位很容易生锈
食品罐头放在南极80多年了,却很少生锈
思考:为什么钢铁在干燥的空气中不易生锈,而在潮湿的空气中却易生锈呢?
钢铁在这过程发生了电化学腐蚀。
根据电解质溶液的酸碱性的不同电化学腐蚀可分为两种。
钢铁
潮湿空气
水膜
CO2、 SO2、H2S
电解质溶液(H+)
铁--负极
碳--正极
原电池
海边的铁制品比较容易生锈
4.钢铁的电化学腐蚀
析氢腐蚀
条件
负极反应
正极反应
总反应式
水膜呈较强酸性(pH≤4.3)
Fe - 2e- === Fe2+
2H+ + 2e- === H2↑
Fe + 2H+ === Fe2+ + H2↑
吸氧腐蚀
条件
负极反应
正极反应
总反应式
水膜呈弱酸性、中性或碱性
Fe - 2e- === Fe2+
O2 + 2H2O + 4e- === 4OH-
2Fe+ O2+2H2O =2Fe(OH)2
4Fe(OH)2 +O2 + 2H2O =4 Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+ (3-x) H2O
联系:
通常两种腐蚀同时存在,但吸氧腐蚀更普遍
注意:
电化学腐蚀中,只有金属活动性顺序位于H前面的金属才可能发生析氢腐蚀,位于H之后的金属只能发生吸氧腐蚀,吸氧腐蚀是金属腐蚀的主要形式。
金属腐蚀快慢的判断 :(学法p154)
①在同一电解质溶液中:
②同一种金属的腐蚀:
电解原理腐蚀>原电池原理腐蚀>化学腐蚀>有防腐措施的腐蚀
强电解质>弱电解质>非电解质
下列各情况下,其中Fe片腐蚀由快到慢的顺序是 。
(5)(2)(1)(3)(4)
注意:原电池正极、电解池阴极受到保护。
随堂练习
思考:
1.纯银器表面变黑和钢铁表面生锈腐蚀原理一样吗?
2.用铝制饭盒盛放醋酸,一段时间后,饭盒被腐蚀,这种腐蚀属于 ,反应的化学方程式为 。
3.若用铝制饭盒盛放食盐(含水时),一段时间后,饭盒被腐蚀,这种腐蚀属于 ,反应原理是(写电极反应式和总反应式):
。
化学腐蚀
电化学腐蚀
化学腐蚀
2Al+6CH3COOH=2(CH3COO)3Al+3H2↑
电化学腐蚀
实验4-3
现象:
(1)导管中水面_______,形成一段________。
在中性条件下,铁钉发生吸氧腐蚀,消耗具支试管中的氧气,使具支试管内气压减小,水被压入导管形成水柱。
上升
水柱
(2)加入CuSO4溶液的试管生成H2的速率______。
加快
被Zn置换出来的Cu与Zn、稀盐酸构成很多微小的原电池,发生原电池反应,使生成H2的速率加快。
你能说出下列金属防护方法么
二、金属的防护
1.改变金属材料的组成
在金属中添加其他金属或非金属可以制成生能优异的合金。
如:①把铬、镍加入普通钢中制成不锈钢产品;②钛合金不仅具有优异的抗腐蚀性,不具有良好的生物相溶性。
2.在金属表面覆盖保护层
在金属表面覆盖致密的保护层,将金属物品与周围物质隔开是一种普遍采用的防护方法。
如:①在钢铁制品的表面喷涂油漆、矿物性油脂或覆盖搪瓷等;②用电镀等方法在钢铁表面镀上一层锌、锡、铬、镍等金属;③用化学方法在钢铁部件表面进行发蓝处理(烤蓝,生成一层致密的四氧化三铁薄膜);④利用阳极氧化处理铝制品的表面,使之形成致密的氧化膜而钝化等。⑤采用离子注入、表面渗透镀等方式在金属表面也可以形成稳定的钝化膜等。
3.电化学保护法
牺牲阳极保护法
原理 ________原理
电极 要求 被保护的金属作______极,
活泼性更强的金属作______极
应用
原电池
正
负
锅炉内壁、船舶外壳安装镁合金或锌块
用牺牲锌块的方法来保护船身,锌块必须定期更换
用牺牲锌板的方法来保护钢闸门,锌板必须定期更换
实验4-4
实验装置 电流表 阳极(-) 阴极(+)
现象
有关反应
(1) 现象:
偏转
溶解
无明显现象
验证牺牲阳极法实验(1)
Zn-2e-=Zn2+
锌片、铁片酸化的氯化钠溶液构成原电池,锌为阳极(负极)失电子,被腐蚀,
铁为阴极(正极)被保护。
结论:
Fe2+的检验:
Fe2++K3[Fe(CN)6]=KFe [Fe(CN)6]↓+2K+
蓝色沉淀
黄色溶液
2H++2e=H2↑
赤血盐固体
验证牺牲阳极法实验(2)
(2) 现象:
缠有锌片的铁钉周周围只出现红色,缠有铜片的铁钉铜片周围出现红色,
同时铁钉周围出现蓝色沉淀。
Zn-2e-=Zn2+
O2 + 2H2O + 4e-= 4OH-
锌片(阳极):
铁钉(阴极):
铜片(阴极):
铁钉(阳极):
Fe-2e-=Fe2+
O2 + 2H2O + 4e-= 4OH-
结论:不同金属构成原电池发生电化学腐蚀时,较活泼金属的被腐蚀,相对不活泼的金属被保护。
锌被腐蚀,铁被保护
铁被腐蚀,铜被保护
外加电流法
原理 ________原理
电极 要求 被保护的金属作为_____极,
与电源的____极相连
应用
电解池
阴
负
钢铁闸门,地下管道连接电源负极
牺牲阳极法:
外加电流法:
比被保护金属活泼(本身不断被腐蚀)
惰性材料(只起导电作用,本身不被腐蚀)
相同
一般而言,外加电流法比牺牲阳极法保护效果更好。
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的负极
同一金属在相同电解质溶液中,腐蚀快慢如下:
三、金属腐蚀快慢规律
知识总结
