化学苏教版(2019)必修第一册 5.1.1元素周期律课件(共19张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 5.1.1元素周期律课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 32.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-17 12:30:44 | ||
图片预览




文档简介
(共19张PPT)
5.1.1 元素周期律
思考:
1、原子核外电子排布有哪些规律?
2、画出Na、Mg、Al、Si、P、S、Cl原子的原子结构示意图
3、元素化合价与核外电子排布有什么关系?
(1)核外电子总是尽可能先排布在能量的电子层,然后由里及外从能量的电子层逐步向能量的电子层排布。 即 K(1)活泼金属在反应中,一般失去电子,表现正化合价。
(2)活泼非金属在反应中,一般得到电子,表示负化合价。
一、原子序数
1、概念:按照_____由小到大的顺序给元素依次编号,这种编号叫作_____。
思考:根据原子序数的规定方法,该序数与原子组成的哪些粒子数有关系 有什么关系
2、规律:
(1)元素的原子序数在数值上等于该元素原子的____________。
(2)原子序数=__________=__________=_______________
核电荷数
原子序数
核电荷数
核电荷数
质子数
原子的核外电子数
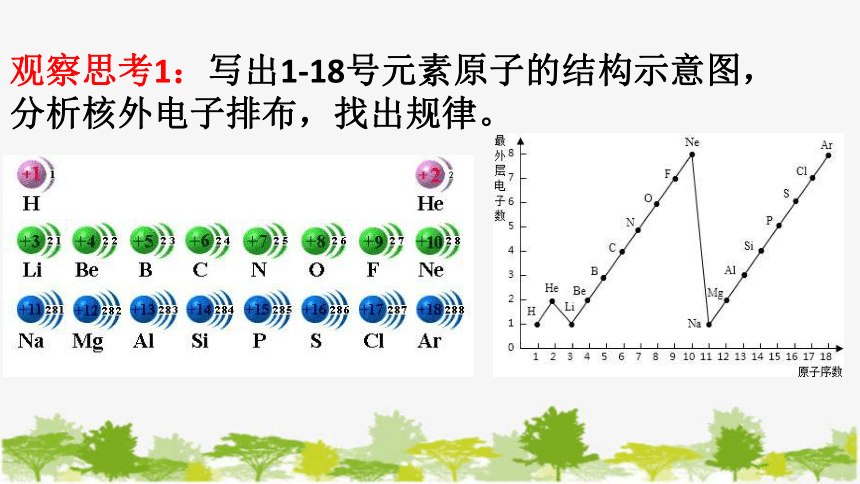
观察思考1:写出1-18号元素原子的结构示意图,分析核外电子排布,找出规律。
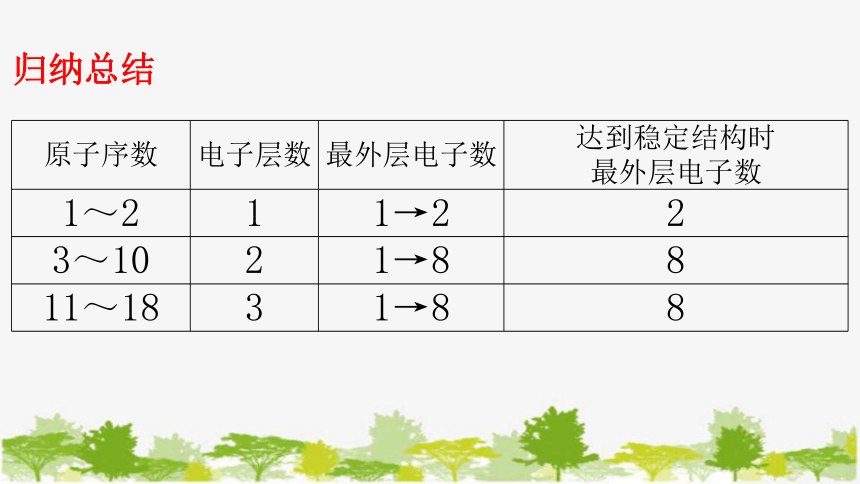
原子序数 电子层数 最外层电子数 达到稳定结构时
最外层电子数
1~2 1 1→2 2
3~10 2 1→8 8
11~18 3 1→8 8
归纳总结
二、元素周期律
(一)原子结构:
1、核外电子排布:随着原子序数的递增,元素原子的核外电子排布呈现周期性变化
规律:
(1)原子电子层数相同时,最外层电子数_____,半径_____
(2)最外层电子数相同时,电子层数________,半径______
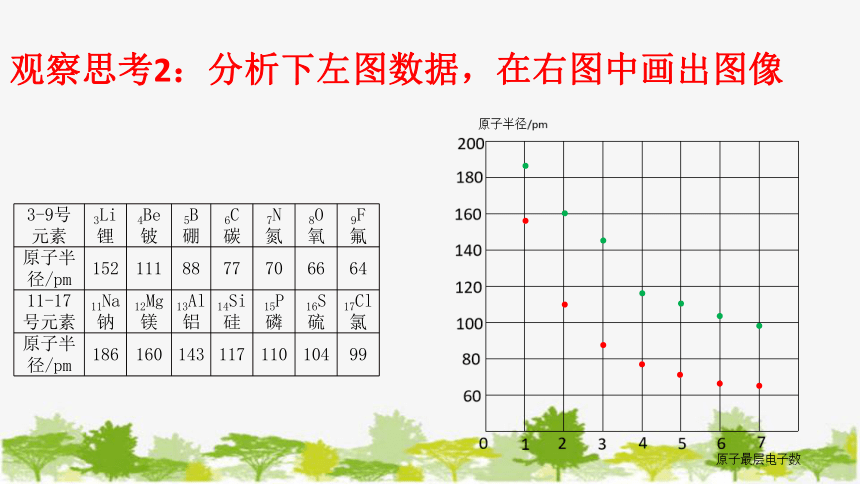
观察思考2:分析下左图数据,在右图中画出图像
3-9号元素 3Li锂 4Be铍 5B硼 6C碳 7N氮 8O氧 9F氟
原子半径/pm 152 111 88 77 70 66 64
11-17号元素 11Na钠 12Mg镁 13Al铝 14Si硅 15P磷 16S硫 17Cl氯
原子半径/pm 186 160 143 117 110 104 99
●
●
●
●
●
●
●
●
●
●
●
●
●
●
2、原子半径:随着原子序数的递增,元素原子半径呈现周期性的变
规律:
(1)原子电子层数相同时,最外层电子数越多,半径越小
(2)最外层电子数相同时,电子层数越多,半径越大
观察思考3:
(1)元素的化合价随着元素原子序数的递增有什么规律性的变化
(2)元素的最高正价与什么有关?元素的最低负价与什么有关?元素的最高正价与最低负价之间有什么联系?
原子序数 化合价的变化
1~2 +1→0
3~10 +1→+5;-4→-1→0
11~18 +1→+7;-4→-1→0
(二)元素性质
1、元素化合价:随着原子序数的递增,元素化合价呈现周期性的变化
规律:
①元素的最高正价=最外层电子数(O、F及稀有气体元素除外)
②元素的负化合价(非金属具有)=8-最外层电子数
③元素的最高化合价与最低化合价绝对值之和=8
观察思考4:钠、镁、铝的金属性有什么变化规律?
性 质 Na Mg Al
单质与水(或酸)的反应情况 与冷水剧烈反应 与冷水缓慢、与沸水迅速反应,与酸剧烈反应 与酸迅速反应
最高价氧化物对应水化物的碱性强弱 NaOH强碱 Mg(OH)2中强碱 Al(OH)3两性氢氧化物
金属性:随着核电荷数的递增,元素的金属性呈现周期性变化。
分析:钠到铝,原子的最外层电子数依次递增,元素的原子半径依次递减,原子核对最外层电子的引力逐步增强,原子失去最外层电子的能力逐步减弱,所以,元素的金属性依次减弱。
观察思考5:根据下表数据分析元素非金属性强弱规律
3、非金属性:随着核电荷数的递增,元素的非金属性呈现周期性的变化。
分析:从Si、P、S到Cl,原子的最外层电子数依次递增,元素的原子半径依次递减,原子核对最外层电子的引力逐步增强,原子得到电子的能力逐步增强,所以元素的非金属性依次增强。
小结:金属性与非金属性强弱比较:
1、金属性:(1)元素原子失电子能力越强,元素的金属性越强
(2)与水或酸反应越剧烈,金属性越强
(3)最高价氧化物的水化物碱性越强,金属性越强
2、非金属性:
(1)元素原子得电子能力越强,元素的非金属性越强
(2)与氢气反应越容易,非金属性越强
(3)氢态氢化物越稳定,非金属性越强
(4)最高价氧化物的水化物的酸性越强,非金属性越强。
教材118页“观察与思考”:
(1)11-17号元素:
随核电荷数增加,_____逐渐减弱,____逐渐增强;
随核电荷数增加,金属性逐渐_____,非金属性逐渐____。
(2)Al(OH)3既能与酸反应,又能与碱反应,为________。
①与盐酸反应的化学方程式:______________________________________
②与氢氧化钠反应的化学方程式:_____________________________________
3、元素周期律:元素的性质随着核电荷数的递增呈现周期性的变化规律。
分析:随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的主要化合价(最高化合价和最低化合价)、元素的金属性和非金属性均呈现周期性变化。元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果,提示他元素之间的内在关系。
课堂小结:
1.HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是 ( )
A.CH4<H2O<HF<SiH4 B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HF D.H2O<CH4<HF<SiH4
2.下列氧化物按其形成的含氧酸酸性递增排列的顺序是
( )
A.SiO2<CO2<SO3<P2O5 B.SiO2<CO2<P2O5<SO3
C.CO2<SiO2<P2O5<SO3 D.CO2<P2O5<SO3<SiO2
C
B
5.1.1 元素周期律
思考:
1、原子核外电子排布有哪些规律?
2、画出Na、Mg、Al、Si、P、S、Cl原子的原子结构示意图
3、元素化合价与核外电子排布有什么关系?
(1)核外电子总是尽可能先排布在能量的电子层,然后由里及外从能量的电子层逐步向能量的电子层排布。 即 K
(2)活泼非金属在反应中,一般得到电子,表示负化合价。
一、原子序数
1、概念:按照_____由小到大的顺序给元素依次编号,这种编号叫作_____。
思考:根据原子序数的规定方法,该序数与原子组成的哪些粒子数有关系 有什么关系
2、规律:
(1)元素的原子序数在数值上等于该元素原子的____________。
(2)原子序数=__________=__________=_______________
核电荷数
原子序数
核电荷数
核电荷数
质子数
原子的核外电子数
观察思考1:写出1-18号元素原子的结构示意图,分析核外电子排布,找出规律。
原子序数 电子层数 最外层电子数 达到稳定结构时
最外层电子数
1~2 1 1→2 2
3~10 2 1→8 8
11~18 3 1→8 8
归纳总结
二、元素周期律
(一)原子结构:
1、核外电子排布:随着原子序数的递增,元素原子的核外电子排布呈现周期性变化
规律:
(1)原子电子层数相同时,最外层电子数_____,半径_____
(2)最外层电子数相同时,电子层数________,半径______
观察思考2:分析下左图数据,在右图中画出图像
3-9号元素 3Li锂 4Be铍 5B硼 6C碳 7N氮 8O氧 9F氟
原子半径/pm 152 111 88 77 70 66 64
11-17号元素 11Na钠 12Mg镁 13Al铝 14Si硅 15P磷 16S硫 17Cl氯
原子半径/pm 186 160 143 117 110 104 99
●
●
●
●
●
●
●
●
●
●
●
●
●
●
2、原子半径:随着原子序数的递增,元素原子半径呈现周期性的变
规律:
(1)原子电子层数相同时,最外层电子数越多,半径越小
(2)最外层电子数相同时,电子层数越多,半径越大
观察思考3:
(1)元素的化合价随着元素原子序数的递增有什么规律性的变化
(2)元素的最高正价与什么有关?元素的最低负价与什么有关?元素的最高正价与最低负价之间有什么联系?
原子序数 化合价的变化
1~2 +1→0
3~10 +1→+5;-4→-1→0
11~18 +1→+7;-4→-1→0
(二)元素性质
1、元素化合价:随着原子序数的递增,元素化合价呈现周期性的变化
规律:
①元素的最高正价=最外层电子数(O、F及稀有气体元素除外)
②元素的负化合价(非金属具有)=8-最外层电子数
③元素的最高化合价与最低化合价绝对值之和=8
观察思考4:钠、镁、铝的金属性有什么变化规律?
性 质 Na Mg Al
单质与水(或酸)的反应情况 与冷水剧烈反应 与冷水缓慢、与沸水迅速反应,与酸剧烈反应 与酸迅速反应
最高价氧化物对应水化物的碱性强弱 NaOH强碱 Mg(OH)2中强碱 Al(OH)3两性氢氧化物
金属性:随着核电荷数的递增,元素的金属性呈现周期性变化。
分析:钠到铝,原子的最外层电子数依次递增,元素的原子半径依次递减,原子核对最外层电子的引力逐步增强,原子失去最外层电子的能力逐步减弱,所以,元素的金属性依次减弱。
观察思考5:根据下表数据分析元素非金属性强弱规律
3、非金属性:随着核电荷数的递增,元素的非金属性呈现周期性的变化。
分析:从Si、P、S到Cl,原子的最外层电子数依次递增,元素的原子半径依次递减,原子核对最外层电子的引力逐步增强,原子得到电子的能力逐步增强,所以元素的非金属性依次增强。
小结:金属性与非金属性强弱比较:
1、金属性:(1)元素原子失电子能力越强,元素的金属性越强
(2)与水或酸反应越剧烈,金属性越强
(3)最高价氧化物的水化物碱性越强,金属性越强
2、非金属性:
(1)元素原子得电子能力越强,元素的非金属性越强
(2)与氢气反应越容易,非金属性越强
(3)氢态氢化物越稳定,非金属性越强
(4)最高价氧化物的水化物的酸性越强,非金属性越强。
教材118页“观察与思考”:
(1)11-17号元素:
随核电荷数增加,_____逐渐减弱,____逐渐增强;
随核电荷数增加,金属性逐渐_____,非金属性逐渐____。
(2)Al(OH)3既能与酸反应,又能与碱反应,为________。
①与盐酸反应的化学方程式:______________________________________
②与氢氧化钠反应的化学方程式:_____________________________________
3、元素周期律:元素的性质随着核电荷数的递增呈现周期性的变化规律。
分析:随着元素核电荷数的递增,元素的原子半径(稀有气体元素除外)、元素的主要化合价(最高化合价和最低化合价)、元素的金属性和非金属性均呈现周期性变化。元素周期律是元素原子核外电子排布随着元素核电荷数的递增发生周期性变化的必然结果,提示他元素之间的内在关系。
课堂小结:
1.HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是 ( )
A.CH4<H2O<HF<SiH4 B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HF D.H2O<CH4<HF<SiH4
2.下列氧化物按其形成的含氧酸酸性递增排列的顺序是
( )
A.SiO2<CO2<SO3<P2O5 B.SiO2<CO2<P2O5<SO3
C.CO2<SiO2<P2O5<SO3 D.CO2<P2O5<SO3<SiO2
C
B
