化学人教版(2019)选择性必修1 2.4化学反应的调控(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.4化学反应的调控(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-17 12:37:28 | ||
图片预览







文档简介
(共27张PPT)
第二章第四节 化学反应的调控
核心素养发展目标
1.变化观念与平衡思想:知道如何应用化学反应速率和化学平衡分
析合成氨的适宜条件,体会应用化学原理分析化工生产条件的思
路和方法。
2.科学态度与社会责任:认识化学反应速率和化学平衡的调控在工
业生产中的重要应用,探索最适宜的化工生产条件。
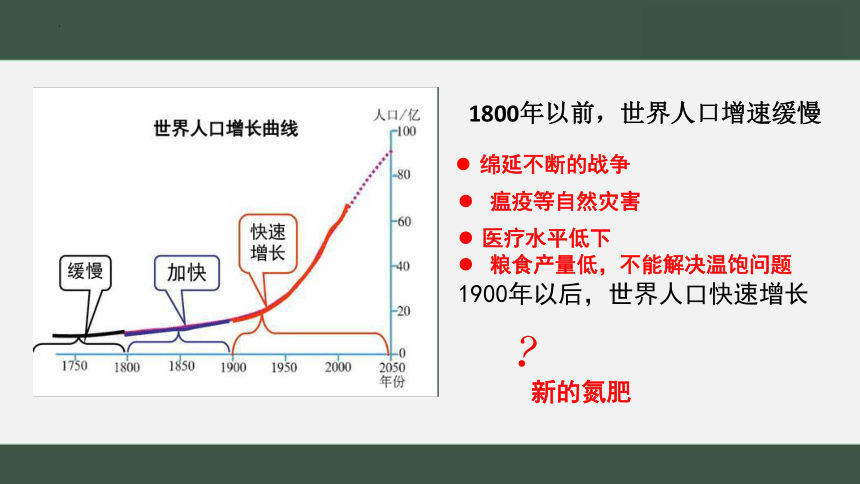
绵延不断的战争
瘟疫等自然灾害
粮食产量低,不能解决温饱问题
1900年以后,世界人口快速增长
1800年以前,世界人口增速缓慢
?
新的氮肥
医疗水平低下
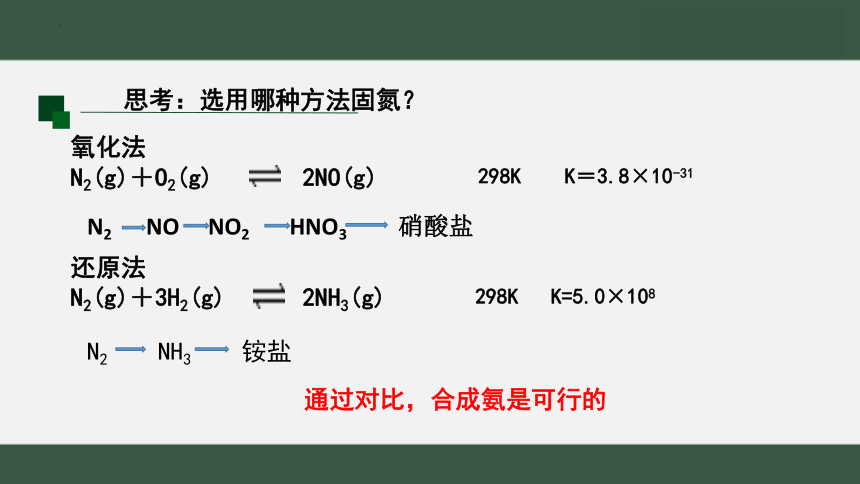
氧化法
N2(g)+O2(g) 2NO(g)
还原法
N2(g)+3H2(g) 2NH3(g)
298K K=3.8×10-31
298K K=5.0×108
思考:选用哪种方法固氮?
通过对比,合成氨是可行的
N2 NO NO2 HNO3 硝酸盐
N2 NH3 铵盐
1918年,德国化学家弗里茨·哈伯,研究从单质氮气合成氨而获奖
1931年,德国化学家卡尔·博施发展合成氨化学高压技术而获奖
2007年德国化学家格哈德·埃特尔由于他的固体表面化学反应的研究而获奖
哈伯合成氨实验装置
压强:17.5 —20MPa
温度:500— 600 °C
催化剂:锇金属
氨的含量:6%
用空气制造面包的圣人
任务一:如何提高合成氨中,平衡混合物中氨的百分含量?
化学平衡角度
化学反应速率角度
1.合成氨反应的特点:
合成氨反应N2(g)+3H2(g) =2NH3(g)。已知298K时:
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1。
常温(298 K)下,ΔG = ΔH-TΔS <0,能自发进行。
一、合成氨原理分析
①放热反应
②熵减小的反应 体积缩小的反应
③ΔH <0 ΔS <0
低温能自发进行
对合成氨反应得影响 影响因素 浓度 温度 压强 催化剂
提高平衡混合物中氨的含量
2.原理分析:根据合成氨反应的特点,如何选择反应条件,提高平衡混合物中氨的含量?
增大压强
及时移走生成物氨气
n(N2):n(H2) 1:3
降低温度
无影响
≈
任务二:如何验证理论的真实性?
设计实验
控制单一变量
1.压强
①理论分析:根据合成氨反应的特点,
压强越大越有利于合成氨,能提高平衡
混合物中氨的百分含量
②实验分析:与理论一致
二、合成氨实验分析
控制变量n(N2):n(H2) 1:3 400°C
≈
2.温度
①理论分析:根据合成氨反应的特点,
低温有利于提高原料的平衡转化率,
能提高平衡混合物中氨的百分含量
②实验分析:与理论一致
控制变量n(N2):n(H2) 1:3 10MPa
≈
3.浓度
理论分析:增大反应物浓度,及时移走生成物有利于合成氨(n(N2):n(H2) 1:3)
实验分析:与理论一致
≈
从化学平衡角度,合成氨的适宜条件
浓度 及时移走生成物氨气,n(N2):n(H2) 1:3
低温
高压
≈
三、从化学反应速率考虑合成氨
有利于加快合成氨速率的因素
对合成氨反应得影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
增大反应物的浓度
升高温度
增大压强
合适的催化剂
对合成氨反应得影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
升高温度
增大压强
使用合适催化剂
n(N2):n(H2) 1:3
移走生成物氨气
降低温度
增大压强
任务三:根据合成氨反应的特点,如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
≈
综合考虑(合成氨反应速率及平衡时氨的含量)
1.压强 10-30MPa 设备的承压能力,安全操作
2.催化剂 铁触媒 降低合成氨反应的活化能,加快反应速率
3.温度 400-500℃ 催化剂的活性最强
条件 活化能KJ/mol K (催)/K(无)
无催化剂 335 3.4×1012
(700K)
铁触媒催化剂 167
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.3 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
任务四:如何进一步提高氮气和氢气的转化率?
不同条件下,合成氨反应达平衡时,混合物中氨的百分含量
4.浓度 n(N2):n(H2) 1:3 及时移走生成物氨气, 将分离后的氮气和氢气循环使用,并及时补充原料气, 使反应物保持一定浓度。
≈
合成氨反应中,铁催化剂的反应机理
①xFe+N2 → FexN ②FexN+[H]吸 → FexNH
③FeNH+[H]吸→ FexNH2 ④FexNH2+[H]吸 → FexNH3
⑤FexNH3 →xFe+NH3
再说催化剂
含S、P、As的化合物能使铁催化剂永久性中毒,失去活性,因此原料气必须净化
合成氨领域重大发现
1908年,哈伯研究合成氨获得成功,不仅为人类开辟了人工固氮的途径,而且对化学工艺的发展产生深远的影响
1931年,博施研究因发展合成氨高压技术获得成功
2007年,埃特尔阐明了氮气与氢气在铁催化剂表面反应的七个步骤,并发现了传统的合成氨反应中最慢的一步,进行了有效的疏通,使整个反应的效率大为改观
2016年,中国科学家研制出一种双活性中心新型催化剂,把合成氨条件降到了350℃、1MPa,为发展新型催化剂提供了新的思路
思考:为了提高合成氨的生产能力,我们还可以在哪些方面做进一步改进?
寻找更耐压的金属材料
仿生固氮酶课题的突破
寻找抗毒能力强的新型催化剂
合成氨生产简易流程示意图
合成氨工业
防止催化剂中毒
原理分析
任务五:对于一个化学反应,如何选择反应适宜条件?
工业
理论分析
调控目的
确定反应
实践验证
化学平衡
反应速率
设备、成本
安全、环保
确定最终条件
1.CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下平衡转化率与压强的关系如图。该反应ΔH (填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______________________________________ _
____________________________________________________________________
在250 ℃、1.3×104 kPa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,而生产成本增加,经济效益低
任务六: 课堂演练
<
温度 平衡时SO2的转化率(%) 1×105Pa 5×105Pa 1×106Pa 5×106Pa 1×107Pa
450 ℃ 97.5 98.9 99.2 99.6 99.7
550 ℃ 85.6 92.9 94.9 97.7 98.3
2.在硫酸工业中.通过下列反应2SO2(g)+O2(g) 2SO3(g) △H<0。制备SO3过程中使用的催化剂是V2O5。下表为不同温度和压强下SO2的转化率,试回答下列问题:
(1)实际生产中,选定400~500℃作为操作温度,是由于_______________。
(2)实际生产中采用的压强为常压,原因是 _______________。
(3)根据化学原理综合分析,为了使SO2尽可能转化为SO3,可控制的条件是_______________________。
此温度下,催化剂活性最高
在常压下,SO2的转化率(97.5%)已经很高,若再加压,平衡正向移动效果不明显,且对设备要求高,成本高
3
450℃、常压、催化剂
3.合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)
在进入合成塔前常用醋酸二氨合铜溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac CO△H<0。回答下列问题:
(1)必须除去原料气中的CO的原因是_________
(2)醋酸二氨合铜溶液吸收CO的适宜条件是___________。
(3)吸收CO后的醋酸二氨合铜经过适当的处理又可再生,
恢复吸收CO的能力以供循环使用。醋酸二氨合铜再生
的适宜条件应是____________________。
防止催化剂中毒
低温、高压
高温、低压
第二章第四节 化学反应的调控
核心素养发展目标
1.变化观念与平衡思想:知道如何应用化学反应速率和化学平衡分
析合成氨的适宜条件,体会应用化学原理分析化工生产条件的思
路和方法。
2.科学态度与社会责任:认识化学反应速率和化学平衡的调控在工
业生产中的重要应用,探索最适宜的化工生产条件。
绵延不断的战争
瘟疫等自然灾害
粮食产量低,不能解决温饱问题
1900年以后,世界人口快速增长
1800年以前,世界人口增速缓慢
?
新的氮肥
医疗水平低下
氧化法
N2(g)+O2(g) 2NO(g)
还原法
N2(g)+3H2(g) 2NH3(g)
298K K=3.8×10-31
298K K=5.0×108
思考:选用哪种方法固氮?
通过对比,合成氨是可行的
N2 NO NO2 HNO3 硝酸盐
N2 NH3 铵盐
1918年,德国化学家弗里茨·哈伯,研究从单质氮气合成氨而获奖
1931年,德国化学家卡尔·博施发展合成氨化学高压技术而获奖
2007年德国化学家格哈德·埃特尔由于他的固体表面化学反应的研究而获奖
哈伯合成氨实验装置
压强:17.5 —20MPa
温度:500— 600 °C
催化剂:锇金属
氨的含量:6%
用空气制造面包的圣人
任务一:如何提高合成氨中,平衡混合物中氨的百分含量?
化学平衡角度
化学反应速率角度
1.合成氨反应的特点:
合成氨反应N2(g)+3H2(g) =2NH3(g)。已知298K时:
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1。
常温(298 K)下,ΔG = ΔH-TΔS <0,能自发进行。
一、合成氨原理分析
①放热反应
②熵减小的反应 体积缩小的反应
③ΔH <0 ΔS <0
低温能自发进行
对合成氨反应得影响 影响因素 浓度 温度 压强 催化剂
提高平衡混合物中氨的含量
2.原理分析:根据合成氨反应的特点,如何选择反应条件,提高平衡混合物中氨的含量?
增大压强
及时移走生成物氨气
n(N2):n(H2) 1:3
降低温度
无影响
≈
任务二:如何验证理论的真实性?
设计实验
控制单一变量
1.压强
①理论分析:根据合成氨反应的特点,
压强越大越有利于合成氨,能提高平衡
混合物中氨的百分含量
②实验分析:与理论一致
二、合成氨实验分析
控制变量n(N2):n(H2) 1:3 400°C
≈
2.温度
①理论分析:根据合成氨反应的特点,
低温有利于提高原料的平衡转化率,
能提高平衡混合物中氨的百分含量
②实验分析:与理论一致
控制变量n(N2):n(H2) 1:3 10MPa
≈
3.浓度
理论分析:增大反应物浓度,及时移走生成物有利于合成氨(n(N2):n(H2) 1:3)
实验分析:与理论一致
≈
从化学平衡角度,合成氨的适宜条件
浓度 及时移走生成物氨气,n(N2):n(H2) 1:3
低温
高压
≈
三、从化学反应速率考虑合成氨
有利于加快合成氨速率的因素
对合成氨反应得影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
增大反应物的浓度
升高温度
增大压强
合适的催化剂
对合成氨反应得影响 影响因素 浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
升高温度
增大压强
使用合适催化剂
n(N2):n(H2) 1:3
移走生成物氨气
降低温度
增大压强
任务三:根据合成氨反应的特点,如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
≈
综合考虑(合成氨反应速率及平衡时氨的含量)
1.压强 10-30MPa 设备的承压能力,安全操作
2.催化剂 铁触媒 降低合成氨反应的活化能,加快反应速率
3.温度 400-500℃ 催化剂的活性最强
条件 活化能KJ/mol K (催)/K(无)
无催化剂 335 3.4×1012
(700K)
铁触媒催化剂 167
温度/℃ 氨的含量/% 0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.3 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
任务四:如何进一步提高氮气和氢气的转化率?
不同条件下,合成氨反应达平衡时,混合物中氨的百分含量
4.浓度 n(N2):n(H2) 1:3 及时移走生成物氨气, 将分离后的氮气和氢气循环使用,并及时补充原料气, 使反应物保持一定浓度。
≈
合成氨反应中,铁催化剂的反应机理
①xFe+N2 → FexN ②FexN+[H]吸 → FexNH
③FeNH+[H]吸→ FexNH2 ④FexNH2+[H]吸 → FexNH3
⑤FexNH3 →xFe+NH3
再说催化剂
含S、P、As的化合物能使铁催化剂永久性中毒,失去活性,因此原料气必须净化
合成氨领域重大发现
1908年,哈伯研究合成氨获得成功,不仅为人类开辟了人工固氮的途径,而且对化学工艺的发展产生深远的影响
1931年,博施研究因发展合成氨高压技术获得成功
2007年,埃特尔阐明了氮气与氢气在铁催化剂表面反应的七个步骤,并发现了传统的合成氨反应中最慢的一步,进行了有效的疏通,使整个反应的效率大为改观
2016年,中国科学家研制出一种双活性中心新型催化剂,把合成氨条件降到了350℃、1MPa,为发展新型催化剂提供了新的思路
思考:为了提高合成氨的生产能力,我们还可以在哪些方面做进一步改进?
寻找更耐压的金属材料
仿生固氮酶课题的突破
寻找抗毒能力强的新型催化剂
合成氨生产简易流程示意图
合成氨工业
防止催化剂中毒
原理分析
任务五:对于一个化学反应,如何选择反应适宜条件?
工业
理论分析
调控目的
确定反应
实践验证
化学平衡
反应速率
设备、成本
安全、环保
确定最终条件
1.CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下平衡转化率与压强的关系如图。该反应ΔH (填“>”或“<”)0。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______________________________________ _
____________________________________________________________________
在250 ℃、1.3×104 kPa下,CO的转化率已较高,再增大压强,CO的转化率提高不大,而生产成本增加,经济效益低
任务六: 课堂演练
<
温度 平衡时SO2的转化率(%) 1×105Pa 5×105Pa 1×106Pa 5×106Pa 1×107Pa
450 ℃ 97.5 98.9 99.2 99.6 99.7
550 ℃ 85.6 92.9 94.9 97.7 98.3
2.在硫酸工业中.通过下列反应2SO2(g)+O2(g) 2SO3(g) △H<0。制备SO3过程中使用的催化剂是V2O5。下表为不同温度和压强下SO2的转化率,试回答下列问题:
(1)实际生产中,选定400~500℃作为操作温度,是由于_______________。
(2)实际生产中采用的压强为常压,原因是 _______________。
(3)根据化学原理综合分析,为了使SO2尽可能转化为SO3,可控制的条件是_______________________。
此温度下,催化剂活性最高
在常压下,SO2的转化率(97.5%)已经很高,若再加压,平衡正向移动效果不明显,且对设备要求高,成本高
3
450℃、常压、催化剂
3.合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)
在进入合成塔前常用醋酸二氨合铜溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac CO△H<0。回答下列问题:
(1)必须除去原料气中的CO的原因是_________
(2)醋酸二氨合铜溶液吸收CO的适宜条件是___________。
(3)吸收CO后的醋酸二氨合铜经过适当的处理又可再生,
恢复吸收CO的能力以供循环使用。醋酸二氨合铜再生
的适宜条件应是____________________。
防止催化剂中毒
低温、高压
高温、低压
