氧化还原反应
图片预览





文档简介
课件26张PPT。氧化还原反应榆林林校综合高中 张振宏高中化学总复习系列课件1、化学反应的分类
(1)据反应物的类别和种类的多少分
(2)据有无电子转移
(3)据是否有离子参加
(4)据反应进行的程度
(5)据反应的热效应化合反应 分解反应 置换反应 复分解反应氧化还原反应 非氧化还原反应离子反应 分子反应可逆反应 不可逆反应吸热反应 放热反应
( 1 )、本质:
有电子转移
( 2 )、特征:
元素化合价了生变化
( 3 )、判断:
凡是有化合价升降的化学反应就是氧化还原反应。
元素化合价均没有变化的化学反应就是非氧化还原反应。
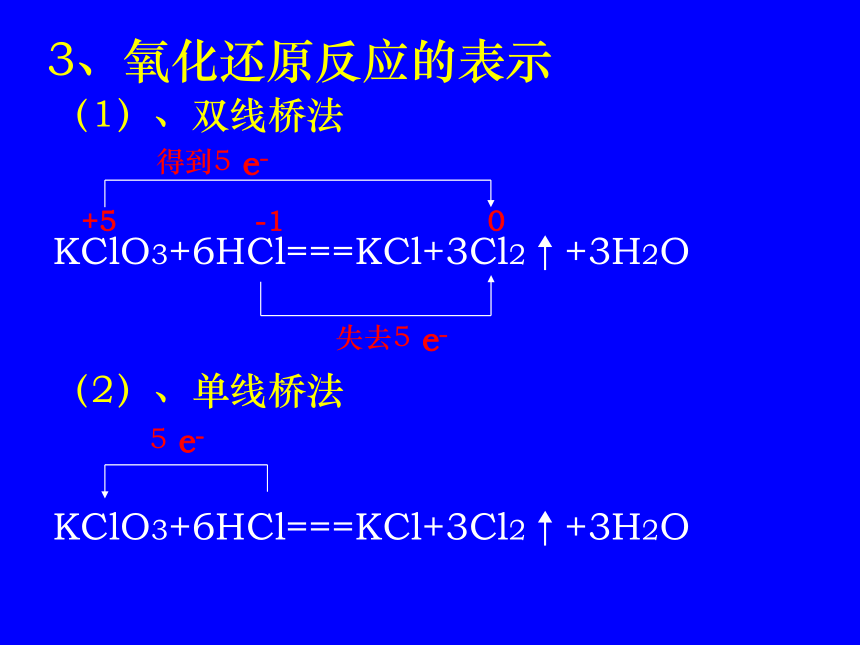
例:IBr+H2O==HBr+HIO 2、氧化还原反应的本质、特征、判断3、氧化还原反应的表示(1)、双线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O
(2)、单线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O +5 -1 0 得到5 e- 失去5 e- 5 e-
氧化反应:
还原反应:
氧 化 性:
还 原 性:
氧 化 剂:
还 原 剂:
氧化产物:
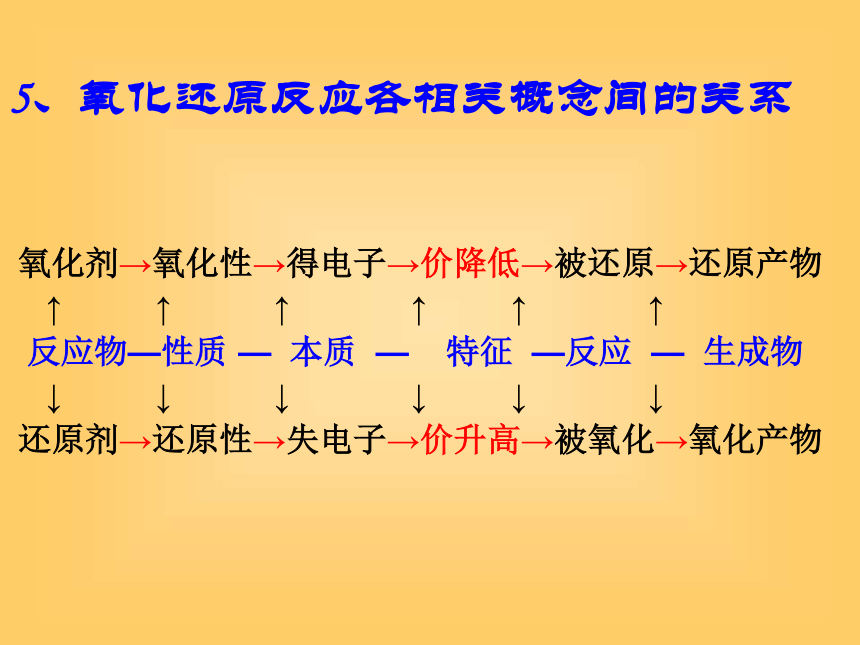
还原产物:物质所含元素化合价升高的过程物质所含元素化合价降低的过程物质(元素、离子)具有得到电子的性质或能力物质(元素、离子)具有失去电子的性质或能力所含元素化合价降低的反应物所含元素化合价升高的物质还原剂失去电子被氧化后的产物氧化剂得到电子被还原后的产物4、相关概念5、氧化还原反应各相关概念间的关系 氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
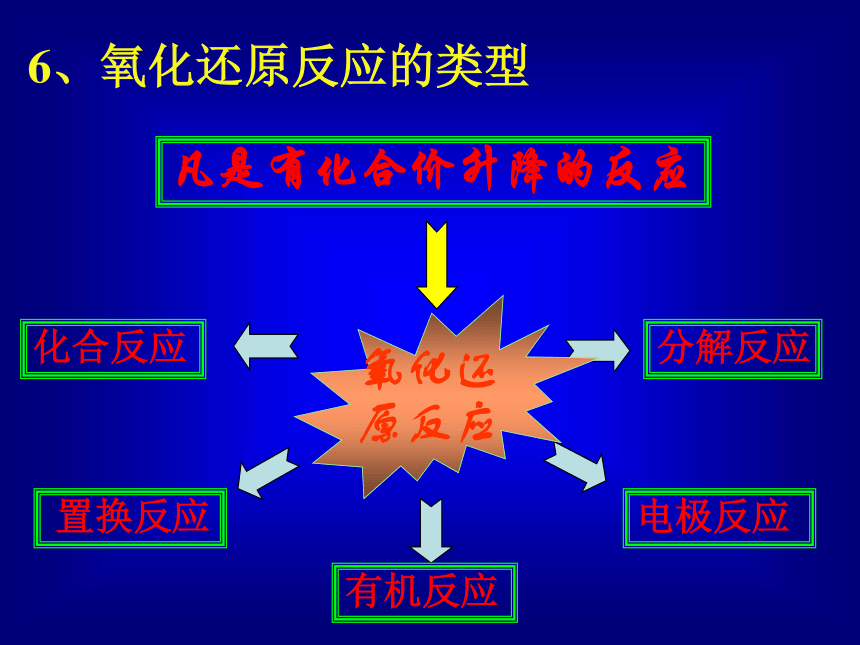
还原剂→还原性→失电子→价升高→被氧化→氧化产物 6、氧化还原反应的类型 置换反应 电极反应 化合反应 分解反应 有机反应 凡是有化合价升降的反应氧化还原反应判断下列哪些反应是氧化还原反应?理由?
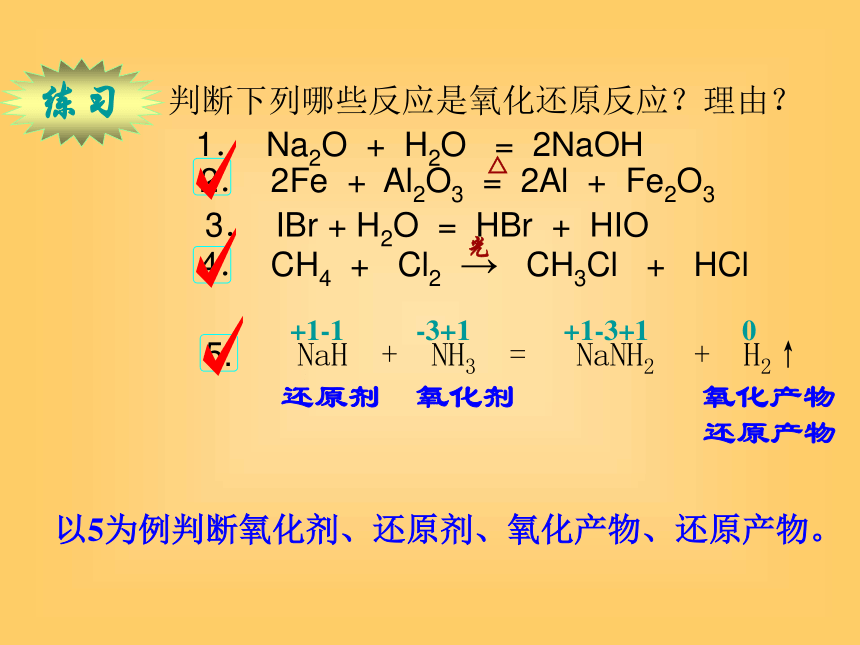
1.? Na2O + H2O = 2NaOH 2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? IBr + H2O = HBr + HIO 4.? CH4 + Cl2 → CH3Cl + HCl
5. NaH + NH3 = NaNH2 + H2↑
光△以5为例判断氧化剂、还原剂、氧化产物、还原产物。 还原剂 氧化剂 氧化产物
还原产物 +1-1 -3+1 +1-3+1 0练习7、常见的氧化剂、还原剂重要的氧化剂
(1)活泼的非金属单质,如Cl2、Br2、O2等。
(2)元素处于高化合价时的氧化物,如MnO2等。
(3)元素处于高化合价时的含氧酸,如浓H2SO4、HNO3等。
(4)元素处于高化合价时的盐,比如KMnO4、KClO3、FeCl3等。
(5)过氧化物,如Na2O2、H2O2等。 重要的还原剂
(1)活泼的金属,如Na、 Al、Zn、Fe等。
(2)某些非金属单质,如H2、C、Si等。
(3)元素处于低化合价时的氧化物,如CO、SO2等。
(4)元素处于低化合价时的酸,如HCl、H2S等。
(5)元素处于低化合价时的盐,如Na2SO3、FeSO4等。8、氧化还原反应方程式的配平
配平原则
得失电子数相等
化合价代数和为零例题 K2S + HNO3 —— KNO3 + S + NO + H2O 9、氧化性、还原性强弱比较
(1)根据金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐增强,还原性逐渐增强其阳离子得电子能力逐渐增强,氧化性逐渐增强例:如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1) 请写出A、B两极发生反应的电极反应式 。
(2)请分析A、B两极质量变化情况为 。 答案:A:Zn-2e-→Zn2+B:先2Ag++2e- →2AgB:后Cu2++2e- →CuA极减少6.5克,
B极增加14克。(2)根据非金属活动顺序判断
F2 Cl2 Br2 I2 S
F- Cl- Br- I- S2-氧化性逐渐减弱还原性逐渐增强(3)根据反应进行的方向判断
氧化剂+还原剂 还原产物+氧化产物氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物 今有下列三个氧化还原反应:
1、2FeCl3+2KI=2FeCl2+2KCl+I2
2、2FeCl2+Cl2=2FeCl3
3、2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-、 Cl-共存,要除去I-而不影响Fe2+和Cl- ,则可加入的试剂是 。
A、Cl2 B、KMnO4 C、FeCl3 D、HCl例金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱(4)根据元素周期表判断( 5 )根据氧化还原产物判断已知:
Fe+S=FeS
2Fe+3Cl2=2FeCl3
Fe+O2=Fe3O4 氧化性:Cl2 >O2 > S(6)根据反应进行的难易判断 不同氧化剂与同一还原剂反应,越容易进行的反应其中氧化剂的氧化性越强; 不同还原剂与同一氧化剂反应,越容易进行的反应其中还原剂的还原性越强。(7)根据电极反应判断(1)两种不同的金属构成原电池时,做负极的金属的还原性比正极金属的还原性强。 (2)用惰性电极电解混合溶液时,在阴极先放电的金属离子的氧化性强;在阳极先放电的阴离子的还原性强。 10、氧化还原反应的规律(1)得失电子相等规律 化合价升高的原子个数×化合价升高值=化合价降低的原子个数×化合价降低值(2)反应的先后规律 在溶液中存在多种氧化剂,当向溶液中加入一种还原剂时,氧化性强者先被还原。 在溶液中存在多种还原剂,当向溶液中加入一种氧化剂时,还原性强者先被氧化。 (3)邻位转化规律 在一般情况下大多数氧化还原反应中,氧化剂和还原剂的价态变化是邻位转化的。 (4)归中规律 同一元素不同价态之间的氧化还原反应,其产物的价态的变化既不交换,也不交叉。如:H2S+H2SO4=S+SO2+2H2O-2 +6 0 +4 11、氧化还原反应的计算 氧化还原反应比较典型的计算有:
(1)求氧化剂与还原剂、氧化产物与还原产物的物质的量或质量比;
(2)计算氧化剂、还原剂、氧化产物、还原产物的量;
(3)确定反应前后某一元素的价态变化。
基本思路:
由化合价变化入手进行分析弄清各相关概念之间的定性关系,依据氧化剂与还原剂得失电子总数相等列出守恒关系式求解
再见
(1)据反应物的类别和种类的多少分
(2)据有无电子转移
(3)据是否有离子参加
(4)据反应进行的程度
(5)据反应的热效应化合反应 分解反应 置换反应 复分解反应氧化还原反应 非氧化还原反应离子反应 分子反应可逆反应 不可逆反应吸热反应 放热反应
( 1 )、本质:
有电子转移
( 2 )、特征:
元素化合价了生变化
( 3 )、判断:
凡是有化合价升降的化学反应就是氧化还原反应。
元素化合价均没有变化的化学反应就是非氧化还原反应。
例:IBr+H2O==HBr+HIO 2、氧化还原反应的本质、特征、判断3、氧化还原反应的表示(1)、双线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O
(2)、单线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O +5 -1 0 得到5 e- 失去5 e- 5 e-
氧化反应:
还原反应:
氧 化 性:
还 原 性:
氧 化 剂:
还 原 剂:
氧化产物:
还原产物:物质所含元素化合价升高的过程物质所含元素化合价降低的过程物质(元素、离子)具有得到电子的性质或能力物质(元素、离子)具有失去电子的性质或能力所含元素化合价降低的反应物所含元素化合价升高的物质还原剂失去电子被氧化后的产物氧化剂得到电子被还原后的产物4、相关概念5、氧化还原反应各相关概念间的关系 氧化剂→氧化性→得电子→价降低→被还原→还原产物
↑ ↑ ↑ ↑ ↑ ↑
反应物—性质 — 本质 — 特征 —反应 — 生成物
↓ ↓ ↓ ↓ ↓ ↓
还原剂→还原性→失电子→价升高→被氧化→氧化产物 6、氧化还原反应的类型 置换反应 电极反应 化合反应 分解反应 有机反应 凡是有化合价升降的反应氧化还原反应判断下列哪些反应是氧化还原反应?理由?
1.? Na2O + H2O = 2NaOH 2.? 2Fe + Al2O3 = 2Al + Fe2O3
3.? IBr + H2O = HBr + HIO 4.? CH4 + Cl2 → CH3Cl + HCl
5. NaH + NH3 = NaNH2 + H2↑
光△以5为例判断氧化剂、还原剂、氧化产物、还原产物。 还原剂 氧化剂 氧化产物
还原产物 +1-1 -3+1 +1-3+1 0练习7、常见的氧化剂、还原剂重要的氧化剂
(1)活泼的非金属单质,如Cl2、Br2、O2等。
(2)元素处于高化合价时的氧化物,如MnO2等。
(3)元素处于高化合价时的含氧酸,如浓H2SO4、HNO3等。
(4)元素处于高化合价时的盐,比如KMnO4、KClO3、FeCl3等。
(5)过氧化物,如Na2O2、H2O2等。 重要的还原剂
(1)活泼的金属,如Na、 Al、Zn、Fe等。
(2)某些非金属单质,如H2、C、Si等。
(3)元素处于低化合价时的氧化物,如CO、SO2等。
(4)元素处于低化合价时的酸,如HCl、H2S等。
(5)元素处于低化合价时的盐,如Na2SO3、FeSO4等。8、氧化还原反应方程式的配平
配平原则
得失电子数相等
化合价代数和为零例题 K2S + HNO3 —— KNO3 + S + NO + H2O 9、氧化性、还原性强弱比较
(1)根据金属活动顺序表
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐增强,还原性逐渐增强其阳离子得电子能力逐渐增强,氧化性逐渐增强例:如图,将铜片和锌片焊接在一起组成A电极,B为碳棒进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1) 请写出A、B两极发生反应的电极反应式 。
(2)请分析A、B两极质量变化情况为 。 答案:A:Zn-2e-→Zn2+B:先2Ag++2e- →2AgB:后Cu2++2e- →CuA极减少6.5克,
B极增加14克。(2)根据非金属活动顺序判断
F2 Cl2 Br2 I2 S
F- Cl- Br- I- S2-氧化性逐渐减弱还原性逐渐增强(3)根据反应进行的方向判断
氧化剂+还原剂 还原产物+氧化产物氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物 今有下列三个氧化还原反应:
1、2FeCl3+2KI=2FeCl2+2KCl+I2
2、2FeCl2+Cl2=2FeCl3
3、2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-、 Cl-共存,要除去I-而不影响Fe2+和Cl- ,则可加入的试剂是 。
A、Cl2 B、KMnO4 C、FeCl3 D、HCl例金属单质的还原性随金属性增强而增强,其离子的氧化性相应减弱非金属单质的氧化性随非金属性增强而增强,其离子的还原性相应减弱(4)根据元素周期表判断( 5 )根据氧化还原产物判断已知:
Fe+S=FeS
2Fe+3Cl2=2FeCl3
Fe+O2=Fe3O4 氧化性:Cl2 >O2 > S(6)根据反应进行的难易判断 不同氧化剂与同一还原剂反应,越容易进行的反应其中氧化剂的氧化性越强; 不同还原剂与同一氧化剂反应,越容易进行的反应其中还原剂的还原性越强。(7)根据电极反应判断(1)两种不同的金属构成原电池时,做负极的金属的还原性比正极金属的还原性强。 (2)用惰性电极电解混合溶液时,在阴极先放电的金属离子的氧化性强;在阳极先放电的阴离子的还原性强。 10、氧化还原反应的规律(1)得失电子相等规律 化合价升高的原子个数×化合价升高值=化合价降低的原子个数×化合价降低值(2)反应的先后规律 在溶液中存在多种氧化剂,当向溶液中加入一种还原剂时,氧化性强者先被还原。 在溶液中存在多种还原剂,当向溶液中加入一种氧化剂时,还原性强者先被氧化。 (3)邻位转化规律 在一般情况下大多数氧化还原反应中,氧化剂和还原剂的价态变化是邻位转化的。 (4)归中规律 同一元素不同价态之间的氧化还原反应,其产物的价态的变化既不交换,也不交叉。如:H2S+H2SO4=S+SO2+2H2O-2 +6 0 +4 11、氧化还原反应的计算 氧化还原反应比较典型的计算有:
(1)求氧化剂与还原剂、氧化产物与还原产物的物质的量或质量比;
(2)计算氧化剂、还原剂、氧化产物、还原产物的量;
(3)确定反应前后某一元素的价态变化。
基本思路:
由化合价变化入手进行分析弄清各相关概念之间的定性关系,依据氧化剂与还原剂得失电子总数相等列出守恒关系式求解
再见
