2.3.4阿伏加德罗定律及其应用 课件(共30张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.4阿伏加德罗定律及其应用 课件(共30张ppt)化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-17 20:20:27 | ||
图片预览










文档简介
(共30张PPT)
第二章 海水中的重要元素-钠和氯
第三节 物质的量
第4课时 阿伏加德罗定律及其应用
思考:在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
在同温同压下,相同分子数的气体,其体积( )
在同温同压下,体积相同的气体,其分子数( )
在同温同压下,气体体积的大小与分子数目成( )比
相同
相同
正
目录
阿伏加德罗定律及其应用
01
阿伏加德罗定律的推论
02
1.理解并掌握阿伏加德罗定律及其重要推论。
2.能够熟练运用并自行推导阿伏加德罗定律的三大推论。
3.理解物质的量是统计、质量、微粒数等物理量之间转化的桥梁,然后正确运用阿伏加德罗定律及其推论进行解答。
习
学
目
标
NO.1
阿伏加德罗定律及其应用
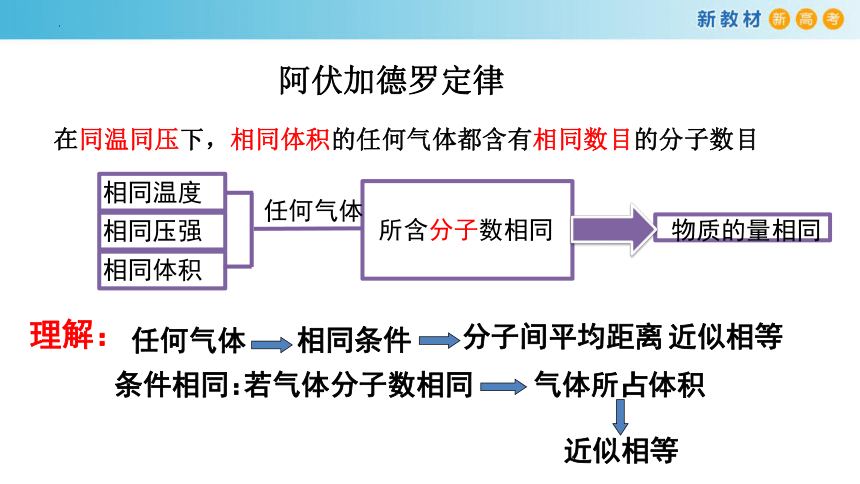
所含分子数相同
相同体积
相同压强
相同温度
任何气体
物质的量相同
理解:
任何气体
在同温同压下,相同体积的任何气体都含有相同数目的分子数目
阿伏加德罗定律
相同条件
分子间平均距离
近似相等
条件相同:
若气体分子数相同
气体所占体积
近似相等
(1)“三同”定“一同”。
(2)适用于任何气态物质。既适用于单一气体,又适用于混合气体。
【注意】
定律中有“四同”:
同温、同压、同体积、同分子数目
三同定一同
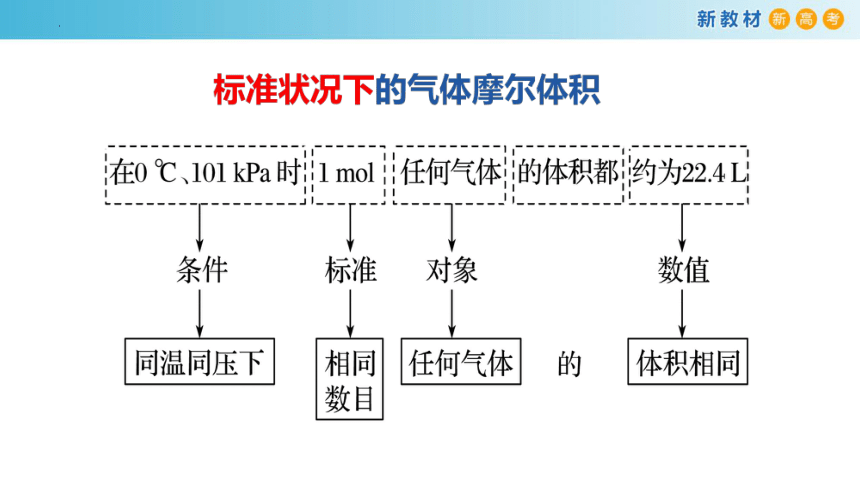
(3)标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例
理想气体方程式:PV=nRT
阿伏加德罗定律的数学表达式:
P:气体压强(单位:Pa )
V:气体的体积(单位:L)
n:气体分子的物质的量(单位:mol)
T:温度(单位:K)
R:常数
n1
=
V1
-
V2
-
n2
=
N1
-
N2
例1、(多选)两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气。在同温同压下两容器内的气体一定具有相同的是 ( )
(A)原子总数 (B)质子总数
(C)分子总数 (D)质量
A C
例2.同温同压下,同物质的量的CH4气体与CO体积比是:
A.3:1 B.1:1 C.1:3 D.2:3
B
阿伏伽德罗定律应用
1、求生成物的分子式
例题1、在一定温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积气态化合物A,则化合物A的化学式是( )
A、XY3 B、XY C、X3Y D、X2Y3
分析:
(1)由阿伏加德罗定律的推论:同温、同压下, V1/V2=n1/n2,得:
n(X2): n(Y2): n(A) = 1: 3 :2
(2)由物质的量之比=化学方程式各物质前的系数比,反应的化学方程式可表示为:X2+3Y2=2A。
(3)根据质量守恒定律,可知A的分子式为XY3。
A
2、式量的确定
例题2、有一真空瓶的质量为m1g,该瓶充入氧气后总质量为m2g;在相同状况下,若改充某气体A后,总质量为m3g。则A的分子量为 。
分析:(1)m(O2)=m2–m1(g)
则:n(O2)=
(m2–m1)g/32g·mol-1= (m2–m1)/32 mol
(2)m(A)= m3–m1(g),
设气体A的摩尔质量为M,
则:n(A)= (m3–m1)/M mol
(3)因气体A与氧气的体积相等,由推论:V1/V2=n1/n2得:
(m2–m1)/32 mol = (m3–m1)/M mol
则:M= 32(m3–m1)/ (m2–m1) (g/mol)
32(m3–m1)/ (m2–m1)
3、判断混合气体的组成
例题3、常温下,在密闭容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是( )。
A、H2和O2 B、HC l和NH3 C、H2和C l2 D、CO和O2
分析:由题意,反应前后温度相同、体积相同,由推论:
同温、同体积时: P2 / P1 =n2 /n1,逐一分析。
A项: 2H2 + O2= 2H2O(液)
2mol 1mol
0.1mol 0.05mol
由计算知:余0.05molO2,因此
P反应后 / P反应前 =n反应后 /n反应前
=0.05mol/(0.1+0.1)mol=1/4。
符合题意。
A
B项: HC l + NH3= NH4C l(固体)
1mol 1mol
0.1mol 0.1mol
无气体剩余,反应后体系压强降为0,不合题意
3、判断混合气体的组成
例题3、常温下,在密闭容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是( )。
A、H2和O2 B、HC l和NH3 C、H2和C l2 D、CO和O2
分析:由题意,反应前后温度相同、体积相同,由推论:
同温、同体积时: P2 / P1 =n2 /n1,逐一分析。
A
C项: H2 + C l2 = 2HCl
1mol 1mol 2mol
0.1mol 0.1mol 0.2mol
反应前后气体的物质的量不变,
则体系压强不变。不合题意。
D项: 2CO + O2 = 2CO2
2mol 1mol 2mol
0.1mol 0.05mol 0.1mol
据反应方程式知:O2过量,余0.05mol;生成CO2 0.1mol,故
P反应后/ P反应前 =n反应后 /n反应前
=(0.1+0.05)mol /(0.1+0.1)mol
= 3 / 4(不合题意)
4、结合化学方程式的计算
例题4、在一定体积的密闭容器中放入3L气体R和气 5L气体Q,在一定条件下发生反应:2R(g)+5Q(g)=4X(g)+n y(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则n值是( )。
A、2 B、3 C、4 D、5
巧解:
因反应完成后,压强变小,故该反应是气体分子数减
小的反应,即:2+5>4+n,得:n<3,只能选A。
分析:由题意:反应前后体积不变、温度不变,则可由推论
P2 / P1 =n2 /n1来解答。
A
推论一:
同温同压下,气体的物质的量之比等于气体的体积比。
T、P相同
∵PV=nRT →V= nRT/P
∴当T、P相同时,气体的体积之比等于其物质的量之比。
阿伏加德罗定律的推论
例1.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)物质的量之比为 ;
(2)原子数之比为 ;
(3)分子数之比为 ;
1:2
1:2
3:4
推论二:
同温同压下,气体的密度之比等于气体的摩尔质量之比。
T、P相同
=D(相对密度)
∵PV=nRT →PV=mRT/M →PM/RT=m/V=ρ
∴当T、P相同时,气体的密度之比等于气体相对分子质量之比。
例2、在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是( )
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
①③④
1.同温同压下,体积相同的下列气体,密度与其它三者不同的是( )
A、N2 B、C2H4
C、CO D、H2S
2.同温同压下,密度相同的气体组是( )
A、CO、N2 B、NO、CH4
C、C2H4、NO D、SO2、Cl2
思考:同温同体积的气体,压强之比等于什么?
T、V相同:
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于
其分子数目之比。
1.在某温度下,将0.1摩O2和0.4摩H2充入容积为2升的密闭容器中,测得其压强为1大气压,H2的压强是( )
A、0.2大气压 B、0.8大气压
C、1大气压 D、无法确定
B
推论5:同温同压同质量下,任何气体的体积之比与_________之比(即_______之比)成反比
V2 M1
V1 M2
=
推论4:同温同压同体积下,任何气体的质量之比等于_______之比(即_________之比)
m1 M1
m2 M2
=
摩尔质量
相对分子质量
摩尔质量
相对分子质量
例4、在同温同压下,同体积的下列气体,质量最大的是( )
A、O2 B、N2 C、Cl2 D、CO2
C
例5、同温同压下,等质量的二氧化碳和二氧化硫相比,下列叙述中正确的是( )
A、密度之比为16:11 B、密度之比为11:16
C、体积之比为11:16 D、物质的量之比为16:11
B D
1、下列说法正确的是( )
A 在标准状况下,1mol水和1molH2的体积都 约是22.4L
B 2gH2和44gCO2的体积相等
C 1mol某气体的体积为22.4L,则该气体一定处于标准状况
D 在标准状况下,1gH2和11.2LO2的物质的量相等
液体
条件不同,可能V不同
不一定
均为气体
D
巩固练习
2:同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)物质的量之比为 ;
(2)分子数之比为_________;
(3)原子数之比为 ;
(4)质量之比为 ___________;
(5)摩尔质量之比为 ___________;
(6)密度之比为——————;
1:2
3:4
11:14
11:7
11:7
1:2
NO.2
摩尔质量 平均摩尔质量计算
(4)已知标准状况下气体的密度(ρ)求解:
M= 22 .4L/mol ×ρg/L
(1)由摩尔质量公式求解:M=m/n
1、摩尔质量
(2)M=m·NA/N=m(一个粒子)·NA,
(3)Mr=
(1)混合气体的平均式量:M(混)= m(总)/ n(总)
M=m总÷n总=(M1n1+M2n2+…+Mini) ÷n总=M1n1/n总+M2n2/n总+…+Mini/n总
=M1V1/V总+M2V2/V总+…+MiVi/V总
M=M1a1+M2a2+…+Miai
a1、a2、…、ai各气体组分的物质的量分数或体积分数。
2、平均摩尔质量
(2)由气体的相对密度求解
两种气体的密度之比称为相对密度。如A气体对B气体的相对密度用DB表示为:
由某气体对H2的相对密度,知
由某气体对空气的相对密度, 可知
练习1、标准状况下某气体的密度为2.56g/L,则该气体的相对分子质量是__________
2、空气中氮气氧气氩气的体积分数分别为78%、21%、1%,则空气的平均相对分子质量为_____
3、在一定条件校气体A可发生如下反应:
2A(气体)==B(气体)+3C(气体)
若在相同条件下所得混合气体对氢气的相对密度为4.25,则A的相对分子质量为___________
M=p22.4=2.56g/L×22.4L/mol
M=M1a1+M2a2+…+Miai
=28×78%+32×21%+40×1%
M(混)=D×M(H2)=4.25×2g/mol=8.5g/mol
由方程式可知2molA生成4mol混合气体,
结合M(混)可知2molA生成4mol×8.5g/mol=34g的混合气体
由质量守恒定律知1molA的质量为17g即M(A)=17g/mol
第二章 海水中的重要元素-钠和氯
第三节 物质的量
第4课时 阿伏加德罗定律及其应用
思考:在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
在同温同压下,相同分子数的气体,其体积( )
在同温同压下,体积相同的气体,其分子数( )
在同温同压下,气体体积的大小与分子数目成( )比
相同
相同
正
目录
阿伏加德罗定律及其应用
01
阿伏加德罗定律的推论
02
1.理解并掌握阿伏加德罗定律及其重要推论。
2.能够熟练运用并自行推导阿伏加德罗定律的三大推论。
3.理解物质的量是统计、质量、微粒数等物理量之间转化的桥梁,然后正确运用阿伏加德罗定律及其推论进行解答。
习
学
目
标
NO.1
阿伏加德罗定律及其应用
所含分子数相同
相同体积
相同压强
相同温度
任何气体
物质的量相同
理解:
任何气体
在同温同压下,相同体积的任何气体都含有相同数目的分子数目
阿伏加德罗定律
相同条件
分子间平均距离
近似相等
条件相同:
若气体分子数相同
气体所占体积
近似相等
(1)“三同”定“一同”。
(2)适用于任何气态物质。既适用于单一气体,又适用于混合气体。
【注意】
定律中有“四同”:
同温、同压、同体积、同分子数目
三同定一同
(3)标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例
理想气体方程式:PV=nRT
阿伏加德罗定律的数学表达式:
P:气体压强(单位:Pa )
V:气体的体积(单位:L)
n:气体分子的物质的量(单位:mol)
T:温度(单位:K)
R:常数
n1
=
V1
-
V2
-
n2
=
N1
-
N2
例1、(多选)两个体积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气。在同温同压下两容器内的气体一定具有相同的是 ( )
(A)原子总数 (B)质子总数
(C)分子总数 (D)质量
A C
例2.同温同压下,同物质的量的CH4气体与CO体积比是:
A.3:1 B.1:1 C.1:3 D.2:3
B
阿伏伽德罗定律应用
1、求生成物的分子式
例题1、在一定温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积气态化合物A,则化合物A的化学式是( )
A、XY3 B、XY C、X3Y D、X2Y3
分析:
(1)由阿伏加德罗定律的推论:同温、同压下, V1/V2=n1/n2,得:
n(X2): n(Y2): n(A) = 1: 3 :2
(2)由物质的量之比=化学方程式各物质前的系数比,反应的化学方程式可表示为:X2+3Y2=2A。
(3)根据质量守恒定律,可知A的分子式为XY3。
A
2、式量的确定
例题2、有一真空瓶的质量为m1g,该瓶充入氧气后总质量为m2g;在相同状况下,若改充某气体A后,总质量为m3g。则A的分子量为 。
分析:(1)m(O2)=m2–m1(g)
则:n(O2)=
(m2–m1)g/32g·mol-1= (m2–m1)/32 mol
(2)m(A)= m3–m1(g),
设气体A的摩尔质量为M,
则:n(A)= (m3–m1)/M mol
(3)因气体A与氧气的体积相等,由推论:V1/V2=n1/n2得:
(m2–m1)/32 mol = (m3–m1)/M mol
则:M= 32(m3–m1)/ (m2–m1) (g/mol)
32(m3–m1)/ (m2–m1)
3、判断混合气体的组成
例题3、常温下,在密闭容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是( )。
A、H2和O2 B、HC l和NH3 C、H2和C l2 D、CO和O2
分析:由题意,反应前后温度相同、体积相同,由推论:
同温、同体积时: P2 / P1 =n2 /n1,逐一分析。
A项: 2H2 + O2= 2H2O(液)
2mol 1mol
0.1mol 0.05mol
由计算知:余0.05molO2,因此
P反应后 / P反应前 =n反应后 /n反应前
=0.05mol/(0.1+0.1)mol=1/4。
符合题意。
A
B项: HC l + NH3= NH4C l(固体)
1mol 1mol
0.1mol 0.1mol
无气体剩余,反应后体系压强降为0,不合题意
3、判断混合气体的组成
例题3、常温下,在密闭容器里分别充入两种气体各0.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是( )。
A、H2和O2 B、HC l和NH3 C、H2和C l2 D、CO和O2
分析:由题意,反应前后温度相同、体积相同,由推论:
同温、同体积时: P2 / P1 =n2 /n1,逐一分析。
A
C项: H2 + C l2 = 2HCl
1mol 1mol 2mol
0.1mol 0.1mol 0.2mol
反应前后气体的物质的量不变,
则体系压强不变。不合题意。
D项: 2CO + O2 = 2CO2
2mol 1mol 2mol
0.1mol 0.05mol 0.1mol
据反应方程式知:O2过量,余0.05mol;生成CO2 0.1mol,故
P反应后/ P反应前 =n反应后 /n反应前
=(0.1+0.05)mol /(0.1+0.1)mol
= 3 / 4(不合题意)
4、结合化学方程式的计算
例题4、在一定体积的密闭容器中放入3L气体R和气 5L气体Q,在一定条件下发生反应:2R(g)+5Q(g)=4X(g)+n y(g)。反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则n值是( )。
A、2 B、3 C、4 D、5
巧解:
因反应完成后,压强变小,故该反应是气体分子数减
小的反应,即:2+5>4+n,得:n<3,只能选A。
分析:由题意:反应前后体积不变、温度不变,则可由推论
P2 / P1 =n2 /n1来解答。
A
推论一:
同温同压下,气体的物质的量之比等于气体的体积比。
T、P相同
∵PV=nRT →V= nRT/P
∴当T、P相同时,气体的体积之比等于其物质的量之比。
阿伏加德罗定律的推论
例1.同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)物质的量之比为 ;
(2)原子数之比为 ;
(3)分子数之比为 ;
1:2
1:2
3:4
推论二:
同温同压下,气体的密度之比等于气体的摩尔质量之比。
T、P相同
=D(相对密度)
∵PV=nRT →PV=mRT/M →PM/RT=m/V=ρ
∴当T、P相同时,气体的密度之比等于气体相对分子质量之比。
例2、在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是( )
①CO2 ②H2 ③Cl2 ④HCl ⑤N2
①③④
1.同温同压下,体积相同的下列气体,密度与其它三者不同的是( )
A、N2 B、C2H4
C、CO D、H2S
2.同温同压下,密度相同的气体组是( )
A、CO、N2 B、NO、CH4
C、C2H4、NO D、SO2、Cl2
思考:同温同体积的气体,压强之比等于什么?
T、V相同:
推论三:同温同体积的气体,压强之比等于其物质的量之比也等于
其分子数目之比。
1.在某温度下,将0.1摩O2和0.4摩H2充入容积为2升的密闭容器中,测得其压强为1大气压,H2的压强是( )
A、0.2大气压 B、0.8大气压
C、1大气压 D、无法确定
B
推论5:同温同压同质量下,任何气体的体积之比与_________之比(即_______之比)成反比
V2 M1
V1 M2
=
推论4:同温同压同体积下,任何气体的质量之比等于_______之比(即_________之比)
m1 M1
m2 M2
=
摩尔质量
相对分子质量
摩尔质量
相对分子质量
例4、在同温同压下,同体积的下列气体,质量最大的是( )
A、O2 B、N2 C、Cl2 D、CO2
C
例5、同温同压下,等质量的二氧化碳和二氧化硫相比,下列叙述中正确的是( )
A、密度之比为16:11 B、密度之比为11:16
C、体积之比为11:16 D、物质的量之比为16:11
B D
1、下列说法正确的是( )
A 在标准状况下,1mol水和1molH2的体积都 约是22.4L
B 2gH2和44gCO2的体积相等
C 1mol某气体的体积为22.4L,则该气体一定处于标准状况
D 在标准状况下,1gH2和11.2LO2的物质的量相等
液体
条件不同,可能V不同
不一定
均为气体
D
巩固练习
2:同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的:
(1)物质的量之比为 ;
(2)分子数之比为_________;
(3)原子数之比为 ;
(4)质量之比为 ___________;
(5)摩尔质量之比为 ___________;
(6)密度之比为——————;
1:2
3:4
11:14
11:7
11:7
1:2
NO.2
摩尔质量 平均摩尔质量计算
(4)已知标准状况下气体的密度(ρ)求解:
M= 22 .4L/mol ×ρg/L
(1)由摩尔质量公式求解:M=m/n
1、摩尔质量
(2)M=m·NA/N=m(一个粒子)·NA,
(3)Mr=
(1)混合气体的平均式量:M(混)= m(总)/ n(总)
M=m总÷n总=(M1n1+M2n2+…+Mini) ÷n总=M1n1/n总+M2n2/n总+…+Mini/n总
=M1V1/V总+M2V2/V总+…+MiVi/V总
M=M1a1+M2a2+…+Miai
a1、a2、…、ai各气体组分的物质的量分数或体积分数。
2、平均摩尔质量
(2)由气体的相对密度求解
两种气体的密度之比称为相对密度。如A气体对B气体的相对密度用DB表示为:
由某气体对H2的相对密度,知
由某气体对空气的相对密度, 可知
练习1、标准状况下某气体的密度为2.56g/L,则该气体的相对分子质量是__________
2、空气中氮气氧气氩气的体积分数分别为78%、21%、1%,则空气的平均相对分子质量为_____
3、在一定条件校气体A可发生如下反应:
2A(气体)==B(气体)+3C(气体)
若在相同条件下所得混合气体对氢气的相对密度为4.25,则A的相对分子质量为___________
M=p22.4=2.56g/L×22.4L/mol
M=M1a1+M2a2+…+Miai
=28×78%+32×21%+40×1%
M(混)=D×M(H2)=4.25×2g/mol=8.5g/mol
由方程式可知2molA生成4mol混合气体,
结合M(混)可知2molA生成4mol×8.5g/mol=34g的混合气体
由质量守恒定律知1molA的质量为17g即M(A)=17g/mol
