浙教版科学2023-2024学年上学期九年级“冲刺重高”讲义(十七):物质的推断(含解析)
文档属性
| 名称 | 浙教版科学2023-2024学年上学期九年级“冲刺重高”讲义(十七):物质的推断(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 443.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-08-18 22:44:37 | ||
图片预览



文档简介
一、解题策略
1.以物质特征颜色为突破口
⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)。
⑵ 溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
⑶ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
⑷ 沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
2.以物质特征状态为突破口
常见固体单质有Fe、Cu、C、S;
气体单质有H2、N2、O2;
无色气体有H2、N2、O2、CO、CO2、CH4、SO2;
常温下呈液态的物质有H2O。
3.以物质特征反应条件为突破口
点燃(有O2参加的反应); 通电(电解H2O); 催化剂(KClO3分解制O2);
高温(CaCO3分解,C、CO还原CuO、Fe2O3);
加热(KCIO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
4.以物质特征现象为突破口
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体O2。
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气。
⑸ 在O2中燃烧火星四射的物质是Fe。
⑹ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
5.以元素或物质之最为突破口
⑴ 地壳中含量最多的元素是O,含量最多的金属元素是AI。
⑵ 人体中含量最多的元素是O。 ⑶ 空气中含量最多的元素是N。
⑷ 形成化合物最多的元素是C。 ⑸ 质子数最少的元素是H。
⑹ 相对分子质量最小、密度也最小的气体是H2。
⑺ 相对分子质量最小的氧化物是H2O。
⑻ 自然界中硬度最大的物质是金刚石。
⑼ 空气中含量最多的气体是N2。 ⑽ 最简单的有机物是CH4。
⑾ 最常用的溶剂是H2O。 ⑿ 人体中含量最多的物质是H2O。
二、解题技巧和思路
1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
3.解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
4.检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。若出现不符,则说明答案有误,需要另行思考,推出正确答案。
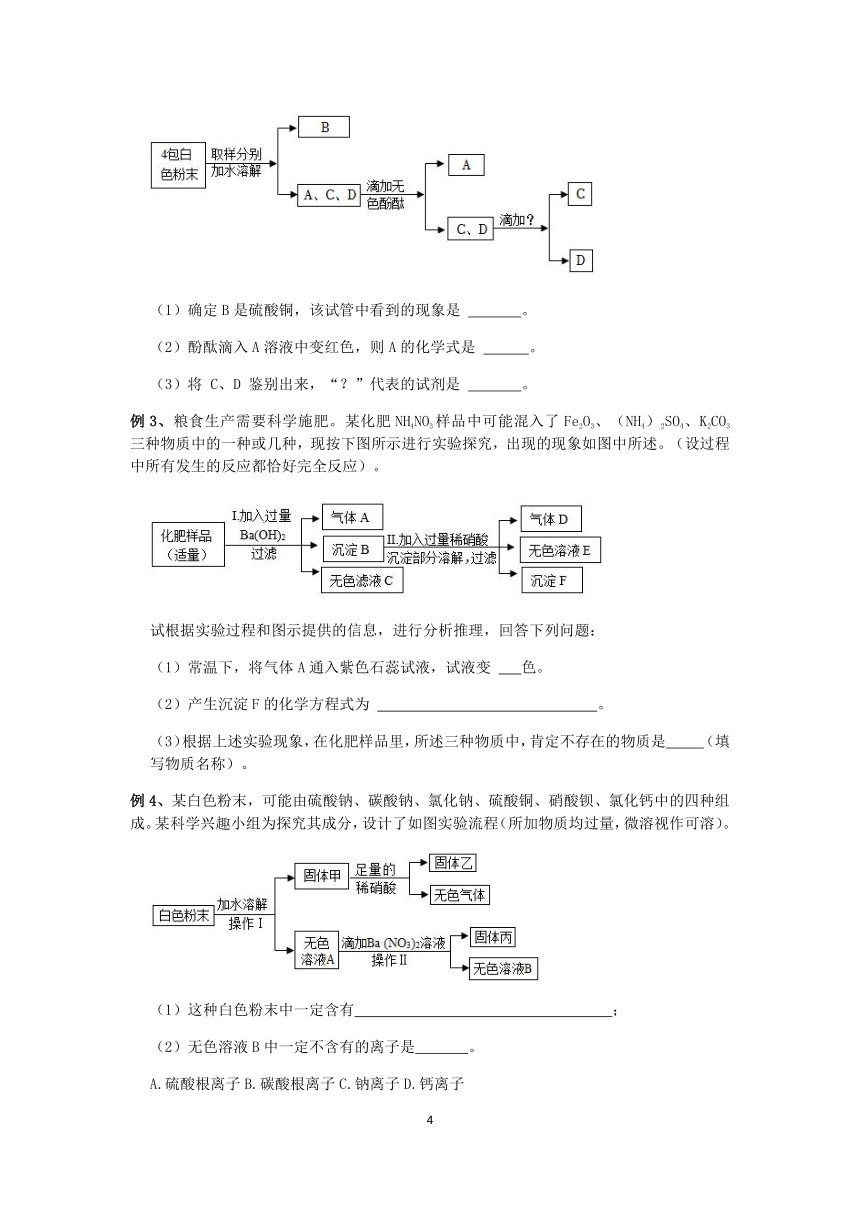
例1、有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH 中的一种或几种。小科进行如图所示的实验。
(1)由实验现象可知,滤渣成分是 。
(2)白色固体中一定不含有的是 。
(3)为了验证NaOH是否存在,还应该在加入酚酞试液前加入足量的 溶液。
例2、现有4包白色粉末,编号为A、B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。
(1)确定B是硫酸铜,该试管中看到的现象是 。
(2)酚酞滴入A溶液中变红色,则A的化学式是 。
(3)将 C、D 鉴别出来,“?”代表的试剂是 。
例3、粮食生产需要科学施肥。某化肥NH4NO3样品中可能混入了Fe2O3、(NH4)2SO4、K2CO3三种物质中的一种或几种,现按下图所示进行实验探究,出现的现象如图中所述。(设过程中所有发生的反应都恰好完全反应)。
试根据实验过程和图示提供的信息,进行分析推理,回答下列问题:
(1)常温下,将气体A通入紫色石蕊试液,试液变 色。
(2)产生沉淀F的化学方程式为 。
(3)根据上述实验现象,在化肥样品里,所述三种物质中,肯定不存在的物质是 (填写物质名称)。
例4、某白色粉末,可能由硫酸钠、碳酸钠、氯化钠、硫酸铜、硝酸钡、氯化钙中的四种组成。某科学兴趣小组为探究其成分,设计了如图实验流程(所加物质均过量,微溶视作可溶)。
(1)这种白色粉末中一定含有 ;
(2)无色溶液B中一定不含有的离子是 。
A.硫酸根离子B.碳酸根离子C.钠离子D.钙离子
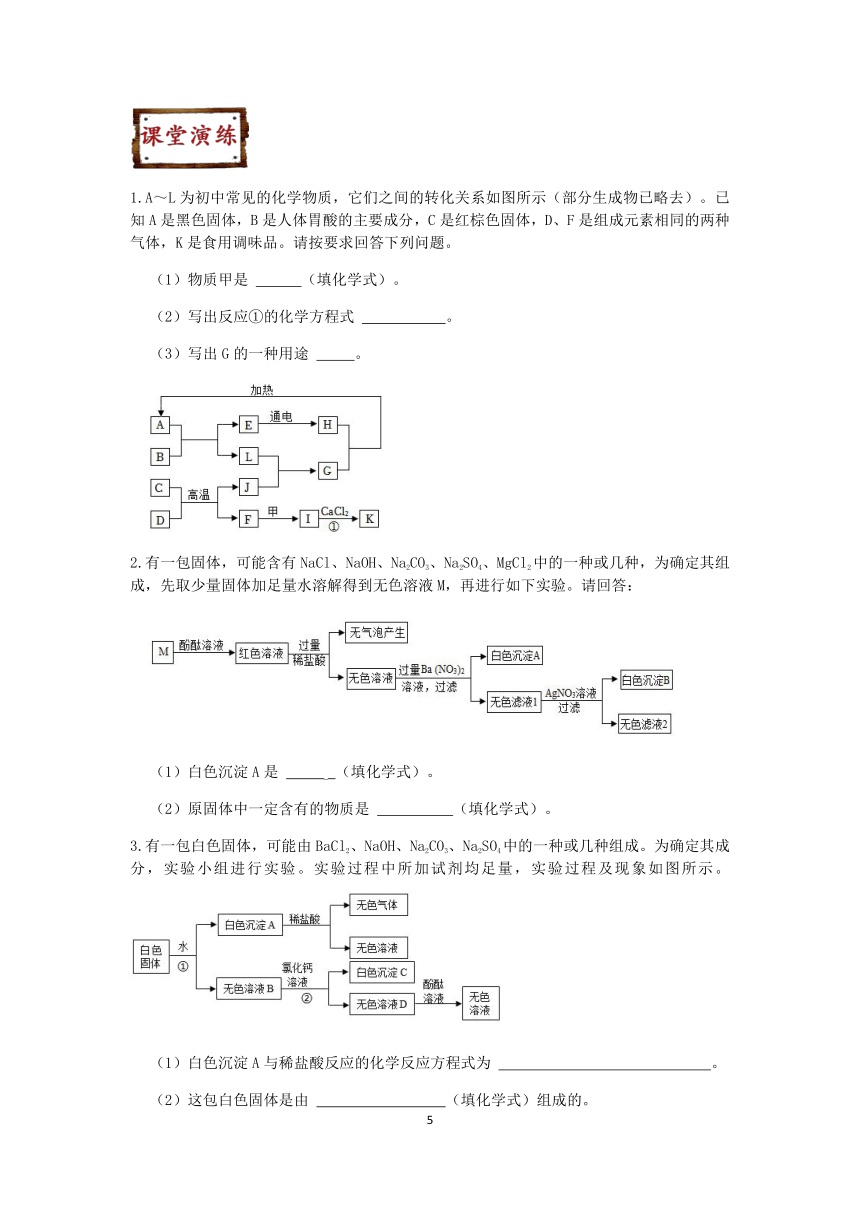
1.A~L为初中常见的化学物质,它们之间的转化关系如图所示(部分生成物已略去)。已知A是黑色固体,B是人体胃酸的主要成分,C是红棕色固体,D、F是组成元素相同的两种气体,K是食用调味品。请按要求回答下列问题。
(1)物质甲是 (填化学式)。
(2)写出反应①的化学方程式 。
(3)写出G的一种用途 。
2.有一包固体,可能含有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种,为确定其组成,先取少量固体加足量水溶解得到无色溶液M,再进行如下实验。请回答:
(1)白色沉淀A是 (填化学式)。
(2)原固体中一定含有的物质是 (填化学式)。
3.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为 。
(2)这包白色固体是由 (填化学式)组成的。
1.A~F是初中化学常见的六种物质,它们分别是单质、氧化物、有机物、酸、碱、盐中的一种,且均能通过化学反应生成水,如“雪花”图案所示(部分反应物、生成物和反应条件已略去)。已知A是稀盐酸,B是铁锈的主要成分,A能与某些金属反应生成D,且能与E发生中和反应,F是碳酸钠。
(1)D的化学式为 。
(2)A与B发生反应的现象是 。
(3)C属于上述物质类别中的 。
2.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为 。
(2)白色沉淀C的主要成分是 。
(3)这包白色固体是由 (填化学式)组成的。
3.我校化学兴趣小组调查某化工厂排放的废水。废水略显蓝色,无悬浮颗粒,透明。
实验过程:
①取少量废水加入过量的盐酸,有白色沉淀生成,过滤,得沉淀物和滤液。向沉淀中加入稀硝酸白色沉淀不溶解。
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸产生白色沉淀,过滤,向沉淀物中加入稀硝酸沉淀不溶解。
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀。
(1)实验结果:废水中肯定含有的阳离子有 ,它们都是重金属离子;还含有的大量的阴离子NO3﹣,对环境都有污染。
(2)针对上述情况,某同学设计了一种从废水中除去重金属离子的方案(已知白色的Fe(OH)2沉淀在氧气和水的存在下会转化成红褐色沉淀)假设能发生化学反应的物质均恰好完全反应,则:
X固体为 。
(3)B溶液中的溶质一定有 。
A.K2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
(4)写出④反应的化学方程式 。
答案及解析
例1、解:有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH 中的一种或几种。向白色固体中加足量的水过滤,得到滤渣和滤液,向滤渣中加入稀盐酸,滤渣全部消失并产生气泡,硫酸钠、碳酸钠和氯化钡反应分别生成硫酸钡沉淀和碳酸钡沉淀,硫酸钡不溶于稀盐酸,碳酸钡和稀盐酸反应生成二氧化碳气体,则白色固体中一定含有碳酸钠和氯化钡,一定不含硫酸钠;向滤液中滴加酚酞试剂,溶液变红,碳酸钠、氢氧化钠溶液都显碱性,都能使无色酚酞试剂变红,已经能确定有碳酸钠,则无法判断是否有氢氧化钠。
(1)由实验现象可知,滤渣成分是碳酸钡。
(2)白色固体中一定不含有的是硫酸钠。
(3)为了验证NaOH是否存在,还应该在加入酚酞试液前加入足量的氯化钡溶液,将碳酸钠全部除去。
故答案为:(1)碳酸钡;(2)硫酸钠;(3)氯化钡。
例2、解:(1)硫酸铜溶液呈蓝色,观察溶液的颜色可判断出硫酸铜。
(2)酚酞滴入A溶液中变红色,说明A为呈碱性的氢氧化钠,A的化学式是NaOH。
(3)氯化钠能与硝酸银溶液反应产生氯化银沉淀,硝酸钾与硝酸银溶液不反应,所以可利用加硝酸银溶液来鉴别两物质。
故答案为:(1)溶液呈蓝色;(2)NaOH;(3)硝酸银溶液。
例3、解:(1)由于硝酸铵能与氢氧化钡反应会生成氨气,则气体A为氨气,其水溶液显碱性,能使紫色石蕊试液变蓝色,故答案为:蓝;
(2)由于氢氧化钡能与硫酸铵反应生成硫酸钡沉淀,氢氧化钡能与碳酸钾反应生成碳酸钡沉淀,而生成的碳酸钡能与稀硝酸反应,但生成的硫酸钡沉淀不能与硝酸银反应,根据加入过量稀硝酸时,沉淀部分溶液解,则沉淀B一定有硫酸钡和碳酸钡,沉淀F为BaSO4,故化学方程式为:Ba(OH )2+(NH4)2SO4=BaSO4↓+2H2O+2NH3↑,故答案为:Ba(OH )2+(NH4)2SO4=BaSO4↓+2H2O+2NH3↑;
(3)由于氧化铁不能与氢氧化钡反应,但能与稀硝酸反应生成硝酸铁,而溶液中含有铁离子时显黄色,但最后得到的溶液E为无色,说明固体中肯定不存在Fe2O3,故答案为:Fe2O3。
例4、解:依据题意可知,白色粉末,可能由硫酸钠、碳酸钠、氯化钠、硫酸铜、硝酸钡、氯化钙中的四种组成,加水溶解,得固体甲和无色溶液A,固体中一定不含硫酸铜,向固体甲中加入足量稀硝酸,得固体乙和无色气体,说明固体甲含有硫酸钡和碳酸钡,可能含有碳酸钙,则固体中一定含有硫酸钠、碳酸钠、硝酸钡、可能含有氯化钙;向无色溶液A中滴加Ba(NO3)2溶液,得固体丙和无色溶液B,推出固体为硫酸钡、碳酸钡或他们中的一种,说明无色溶液A中含有SO42﹣、CO32﹣或它们中的一种,一定不含Ba2+,若有CO32﹣还一定不含Ca2+;若A中没有CO32﹣,还可能含Ca2+则B中一定不含SO42﹣、CO32﹣;
(1)通过以上分析可知,这种白色粉末中一定含有硫酸钠、碳酸钠、硝酸钡,一定不含硫酸铜,由于固体是的四种物质组成,则这种白色粉末中一定含有硫酸钠、碳酸钠、硝酸钡、氯化钠,或硫酸钠、碳酸钠、硝酸钡、氯化钙;故填:硫酸钠、碳酸钠、硝酸钡、氯化钠,或硫酸钠、碳酸钠、硝酸钡、氯化钙;
(2)通过以上分析可知,B中一定不含SO42﹣、CO32﹣;故填:AB。
1.解:(1)A~L为初中常见的化学物质,A是黑色固体,B是人体胃酸的主要成分,所以B是盐酸,C是红棕色固体,D、F是组成元素相同的两种气体,K是食用调味品,所以K是氯化钠,C和D高温会生成F和J,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,所以C是氧化铁,D是一氧化碳,F是二氧化碳,J是铁,I和氯化钙反应生成了氯化钠,所以I是碳酸钠,二氧化碳和甲反应生成碳酸钠,所以甲是氢氧化钠,A和盐酸反应生成会和L,L会与铁反应,所以A是氧化铜,L是氯化铜,水通电生成氢气和氧气,G和H会生成氧化铜,所以G是铜,H是氧气,经过验证,推导正确,所以物质甲是NaOH;
(2)反应①是碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)G的一种用途是:作导线。
故答案为:(1)NaOH;(2)Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)作导线。
2.解:(1)硫酸钠与硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,因此A是硫酸钡;故答案为:BaSO4;
(2)NaOH、MgCl2或Na2CO3、MgCl2不能共存;加入酚酞试液,显红色,说明溶液显碱性;加入过量的稀盐酸,没有气泡产生,说明一定没有碳酸钠,一定有氢氧化钠,一定没有氯化镁;硫酸钠与硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,因此A是硫酸钡,原固体中一定有硫酸钠;故答案为:氢氧化钠和硫酸钠。
3.解:(1)白色沉淀A是碳酸钡,碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳,反应的化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑。
(2)由分析可知,这包白色固体是由碳酸钠、氯化钡组成的混合物,化学式为:Na2CO3、BaCl2。
故答案为:(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;(2)Na2CO3、BaCl2
1.解:(1)由分析可知,D是氢气,故答案为:H2,故答案为:H2;
(2)A和B反应是稀盐酸和氧化铁反应生成氯化铁和水,反应的现象是固体逐渐溶解,溶液由无色变为黄色,故答案为:固体逐渐溶解,溶液由无色变为黄色;
(3)由上述分析可知,A是酸、B是氧化物、D是单质、E是碱、F是盐,则C是有机物,故答案为:有机物。
2.解:碳酸钠和氯化钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于酸的硫酸钠钡沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀,酚酞遇碱变红色,所以
白色固体加水得到白色沉淀A,白色沉淀A溶于盐酸,所以固体样品中一定含有氯化钡和碳酸钠,一定不含硫酸钠,无色滤液B和氯化钙反应生成白色沉淀,溶于D不能使酚酞变红色,所以样品中一定不含氢氧化钠,所以
(1)白色沉淀A与稀盐酸的反应是碳酸钡沉淀和盐酸反应生成氯化钡、水和二氧化碳,化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)白色沉淀C的化学式为CaCO3;
(3)这包白色固体是由BaCl2、Na2CO3组成的。
故答案为:(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;(2)CaCO3;(3)BaCl2、Na2CO3。
3.解:①取少量废水加入过量的盐酸,有白色沉淀生成,过滤,得沉淀物和滤液。向沉淀中加入稀硝酸白色沉淀不溶解,说明白色沉淀是氯化银,进一步说明废水中含有银离子。
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸产生白色沉淀,过滤,向沉淀物中加入稀硝酸沉淀不溶解,说明白色沉淀是硫酸钡,进一步说明废水中含有钡离子。
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀,蓝色沉淀是氢氧化铜,说明废水中含有铜离子。
(1)实验结果:废水中肯定含有的阳离子有Ag+、Ba2+、Cu2+,它们都是重金属离子;还含有的大量的阴离子NO3﹣,对环境都有污染。
故答案为:Ag+、Ba2+、Cu2+。
(2)X固体为Fe,加入铁,铁和银离子、铜离子反应生成亚铁离子、银和铜,亚铁离子和氢氧根离子结合生成氢氧化亚铁沉淀,氢氧化亚铁和水、氧气反应生成红褐色沉淀氢氧化铁。
故答案为:Fe。
(3)B溶液中的溶质一定有铁和硝酸银、硝酸银反应生成的硝酸亚铁、不能反应的硝酸钡。
故答案为:BD。
(4)④中硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,反应的化学方程式是Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3。
故答案为:Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3。
2023-2024学年上学期浙教版科学九年级“冲刺重高”讲义(十七)
物质的推断
1.以物质特征颜色为突破口
⑴ 固体颜色:Fe、C、CuO、MnO2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4·5H2O(蓝色)。
⑵ 溶液颜色:CuCl2、CuSO4(蓝色);FeCl2、FeSO4(浅绿色);FeCl3、Fe2(SO4)3(黄色)。
⑶ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色)。
⑷ 沉淀颜色:BaSO4、AgCl、CaCO3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色)。
2.以物质特征状态为突破口
常见固体单质有Fe、Cu、C、S;
气体单质有H2、N2、O2;
无色气体有H2、N2、O2、CO、CO2、CH4、SO2;
常温下呈液态的物质有H2O。
3.以物质特征反应条件为突破口
点燃(有O2参加的反应); 通电(电解H2O); 催化剂(KClO3分解制O2);
高温(CaCO3分解,C、CO还原CuO、Fe2O3);
加热(KCIO3、KMnO4、Cu2(OH)2CO3等的分解,H2还原CuO、Fe2O3)。
4.以物质特征现象为突破口
⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2。
⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C。
⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体O2。
⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气。
⑸ 在O2中燃烧火星四射的物质是Fe。
⑹ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH4、C2H5OH等。
⑺ 能溶于盐酸或稀HNO3的白色沉淀有CaCO3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4。
5.以元素或物质之最为突破口
⑴ 地壳中含量最多的元素是O,含量最多的金属元素是AI。
⑵ 人体中含量最多的元素是O。 ⑶ 空气中含量最多的元素是N。
⑷ 形成化合物最多的元素是C。 ⑸ 质子数最少的元素是H。
⑹ 相对分子质量最小、密度也最小的气体是H2。
⑺ 相对分子质量最小的氧化物是H2O。
⑻ 自然界中硬度最大的物质是金刚石。
⑼ 空气中含量最多的气体是N2。 ⑽ 最简单的有机物是CH4。
⑾ 最常用的溶剂是H2O。 ⑿ 人体中含量最多的物质是H2O。
二、解题技巧和思路
1.审题:认真审读原理,弄清文意和图意,理出题给条件,深挖细找,反复推敲。
2.分析:抓住关键,找准解题的突破口,突破口也称为“题眼”,指的是关键词、特殊现象、物质都特征等等,然后从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果。
3.解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答。
4.检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确。若出现不符,则说明答案有误,需要另行思考,推出正确答案。
例1、有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH 中的一种或几种。小科进行如图所示的实验。
(1)由实验现象可知,滤渣成分是 。
(2)白色固体中一定不含有的是 。
(3)为了验证NaOH是否存在,还应该在加入酚酞试液前加入足量的 溶液。
例2、现有4包白色粉末,编号为A、B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。
(1)确定B是硫酸铜,该试管中看到的现象是 。
(2)酚酞滴入A溶液中变红色,则A的化学式是 。
(3)将 C、D 鉴别出来,“?”代表的试剂是 。
例3、粮食生产需要科学施肥。某化肥NH4NO3样品中可能混入了Fe2O3、(NH4)2SO4、K2CO3三种物质中的一种或几种,现按下图所示进行实验探究,出现的现象如图中所述。(设过程中所有发生的反应都恰好完全反应)。
试根据实验过程和图示提供的信息,进行分析推理,回答下列问题:
(1)常温下,将气体A通入紫色石蕊试液,试液变 色。
(2)产生沉淀F的化学方程式为 。
(3)根据上述实验现象,在化肥样品里,所述三种物质中,肯定不存在的物质是 (填写物质名称)。
例4、某白色粉末,可能由硫酸钠、碳酸钠、氯化钠、硫酸铜、硝酸钡、氯化钙中的四种组成。某科学兴趣小组为探究其成分,设计了如图实验流程(所加物质均过量,微溶视作可溶)。
(1)这种白色粉末中一定含有 ;
(2)无色溶液B中一定不含有的离子是 。
A.硫酸根离子B.碳酸根离子C.钠离子D.钙离子
1.A~L为初中常见的化学物质,它们之间的转化关系如图所示(部分生成物已略去)。已知A是黑色固体,B是人体胃酸的主要成分,C是红棕色固体,D、F是组成元素相同的两种气体,K是食用调味品。请按要求回答下列问题。
(1)物质甲是 (填化学式)。
(2)写出反应①的化学方程式 。
(3)写出G的一种用途 。
2.有一包固体,可能含有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种,为确定其组成,先取少量固体加足量水溶解得到无色溶液M,再进行如下实验。请回答:
(1)白色沉淀A是 (填化学式)。
(2)原固体中一定含有的物质是 (填化学式)。
3.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为 。
(2)这包白色固体是由 (填化学式)组成的。
1.A~F是初中化学常见的六种物质,它们分别是单质、氧化物、有机物、酸、碱、盐中的一种,且均能通过化学反应生成水,如“雪花”图案所示(部分反应物、生成物和反应条件已略去)。已知A是稀盐酸,B是铁锈的主要成分,A能与某些金属反应生成D,且能与E发生中和反应,F是碳酸钠。
(1)D的化学式为 。
(2)A与B发生反应的现象是 。
(3)C属于上述物质类别中的 。
2.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验。实验过程中所加试剂均足量,实验过程及现象如图所示。
(1)白色沉淀A与稀盐酸反应的化学反应方程式为 。
(2)白色沉淀C的主要成分是 。
(3)这包白色固体是由 (填化学式)组成的。
3.我校化学兴趣小组调查某化工厂排放的废水。废水略显蓝色,无悬浮颗粒,透明。
实验过程:
①取少量废水加入过量的盐酸,有白色沉淀生成,过滤,得沉淀物和滤液。向沉淀中加入稀硝酸白色沉淀不溶解。
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸产生白色沉淀,过滤,向沉淀物中加入稀硝酸沉淀不溶解。
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀。
(1)实验结果:废水中肯定含有的阳离子有 ,它们都是重金属离子;还含有的大量的阴离子NO3﹣,对环境都有污染。
(2)针对上述情况,某同学设计了一种从废水中除去重金属离子的方案(已知白色的Fe(OH)2沉淀在氧气和水的存在下会转化成红褐色沉淀)假设能发生化学反应的物质均恰好完全反应,则:
X固体为 。
(3)B溶液中的溶质一定有 。
A.K2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
(4)写出④反应的化学方程式 。
答案及解析
例1、解:有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH 中的一种或几种。向白色固体中加足量的水过滤,得到滤渣和滤液,向滤渣中加入稀盐酸,滤渣全部消失并产生气泡,硫酸钠、碳酸钠和氯化钡反应分别生成硫酸钡沉淀和碳酸钡沉淀,硫酸钡不溶于稀盐酸,碳酸钡和稀盐酸反应生成二氧化碳气体,则白色固体中一定含有碳酸钠和氯化钡,一定不含硫酸钠;向滤液中滴加酚酞试剂,溶液变红,碳酸钠、氢氧化钠溶液都显碱性,都能使无色酚酞试剂变红,已经能确定有碳酸钠,则无法判断是否有氢氧化钠。
(1)由实验现象可知,滤渣成分是碳酸钡。
(2)白色固体中一定不含有的是硫酸钠。
(3)为了验证NaOH是否存在,还应该在加入酚酞试液前加入足量的氯化钡溶液,将碳酸钠全部除去。
故答案为:(1)碳酸钡;(2)硫酸钠;(3)氯化钡。
例2、解:(1)硫酸铜溶液呈蓝色,观察溶液的颜色可判断出硫酸铜。
(2)酚酞滴入A溶液中变红色,说明A为呈碱性的氢氧化钠,A的化学式是NaOH。
(3)氯化钠能与硝酸银溶液反应产生氯化银沉淀,硝酸钾与硝酸银溶液不反应,所以可利用加硝酸银溶液来鉴别两物质。
故答案为:(1)溶液呈蓝色;(2)NaOH;(3)硝酸银溶液。
例3、解:(1)由于硝酸铵能与氢氧化钡反应会生成氨气,则气体A为氨气,其水溶液显碱性,能使紫色石蕊试液变蓝色,故答案为:蓝;
(2)由于氢氧化钡能与硫酸铵反应生成硫酸钡沉淀,氢氧化钡能与碳酸钾反应生成碳酸钡沉淀,而生成的碳酸钡能与稀硝酸反应,但生成的硫酸钡沉淀不能与硝酸银反应,根据加入过量稀硝酸时,沉淀部分溶液解,则沉淀B一定有硫酸钡和碳酸钡,沉淀F为BaSO4,故化学方程式为:Ba(OH )2+(NH4)2SO4=BaSO4↓+2H2O+2NH3↑,故答案为:Ba(OH )2+(NH4)2SO4=BaSO4↓+2H2O+2NH3↑;
(3)由于氧化铁不能与氢氧化钡反应,但能与稀硝酸反应生成硝酸铁,而溶液中含有铁离子时显黄色,但最后得到的溶液E为无色,说明固体中肯定不存在Fe2O3,故答案为:Fe2O3。
例4、解:依据题意可知,白色粉末,可能由硫酸钠、碳酸钠、氯化钠、硫酸铜、硝酸钡、氯化钙中的四种组成,加水溶解,得固体甲和无色溶液A,固体中一定不含硫酸铜,向固体甲中加入足量稀硝酸,得固体乙和无色气体,说明固体甲含有硫酸钡和碳酸钡,可能含有碳酸钙,则固体中一定含有硫酸钠、碳酸钠、硝酸钡、可能含有氯化钙;向无色溶液A中滴加Ba(NO3)2溶液,得固体丙和无色溶液B,推出固体为硫酸钡、碳酸钡或他们中的一种,说明无色溶液A中含有SO42﹣、CO32﹣或它们中的一种,一定不含Ba2+,若有CO32﹣还一定不含Ca2+;若A中没有CO32﹣,还可能含Ca2+则B中一定不含SO42﹣、CO32﹣;
(1)通过以上分析可知,这种白色粉末中一定含有硫酸钠、碳酸钠、硝酸钡,一定不含硫酸铜,由于固体是的四种物质组成,则这种白色粉末中一定含有硫酸钠、碳酸钠、硝酸钡、氯化钠,或硫酸钠、碳酸钠、硝酸钡、氯化钙;故填:硫酸钠、碳酸钠、硝酸钡、氯化钠,或硫酸钠、碳酸钠、硝酸钡、氯化钙;
(2)通过以上分析可知,B中一定不含SO42﹣、CO32﹣;故填:AB。
1.解:(1)A~L为初中常见的化学物质,A是黑色固体,B是人体胃酸的主要成分,所以B是盐酸,C是红棕色固体,D、F是组成元素相同的两种气体,K是食用调味品,所以K是氯化钠,C和D高温会生成F和J,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,所以C是氧化铁,D是一氧化碳,F是二氧化碳,J是铁,I和氯化钙反应生成了氯化钠,所以I是碳酸钠,二氧化碳和甲反应生成碳酸钠,所以甲是氢氧化钠,A和盐酸反应生成会和L,L会与铁反应,所以A是氧化铜,L是氯化铜,水通电生成氢气和氧气,G和H会生成氧化铜,所以G是铜,H是氧气,经过验证,推导正确,所以物质甲是NaOH;
(2)反应①是碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)G的一种用途是:作导线。
故答案为:(1)NaOH;(2)Na2CO3+CaCl2=CaCO3↓+2NaCl;(3)作导线。
2.解:(1)硫酸钠与硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,因此A是硫酸钡;故答案为:BaSO4;
(2)NaOH、MgCl2或Na2CO3、MgCl2不能共存;加入酚酞试液,显红色,说明溶液显碱性;加入过量的稀盐酸,没有气泡产生,说明一定没有碳酸钠,一定有氢氧化钠,一定没有氯化镁;硫酸钠与硝酸钡反应生成硫酸钡白色沉淀和硝酸钠,因此A是硫酸钡,原固体中一定有硫酸钠;故答案为:氢氧化钠和硫酸钠。
3.解:(1)白色沉淀A是碳酸钡,碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳,反应的化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑。
(2)由分析可知,这包白色固体是由碳酸钠、氯化钡组成的混合物,化学式为:Na2CO3、BaCl2。
故答案为:(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;(2)Na2CO3、BaCl2
1.解:(1)由分析可知,D是氢气,故答案为:H2,故答案为:H2;
(2)A和B反应是稀盐酸和氧化铁反应生成氯化铁和水,反应的现象是固体逐渐溶解,溶液由无色变为黄色,故答案为:固体逐渐溶解,溶液由无色变为黄色;
(3)由上述分析可知,A是酸、B是氧化物、D是单质、E是碱、F是盐,则C是有机物,故答案为:有机物。
2.解:碳酸钠和氯化钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和氯化钡反应生成不溶于酸的硫酸钠钡沉淀,碳酸钠和氯化钙反应生成碳酸钙沉淀,酚酞遇碱变红色,所以
白色固体加水得到白色沉淀A,白色沉淀A溶于盐酸,所以固体样品中一定含有氯化钡和碳酸钠,一定不含硫酸钠,无色滤液B和氯化钙反应生成白色沉淀,溶于D不能使酚酞变红色,所以样品中一定不含氢氧化钠,所以
(1)白色沉淀A与稀盐酸的反应是碳酸钡沉淀和盐酸反应生成氯化钡、水和二氧化碳,化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)白色沉淀C的化学式为CaCO3;
(3)这包白色固体是由BaCl2、Na2CO3组成的。
故答案为:(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;(2)CaCO3;(3)BaCl2、Na2CO3。
3.解:①取少量废水加入过量的盐酸,有白色沉淀生成,过滤,得沉淀物和滤液。向沉淀中加入稀硝酸白色沉淀不溶解,说明白色沉淀是氯化银,进一步说明废水中含有银离子。
②将所得滤液分成两份,一份滤液中加入适量的稀硫酸产生白色沉淀,过滤,向沉淀物中加入稀硝酸沉淀不溶解,说明白色沉淀是硫酸钡,进一步说明废水中含有钡离子。
③向另一份滤液中加入过量氢氧化钠溶液,只产生蓝色沉淀,蓝色沉淀是氢氧化铜,说明废水中含有铜离子。
(1)实验结果:废水中肯定含有的阳离子有Ag+、Ba2+、Cu2+,它们都是重金属离子;还含有的大量的阴离子NO3﹣,对环境都有污染。
故答案为:Ag+、Ba2+、Cu2+。
(2)X固体为Fe,加入铁,铁和银离子、铜离子反应生成亚铁离子、银和铜,亚铁离子和氢氧根离子结合生成氢氧化亚铁沉淀,氢氧化亚铁和水、氧气反应生成红褐色沉淀氢氧化铁。
故答案为:Fe。
(3)B溶液中的溶质一定有铁和硝酸银、硝酸银反应生成的硝酸亚铁、不能反应的硝酸钡。
故答案为:BD。
(4)④中硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,反应的化学方程式是Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3。
故答案为:Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3。
2023-2024学年上学期浙教版科学九年级“冲刺重高”讲义(十七)
物质的推断
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
