化学人教版(2019)必修第一册1.3.3氧化还原反应方程式的配平与计算(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.3氧化还原反应方程式的配平与计算(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 50.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-19 11:22:52 | ||
图片预览











文档简介
(共30张PPT)
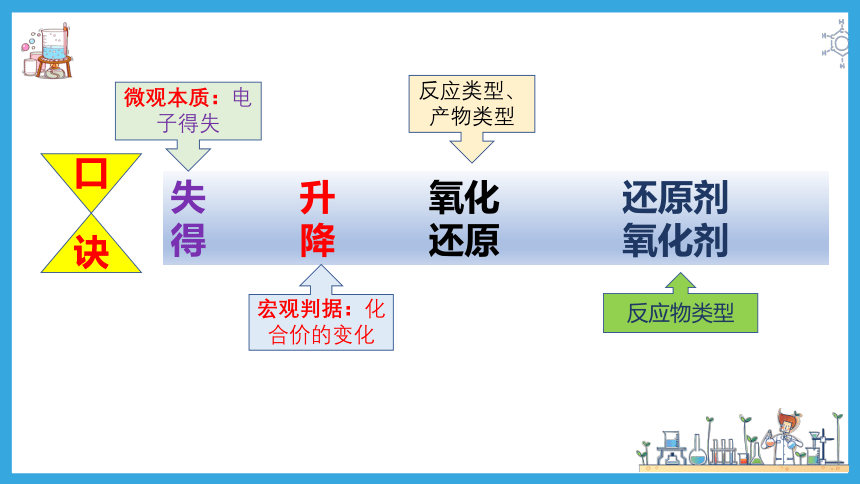
【温故知新,可以为师】
失 升 氧化 还原剂
得 降 还原 氧化剂
微观本质:电子得失
宏观判据:化合价的变化
反应类型、产物类型
反应物类型
口
诀
1.3 氧化还原反应
第三课时 氧化还原反应方程式的配平与计算
素养要求
1.能根据氧化还原反应的特征配平氧化还原反应方程式,能建构氧化还原反应配平的认识模型,培养证据推理与模型认知的核心素养。
2.能从元素价态变化的视角进行氧化还原反应的相关计算。
3.能根据氧化还原反应的特征和本质,理解氧化还原反应的基本规律,构建氧化还原反应规律的认识模型,培养证据推理与模型认知的核心素养。
1
价态规律及应用
元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,元素处于 时,只有氧化性(如KMnO4、HNO3等);元素处于最低价态时,只有 (如S2-、Br-等);元素处于_____ 时,既有氧化性又有还原性(如Fe2+、SO2等)。
预测物质的 和 。
最高价态
还原性
中间价态
氧化性
还原性
1.高低规律
(1)内容:
(2)应用:
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→ ,即“只靠拢,不交叉”“就近变价”。
中间价态
同种元素的物质间发生氧化还原反应时,氧化产物、还原产物的判断,电子转移总数的计算。
2.归中规律
(1)内容:
(2)图示表达如右:
(3)应用:
判断反应物和产物中同种元素价态的高低,计算电子转移的数目
降低
高价
3.歧化规律
(1)内容:
氧化还原反应中,有元素化合价升高,必然有元素化合价
。歧化反应时,某元素的中间价态―→ 态+低价态。
(2)应用:
(2)同一还原剂与多种氧化剂混合时, 的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+
>H+,所以铁粉先与 反应,然后再依次与 反应。
(1)同一氧化剂与多种还原剂混合时, 的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,氯气的量不足时首先氧化 ;把氯气通入FeI2溶液时,氯气的量不足时首先氧化 。
(3)应用:
还原性强
Fe2+
I-
氧化性强
Fe3+
Cu2+、H+
4.反应规律
判断物质的氧化性、还原性强弱或判断反应的先后顺序
典例分析
【例1】预测下列微粒的氧化性和还原性,并简单说明预测依据。
S2-、Fe2+、Mg2+、S、I-、H+
(1)Mg2+、H+只有_____性,预测依据________________________________。
(2)只有还原性的是________,预测依据___________________________ __
______________________________。
(3)既有氧化性又有还原性的是__________,预测依据__________________
_________________________________________________________________________________________。
氧化
元素处于最高价态时只具有氧化性
S2-、I-
二者分别是硫元素、碘元素的最低
价态,只能失去电子表现还原性
Fe2+、S
Fe2+既可以得电子降
为0价,也可以失电子升高到+3价,S可以得电子降为-2价,也可失电子升高到+4价或+6价
氧化还原反应方程式的配平,氧化还原反应的相关计算
5.守恒规律
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数
元素化合价降低的总数=元素化合价升高的总数
应用:
2
氧 化 还 原 反 应
方 程 式 的 配 平
1.氧化还原反应方程式配平的依据
(2)质量守恒:
(1)得失电子守恒:
氧化剂和还原剂得失电子总数相等
化合价升高总数=化合价降低总数
反应前后元素的种类和原子的个数不变
反应前后电荷总数不变
(3)电荷守恒(离子方程式):
以H2O2+H2CrO4——O2↑+Cr(OH)3↓+H2O为例
标出反应前后元素化合价的变化,分析“1分子氧化剂→还原产物”化合价降低数值,“1分子还原剂→氧化产物”化合价升高数值
2.氧化还原反应方程式配平的一般步骤--方法一
(1)标价态:
标出发生氧化反应和还原反应的元素的化合价
(2)列变化:
配出氧化剂、还原剂及氧化产物和还原产物的化学计量数
(3)求总数:
计算化合价升高总数与降低总数的最小公倍数为6,使化合价升高和降低的总数相等,即得失电子守恒。“×”后面的数字就是反应物或生成物的化学计量数。
3H2O2+2H2CrO4 —3O2↑+2Cr(OH)3↓+2H2O
(4)根据原子守恒配平其他物质的化学计量数
原子个数是否守恒,配平后,把单线改成等号,标注反应条件
3H2O2+2H2CrO4 = 3O2↑+2Cr(OH)3↓+2H2O
(5)查守恒:
典例分析
【例2】配平下列化学方程式。
(1)____Mg+____CO2 ____C+____MgO
(2)___Na2SO3+___KIO3+___H2SO4=___Na2SO4+__K2SO4+__I2+__H2O
2
1
1
2
5
2
1
5
1
1
1
以H2O2+H2CrO4——O2↑+Cr(OH)3↓+H2O为例
标出反应前后元素化合价的变化,在正下方标出单个分子的变化值
2.氧化还原反应方程式配平的一般步骤--方法二
(1)标价态:
标出发生氧化反应和还原反应的元素的化合价
(2)列变化:
2
3
(3)交叉配平:
氧化剂的化合价的变化为还原剂的计量数;还原剂的化合价的变化为氧化剂的计量数;
3H2O2+2H2CrO4 —3O2↑+2Cr(OH)3↓+2H2O
2
3
原子个数是否守恒,配平后,把单线改成等号,标注反应条件
(5)查守恒:
4
7
2
4
1
6
1
3
3
(3)__FeS+__O2 __Fe2O3+__SO2
(4)____KClO3+____HCl(浓)===____KCl+____Cl2↑+____H2O
(1)逆向配平法
2、配平氧化还原反应方程式的常用技巧
分解反应、歧化反应、部分氧化还原反应,一般使用逆向配平的方法,即先从氧化产物和还原产物开始配平
____S+____KOH ____K2S+____K2SO3+____H2O
2
1
3
6
3
首先根据得失电子守恒和原子守恒配平氧化剂、还原剂和氧化产物、还原产物,根据电荷守恒,配平离子方程式两边电荷数,最后根据原子守恒配平未变价元素的原子。
(2)离子方程式的配平
6
5
8
2
5
2
(3)缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]
②当化学方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
10
8
2
16H+
2
5
①补项原则
条件 补项原则
酸性条件 缺H或多O补H+,少O补H2O
碱性条件 缺H或多O补H2O,少O补OH-
典例分析
【例3】配平下列氧化还原反应方程式。
(1)正向配平
①___KI+___KIO3+_____H2SO4===_____I2+_____K2SO4+_____H2O
②___MnO4- +___H++___Cl-===___Mn2++____Cl2↑+____H2O
(2)逆向配平
①____P4+____KOH+____H2O===____K3PO4+____PH3↑
②____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+____H2O
5
1
3
3
3
3
2
16
10
2
5
8
2
9
3
3
5
3
8
3
2
4
(3)缺项配平
①___ClO-+___Fe(OH)3+_______===___Cl-+___ +___H2O
②___Mn2++___ +___H2O===___MnO2↓+___Cl2↑+_____
3
2
4OH-
3
2
5
5
2
4
5
1
8H+
氧化还原反应方程式的配平技巧
(1)根据得失电子守恒配平氧化剂和还原剂(或还原产物和氧化产物)。
(2)根据原子守恒配平变价元素原子。
(3)根据电荷守恒和溶液的环境,常用H+或OH-平衡电荷。
(4)根据原子守恒,配平未变价元素原子。
返回
3.有关氧化还原反应的计算
1.计算依据——得失电子守恒
反应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即得失电子守恒。可以理解为下列等量关系:
(1)化合价升高总数=化合价降低总数
(2)失电子总数=得电子总数=转移电子数
(3)化合价升降总数=得失电子总数
2.解题流程
典例分析
【例4】.(2023·南昌质检)检验加“碘”盐含“KIO3”可通过在酸性条件下,加入碘化钾溶液和淀粉来实现。反应原理如下:KIO3+KI+HCl―→I2+KCl+H2O(未配平)。下列有关说法正确的是
A.KI是氧化剂 B.该反应配平后化学计量数依次为1,5,6,3,6,3
C.KIO3被氧化 D.每生成3个I2分子,转移6个电子
B
D
A.+3 B.+4 C.+5 D.+6
【素养反馈】
1.能根据价态规律预测物质的性质及产物。
2.能利用氧化性、还原性的强弱判断物质发生反应的先后及发生反应的可能性。
3.利用电子守恒规律进行简单的计算。
3
课堂检测
A.5∶3 B.5∶4 C.1∶1 D.3∶5
A
5.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧元素为-1价)―→Na2FeO4+Na2O(未配平),下列说法不正确的是( )
A.Na2FeO4能消毒杀菌是因其具有强氧化性
B.Fe2O3在反应中失去电子
C.配平后为Fe2O3+3Na2O2===2Na2FeO4+Na2O
D.Na2O2既是氧化剂又是还原剂
D
3.配平下列化学方程式。
2
2
3
3
6
5
1
3
3
4
3
1
6
(5)__KMnO4+___FeSO4+__H2SO4=__K2SO4+___MnSO4+__Fe2(SO4)3+___H2O
(6)___Au2O3+___Na2S2O3+___NaOH===___Au2O+___Na2SO4+___H2O
1
6
3
3
2
10
8
1
2
5
8
2
1
2
2
2
1
1
【温故知新,可以为师】
失 升 氧化 还原剂
得 降 还原 氧化剂
微观本质:电子得失
宏观判据:化合价的变化
反应类型、产物类型
反应物类型
口
诀
1.3 氧化还原反应
第三课时 氧化还原反应方程式的配平与计算
素养要求
1.能根据氧化还原反应的特征配平氧化还原反应方程式,能建构氧化还原反应配平的认识模型,培养证据推理与模型认知的核心素养。
2.能从元素价态变化的视角进行氧化还原反应的相关计算。
3.能根据氧化还原反应的特征和本质,理解氧化还原反应的基本规律,构建氧化还原反应规律的认识模型,培养证据推理与模型认知的核心素养。
1
价态规律及应用
元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,元素处于 时,只有氧化性(如KMnO4、HNO3等);元素处于最低价态时,只有 (如S2-、Br-等);元素处于_____ 时,既有氧化性又有还原性(如Fe2+、SO2等)。
预测物质的 和 。
最高价态
还原性
中间价态
氧化性
还原性
1.高低规律
(1)内容:
(2)应用:
同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→ ,即“只靠拢,不交叉”“就近变价”。
中间价态
同种元素的物质间发生氧化还原反应时,氧化产物、还原产物的判断,电子转移总数的计算。
2.归中规律
(1)内容:
(2)图示表达如右:
(3)应用:
判断反应物和产物中同种元素价态的高低,计算电子转移的数目
降低
高价
3.歧化规律
(1)内容:
氧化还原反应中,有元素化合价升高,必然有元素化合价
。歧化反应时,某元素的中间价态―→ 态+低价态。
(2)应用:
(2)同一还原剂与多种氧化剂混合时, 的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+
>H+,所以铁粉先与 反应,然后再依次与 反应。
(1)同一氧化剂与多种还原剂混合时, 的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,氯气的量不足时首先氧化 ;把氯气通入FeI2溶液时,氯气的量不足时首先氧化 。
(3)应用:
还原性强
Fe2+
I-
氧化性强
Fe3+
Cu2+、H+
4.反应规律
判断物质的氧化性、还原性强弱或判断反应的先后顺序
典例分析
【例1】预测下列微粒的氧化性和还原性,并简单说明预测依据。
S2-、Fe2+、Mg2+、S、I-、H+
(1)Mg2+、H+只有_____性,预测依据________________________________。
(2)只有还原性的是________,预测依据___________________________ __
______________________________。
(3)既有氧化性又有还原性的是__________,预测依据__________________
_________________________________________________________________________________________。
氧化
元素处于最高价态时只具有氧化性
S2-、I-
二者分别是硫元素、碘元素的最低
价态,只能失去电子表现还原性
Fe2+、S
Fe2+既可以得电子降
为0价,也可以失电子升高到+3价,S可以得电子降为-2价,也可失电子升高到+4价或+6价
氧化还原反应方程式的配平,氧化还原反应的相关计算
5.守恒规律
氧化还原反应中,原子得失电子总数相等,元素化合价升降总数相等,即有关系式:
还原剂失电子的总数=氧化剂得电子的总数
元素化合价降低的总数=元素化合价升高的总数
应用:
2
氧 化 还 原 反 应
方 程 式 的 配 平
1.氧化还原反应方程式配平的依据
(2)质量守恒:
(1)得失电子守恒:
氧化剂和还原剂得失电子总数相等
化合价升高总数=化合价降低总数
反应前后元素的种类和原子的个数不变
反应前后电荷总数不变
(3)电荷守恒(离子方程式):
以H2O2+H2CrO4——O2↑+Cr(OH)3↓+H2O为例
标出反应前后元素化合价的变化,分析“1分子氧化剂→还原产物”化合价降低数值,“1分子还原剂→氧化产物”化合价升高数值
2.氧化还原反应方程式配平的一般步骤--方法一
(1)标价态:
标出发生氧化反应和还原反应的元素的化合价
(2)列变化:
配出氧化剂、还原剂及氧化产物和还原产物的化学计量数
(3)求总数:
计算化合价升高总数与降低总数的最小公倍数为6,使化合价升高和降低的总数相等,即得失电子守恒。“×”后面的数字就是反应物或生成物的化学计量数。
3H2O2+2H2CrO4 —3O2↑+2Cr(OH)3↓+2H2O
(4)根据原子守恒配平其他物质的化学计量数
原子个数是否守恒,配平后,把单线改成等号,标注反应条件
3H2O2+2H2CrO4 = 3O2↑+2Cr(OH)3↓+2H2O
(5)查守恒:
典例分析
【例2】配平下列化学方程式。
(1)____Mg+____CO2 ____C+____MgO
(2)___Na2SO3+___KIO3+___H2SO4=___Na2SO4+__K2SO4+__I2+__H2O
2
1
1
2
5
2
1
5
1
1
1
以H2O2+H2CrO4——O2↑+Cr(OH)3↓+H2O为例
标出反应前后元素化合价的变化,在正下方标出单个分子的变化值
2.氧化还原反应方程式配平的一般步骤--方法二
(1)标价态:
标出发生氧化反应和还原反应的元素的化合价
(2)列变化:
2
3
(3)交叉配平:
氧化剂的化合价的变化为还原剂的计量数;还原剂的化合价的变化为氧化剂的计量数;
3H2O2+2H2CrO4 —3O2↑+2Cr(OH)3↓+2H2O
2
3
原子个数是否守恒,配平后,把单线改成等号,标注反应条件
(5)查守恒:
4
7
2
4
1
6
1
3
3
(3)__FeS+__O2 __Fe2O3+__SO2
(4)____KClO3+____HCl(浓)===____KCl+____Cl2↑+____H2O
(1)逆向配平法
2、配平氧化还原反应方程式的常用技巧
分解反应、歧化反应、部分氧化还原反应,一般使用逆向配平的方法,即先从氧化产物和还原产物开始配平
____S+____KOH ____K2S+____K2SO3+____H2O
2
1
3
6
3
首先根据得失电子守恒和原子守恒配平氧化剂、还原剂和氧化产物、还原产物,根据电荷守恒,配平离子方程式两边电荷数,最后根据原子守恒配平未变价元素的原子。
(2)离子方程式的配平
6
5
8
2
5
2
(3)缺项配平类[一般缺的为酸(H+)、碱(OH-)、水]
②当化学方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
10
8
2
16H+
2
5
①补项原则
条件 补项原则
酸性条件 缺H或多O补H+,少O补H2O
碱性条件 缺H或多O补H2O,少O补OH-
典例分析
【例3】配平下列氧化还原反应方程式。
(1)正向配平
①___KI+___KIO3+_____H2SO4===_____I2+_____K2SO4+_____H2O
②___MnO4- +___H++___Cl-===___Mn2++____Cl2↑+____H2O
(2)逆向配平
①____P4+____KOH+____H2O===____K3PO4+____PH3↑
②____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+____H2O
5
1
3
3
3
3
2
16
10
2
5
8
2
9
3
3
5
3
8
3
2
4
(3)缺项配平
①___ClO-+___Fe(OH)3+_______===___Cl-+___ +___H2O
②___Mn2++___ +___H2O===___MnO2↓+___Cl2↑+_____
3
2
4OH-
3
2
5
5
2
4
5
1
8H+
氧化还原反应方程式的配平技巧
(1)根据得失电子守恒配平氧化剂和还原剂(或还原产物和氧化产物)。
(2)根据原子守恒配平变价元素原子。
(3)根据电荷守恒和溶液的环境,常用H+或OH-平衡电荷。
(4)根据原子守恒,配平未变价元素原子。
返回
3.有关氧化还原反应的计算
1.计算依据——得失电子守恒
反应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即得失电子守恒。可以理解为下列等量关系:
(1)化合价升高总数=化合价降低总数
(2)失电子总数=得电子总数=转移电子数
(3)化合价升降总数=得失电子总数
2.解题流程
典例分析
【例4】.(2023·南昌质检)检验加“碘”盐含“KIO3”可通过在酸性条件下,加入碘化钾溶液和淀粉来实现。反应原理如下:KIO3+KI+HCl―→I2+KCl+H2O(未配平)。下列有关说法正确的是
A.KI是氧化剂 B.该反应配平后化学计量数依次为1,5,6,3,6,3
C.KIO3被氧化 D.每生成3个I2分子,转移6个电子
B
D
A.+3 B.+4 C.+5 D.+6
【素养反馈】
1.能根据价态规律预测物质的性质及产物。
2.能利用氧化性、还原性的强弱判断物质发生反应的先后及发生反应的可能性。
3.利用电子守恒规律进行简单的计算。
3
课堂检测
A.5∶3 B.5∶4 C.1∶1 D.3∶5
A
5.用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧元素为-1价)―→Na2FeO4+Na2O(未配平),下列说法不正确的是( )
A.Na2FeO4能消毒杀菌是因其具有强氧化性
B.Fe2O3在反应中失去电子
C.配平后为Fe2O3+3Na2O2===2Na2FeO4+Na2O
D.Na2O2既是氧化剂又是还原剂
D
3.配平下列化学方程式。
2
2
3
3
6
5
1
3
3
4
3
1
6
(5)__KMnO4+___FeSO4+__H2SO4=__K2SO4+___MnSO4+__Fe2(SO4)3+___H2O
(6)___Au2O3+___Na2S2O3+___NaOH===___Au2O+___Na2SO4+___H2O
1
6
3
3
2
10
8
1
2
5
8
2
1
2
2
2
1
1
