化学人教版(2019)必修第一册1.3.1氧化还原反应的概念(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应的概念(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 25.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-19 11:25:47 | ||
图片预览








文档简介
(共25张PPT)
第三节 氧化还原反应
第一章 物质及其变化
第1课时:氧化还原反应的概念
目 录
CONTENTS
01
不同角度认识氧化还原反应
02
与四种基本反应类型的关系
学习目标
1.能够从化合价变化和电子转移的角度认识氧化还原反应,并会分析判断。
2.理解氧化还原反应与四种基本反应类型的关系,能够正确识别化合、分解、置换反应中的氧化还原反应。
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有2个视频,根据需要选择即时播放。
视频清单
①为什么苹果削皮后颜色很快会变暗
②氯化钠的微观反应历程
致老师和同学们
新课导入
为什么苹果削皮后颜色很快会变暗?
1
不同角度认识氧化还原反应
CuO、Fe2O3
C、CO
还原反应
氧化反应
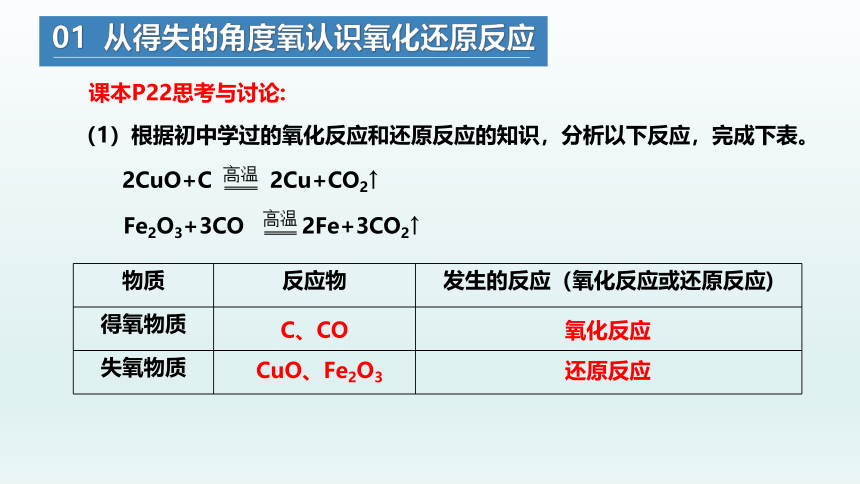
课本P22思考与讨论:
(1)根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑
Fe2O3+3CO 2Fe+3CO2↑
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
01 从得失的角度氧认识氧化还原反应
在所列下面的两个反应中是否只发生了氧化反应或还原反应?
CuO+H2 Cu+ H2O
3CO+Fe2O3 2Fe+3CO2
发生了氧化反应
发生了还原反应
Fe2O3
Fe
得到O
CO
失去O
CO2
CuO
得到O
失去O
Cu
H2
H2O
发生了还原反应
发生了氧化反应
可见,有得必有失,有物质得到氧,必定有另一物质失去氧。
氧化反应和还原反应同时发生,相互依存,把这样的反应称为氧化还原反应。
01 从得失的角度氧认识氧化还原反应
2CuO + C
2Cu + CO2
+2 -2 0 0 +4 -2
化合价降低,
化合价升高,
失氧,还原反应
得氧,氧化反应
化合价降低
化合价升高,
失氧,还原反应
Fe2O 3 + 3CO 2Fe + 3CO2
+3 -2 +2-2 0 +4-2
得氧,氧化反应
元素化合价升高 → 氧化反应
元素化合价降低 → 还原反应
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
课本P22思考与讨论:
02 从化合价的角度氧认识氧化还原反应
虽然没有物质得氧、失氧,但反应前后却有元素化合价的变化。
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
02 从化合价的角度氧认识氧化还原反应
得失氧是狭隘的判断方式,元素化合价的变化是氧化还原反应
的重要特征(特征判据)。
Fe元素的化合价从0升高到+2,发生氧化反应;
Cu元素的化合价从+2降低到0,发生还原反应。
这样的反应也是氧化还原反应。
一、氧化还原反应
1.定义:有元素化合价升降的化反应都是氧化还原反应。
——氧化还原反应的特征 。
2Na+Cl2 =2NaCl
H2+Cl2 =2HCl
√
√
02 从化合价的角度氧认识氧化还原反应
反应前后有元素化合价变化,是氧化还原反应的重要特征。
那么是什么原因导致元素化合价的变化呢?
即氧化还原反应的本质是什么?
氯化钠的微观反应历程视频
03 从电子转移的角度氧认识氧化还原反应
Na
Cl
Na+
Cl-
2Na+ Cl2 = 2NaCl
e-
0
+1
0
-1
失去电子
得到电子
化合价升高 被氧化
Na+
Cl-
化合价降低 被还原
8
1
+11
2
+17
8
7
2
8
+11
2
8
8
+17
2
氯化钠的形成示意图
03 从电子转移的角度氧认识氧化还原反应
结论:化合价升降的原因——电子得失
氯化氢的形成过程
+1
+17
Cl
H
共用电子对
03 从电子转移的角度氧认识氧化还原反应
氯化氢的形成,是不是跟氯化钠一样,也是电子的得失呢?
偏向
偏离
结论:化合价升降的原因--共用电子对偏移
一、氧化还原反应
2.本质:氧化还原反应的本质是有电子转移(包含电子的得失或共用电子对的偏移)。
03 从电子转移的角度氧认识氧化还原反应
氧化还原反应中一定存在电子的转移,有的是电子得失,有的是共用电子对偏移。这是氧化还原反应的本质。
元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;
元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
氧化还原反应的宏观特征
氧化还原反应的微观本质
元素化合价的升降
电子的转移
(电子的得失或共用电子对的偏移)
根本原因
氧化还原反应的实质:
失电子或电子对偏离
化合价升高
被氧化
得电子或电子对偏向
化合价降低
被还原
还原反应
简记:升失氧,降得还
氧化反应
04 多角度氧认识氧化还原反应
2
与四种基本反应类型的关系
①PCl3+Cl2=PCl5
②Na2O+H2O=2NaOH
③NH4HCO3=NH3↑+H2O+CO2↑
④2KClO3 2KCl+3O2↑
⑤Zn+H2SO4=ZnSO4+H2↑
⑥Cu+2AgNO3=Cu(NO3)2+2Ag
⑦NaOH+HCl=NaCl+H2O
⑧2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
△
MnO2
化合
分解
置换
复分解
√
×
×
√
√
√
×
×
判断是否为氧化还原反应依据:元素化合价是否有升降
05 与四种基本反应类型的关系
【实践活动】判断下列反应是否为氧化还原反应?
(4)分解和化合反应可能是氧化还原反应
(1)所有置换反应都属于氧化还原反应
(2)所有复分解反应都是非氧化还原反应
(3)有单质参加的化合和有单质生成的分解是氧化还原反应
05 与四种基本反应类型的关系
从上面几组练习可以看出四种基本反应类型与氧化还原反应有什么关系?
二、四种基本反应类型与氧化还原反应的关系
05 与四种基本反应类型的关系
06 对 点 训 练
【典例1】化学反应中,属于氧化还原反应的是( )
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Zn+CuSO4=Cu+ZnSO4
C.2NaHCO3=Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
B
【典例2】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4===FeSO4+Cu
B.AgNO3+NaCl===AgCl↓+NaNO3
C.Fe2O3+3CO Fe+3CO2
D.2KMnO4 K2MnO4+MnO2+O2↑
C
06 对 点 训 练
【典例3】在下列三个化学反应中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )
A
06 对 点 训 练
①N2+O2 2NO②4AgNO3 2Ag2O+4NO2↑+O2↑③2NH4Cl+Ba(OH)2 BaCl2+2NH3↑+2H2OA.①②③ B.②①③C.③②① D.③①②
【典例4】在钢铁的冶炼中,常将CO气体通入红热的氧化铁中,发生的反应是:Fe2O3+3CO Fe+3CO2。请填空:
(1)在上述反应中, 元素的化合价升高,则该元素的原子 电子,发生氧化反应;而 元素的化合价降低,则该元素的原子得到电子,发生 反应.
(2)该反应中 是氧化剂,发生了 反应;
是还原剂,发生了 反应.
【答案】(1)碳;失去;铁;还原;
(2)Fe2O3;还原; CO;氧化
06 对 点 训 练
谢谢观赏
第三节 氧化还原反应
第一章 物质及其变化
第1课时:氧化还原反应的概念
目 录
CONTENTS
01
不同角度认识氧化还原反应
02
与四种基本反应类型的关系
学习目标
1.能够从化合价变化和电子转移的角度认识氧化还原反应,并会分析判断。
2.理解氧化还原反应与四种基本反应类型的关系,能够正确识别化合、分解、置换反应中的氧化还原反应。
(本页可根据需要自行删除)
①由于ppt含较多高质量素材和视频,故资源比较大。
②所用视频均内嵌在ppt中,不需要另外下载。本节共有2个视频,根据需要选择即时播放。
视频清单
①为什么苹果削皮后颜色很快会变暗
②氯化钠的微观反应历程
致老师和同学们
新课导入
为什么苹果削皮后颜色很快会变暗?
1
不同角度认识氧化还原反应
CuO、Fe2O3
C、CO
还原反应
氧化反应
课本P22思考与讨论:
(1)根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑
Fe2O3+3CO 2Fe+3CO2↑
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
01 从得失的角度氧认识氧化还原反应
在所列下面的两个反应中是否只发生了氧化反应或还原反应?
CuO+H2 Cu+ H2O
3CO+Fe2O3 2Fe+3CO2
发生了氧化反应
发生了还原反应
Fe2O3
Fe
得到O
CO
失去O
CO2
CuO
得到O
失去O
Cu
H2
H2O
发生了还原反应
发生了氧化反应
可见,有得必有失,有物质得到氧,必定有另一物质失去氧。
氧化反应和还原反应同时发生,相互依存,把这样的反应称为氧化还原反应。
01 从得失的角度氧认识氧化还原反应
2CuO + C
2Cu + CO2
+2 -2 0 0 +4 -2
化合价降低,
化合价升高,
失氧,还原反应
得氧,氧化反应
化合价降低
化合价升高,
失氧,还原反应
Fe2O 3 + 3CO 2Fe + 3CO2
+3 -2 +2-2 0 +4-2
得氧,氧化反应
元素化合价升高 → 氧化反应
元素化合价降低 → 还原反应
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
课本P22思考与讨论:
02 从化合价的角度氧认识氧化还原反应
虽然没有物质得氧、失氧,但反应前后却有元素化合价的变化。
Fe+ CuSO4 FeSO4+Cu
0 +2 +2 0
02 从化合价的角度氧认识氧化还原反应
得失氧是狭隘的判断方式,元素化合价的变化是氧化还原反应
的重要特征(特征判据)。
Fe元素的化合价从0升高到+2,发生氧化反应;
Cu元素的化合价从+2降低到0,发生还原反应。
这样的反应也是氧化还原反应。
一、氧化还原反应
1.定义:有元素化合价升降的化反应都是氧化还原反应。
——氧化还原反应的特征 。
2Na+Cl2 =2NaCl
H2+Cl2 =2HCl
√
√
02 从化合价的角度氧认识氧化还原反应
反应前后有元素化合价变化,是氧化还原反应的重要特征。
那么是什么原因导致元素化合价的变化呢?
即氧化还原反应的本质是什么?
氯化钠的微观反应历程视频
03 从电子转移的角度氧认识氧化还原反应
Na
Cl
Na+
Cl-
2Na+ Cl2 = 2NaCl
e-
0
+1
0
-1
失去电子
得到电子
化合价升高 被氧化
Na+
Cl-
化合价降低 被还原
8
1
+11
2
+17
8
7
2
8
+11
2
8
8
+17
2
氯化钠的形成示意图
03 从电子转移的角度氧认识氧化还原反应
结论:化合价升降的原因——电子得失
氯化氢的形成过程
+1
+17
Cl
H
共用电子对
03 从电子转移的角度氧认识氧化还原反应
氯化氢的形成,是不是跟氯化钠一样,也是电子的得失呢?
偏向
偏离
结论:化合价升降的原因--共用电子对偏移
一、氧化还原反应
2.本质:氧化还原反应的本质是有电子转移(包含电子的得失或共用电子对的偏移)。
03 从电子转移的角度氧认识氧化还原反应
氧化还原反应中一定存在电子的转移,有的是电子得失,有的是共用电子对偏移。这是氧化还原反应的本质。
元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;
元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
氧化还原反应的宏观特征
氧化还原反应的微观本质
元素化合价的升降
电子的转移
(电子的得失或共用电子对的偏移)
根本原因
氧化还原反应的实质:
失电子或电子对偏离
化合价升高
被氧化
得电子或电子对偏向
化合价降低
被还原
还原反应
简记:升失氧,降得还
氧化反应
04 多角度氧认识氧化还原反应
2
与四种基本反应类型的关系
①PCl3+Cl2=PCl5
②Na2O+H2O=2NaOH
③NH4HCO3=NH3↑+H2O+CO2↑
④2KClO3 2KCl+3O2↑
⑤Zn+H2SO4=ZnSO4+H2↑
⑥Cu+2AgNO3=Cu(NO3)2+2Ag
⑦NaOH+HCl=NaCl+H2O
⑧2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
△
MnO2
化合
分解
置换
复分解
√
×
×
√
√
√
×
×
判断是否为氧化还原反应依据:元素化合价是否有升降
05 与四种基本反应类型的关系
【实践活动】判断下列反应是否为氧化还原反应?
(4)分解和化合反应可能是氧化还原反应
(1)所有置换反应都属于氧化还原反应
(2)所有复分解反应都是非氧化还原反应
(3)有单质参加的化合和有单质生成的分解是氧化还原反应
05 与四种基本反应类型的关系
从上面几组练习可以看出四种基本反应类型与氧化还原反应有什么关系?
二、四种基本反应类型与氧化还原反应的关系
05 与四种基本反应类型的关系
06 对 点 训 练
【典例1】化学反应中,属于氧化还原反应的是( )
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Zn+CuSO4=Cu+ZnSO4
C.2NaHCO3=Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
B
【典例2】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4===FeSO4+Cu
B.AgNO3+NaCl===AgCl↓+NaNO3
C.Fe2O3+3CO Fe+3CO2
D.2KMnO4 K2MnO4+MnO2+O2↑
C
06 对 点 训 练
【典例3】在下列三个化学反应中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是( )
A
06 对 点 训 练
①N2+O2 2NO②4AgNO3 2Ag2O+4NO2↑+O2↑③2NH4Cl+Ba(OH)2 BaCl2+2NH3↑+2H2OA.①②③ B.②①③C.③②① D.③①②
【典例4】在钢铁的冶炼中,常将CO气体通入红热的氧化铁中,发生的反应是:Fe2O3+3CO Fe+3CO2。请填空:
(1)在上述反应中, 元素的化合价升高,则该元素的原子 电子,发生氧化反应;而 元素的化合价降低,则该元素的原子得到电子,发生 反应.
(2)该反应中 是氧化剂,发生了 反应;
是还原剂,发生了 反应.
【答案】(1)碳;失去;铁;还原;
(2)Fe2O3;还原; CO;氧化
06 对 点 训 练
谢谢观赏
