化学人教版(2019)必修第一册1.1.1物质的分类(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.1物质的分类(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-19 14:57:49 | ||
图片预览




文档简介
(共24张PPT)
必修一化学
第一节 物质的分类方法及分散系、胶体的概念
2023
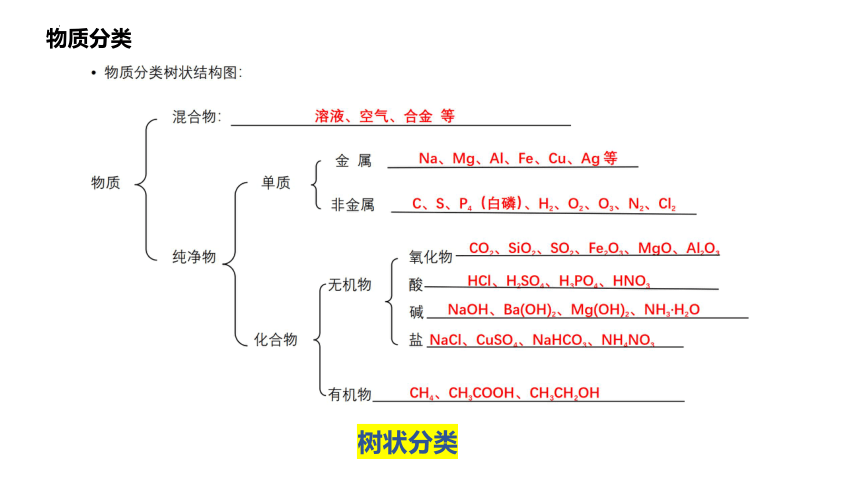
物质分类
树状分类
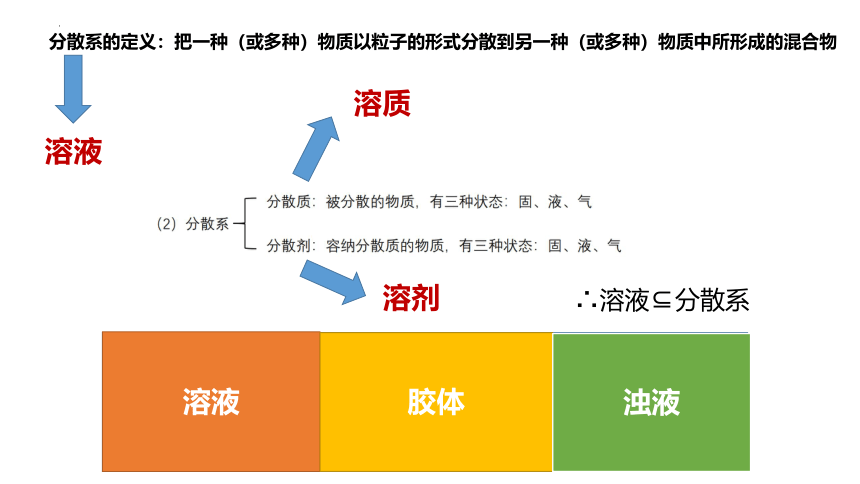
分散系的定义:把一种(或多种)物质以粒子的形式分散到另一种(或多种)物质中所形成的混合物
溶液
溶质
溶剂
分散系
溶液
胶体
浊液
∴溶液 分散系
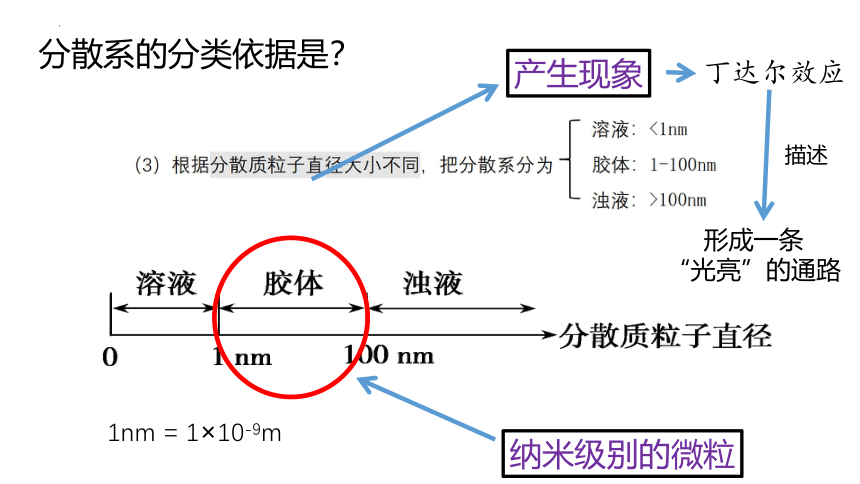
分散系的分类依据是?
1nm = 1×10-9m
纳米级别的微粒
产生现象
丁达尔效应
形成一条
“光亮”的通路
描述
放着没事,一搅变成糊(△)
滤纸
半透膜
浊液
胶体
溶液
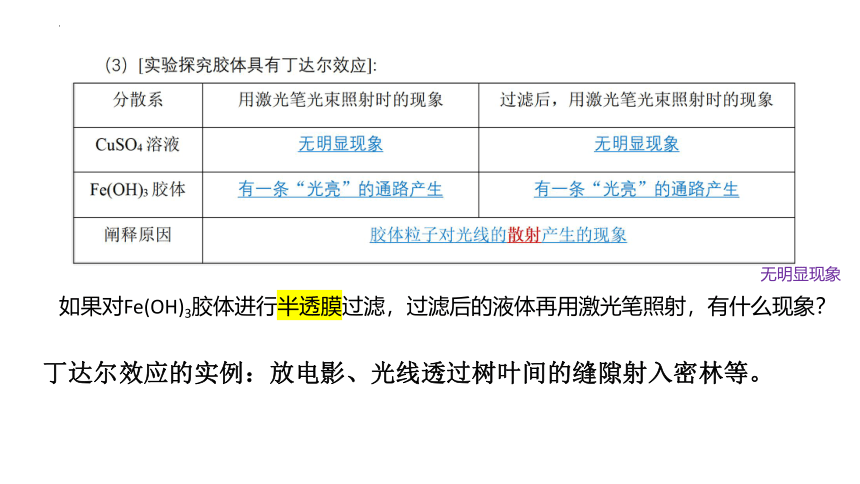
由上表可以总结出:(1) 区分浊液与胶体、溶液的方法是:①看外观,若液体是不透明,其中的物质不均匀的则是浊液;②把液体倒入带有一个装有滤纸的漏斗的烧杯中,若其分散质不能通过漏斗,则证明该液体是浊液。
区分胶体与溶液的方法是:①用激光笔照射通过胶体,若形成一条“光亮”的通路,则证明该液体是胶体;②把液体通入半透膜中,若其分散质不能透过半透膜,则证明该液体是胶体。
物理特性
三角杯 · 微粒大小
现象
如何区分物体是分散系中的哪一种?
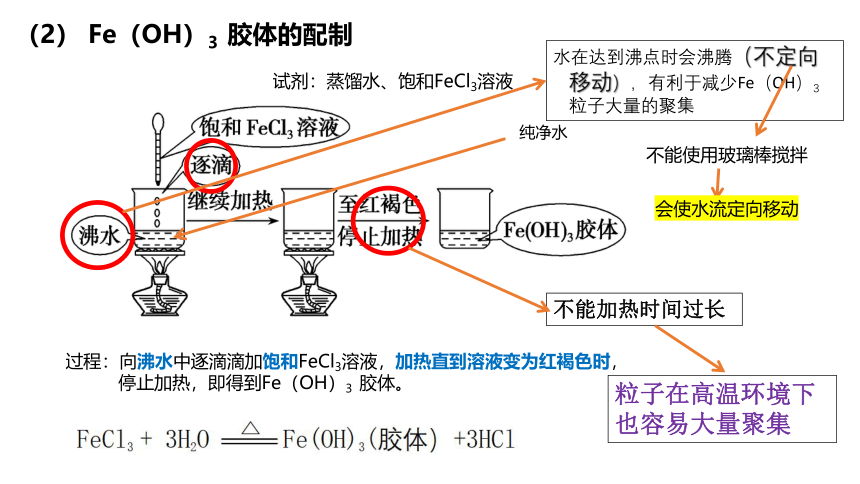
(2) Fe(OH)3 胶体的配制
试剂:蒸馏水、饱和FeCl3溶液
过程:向沸水中逐滴滴加饱和FeCl3溶液,加热直到溶液变为红褐色时,
停止加热,即得到Fe(OH)3 胶体。
纯净水
水在达到沸点时会沸腾(不定向移动),有利于减少Fe(OH)3 粒子大量的聚集
不能使用玻璃棒搅拌
会使水流定向移动
不能加热时间过长
粒子在高温环境下也容易大量聚集
如果对Fe(OH)3胶体进行半透膜过滤,过滤后的液体再用激光笔照射,有什么现象?
无明显现象
丁达尔效应的实例:放电影、光线透过树叶间的缝隙射入密林等。
电解质?
在水溶液或熔融状态下能产生自由移动离子的化合物
判断依据:
化合物
能否产生自由移动的离子
易错:氯化钠是电解质,但盐酸不是电解质!
常见电解质:
强酸、强碱、绝大多数盐
试判断:已知盐酸中的HCl在水溶液中能电离出自由移动的离子,则盐酸是电解质( √ /× )
3. 胶体的其他性质及其应用
A.胶体的介稳性
B.胶体的电泳现象
C 胶体的聚沉
胶体有吸附性
带电
同性相斥
保持距离 !
把氢氧化铁胶体注入U形管中,插入两个碳棒,接通直流电源。
微粒定向移动→正负相吸
现象:一段时间后,与电源负极相连接的碳棒(阴极)附近的现象是颜色变深
氢氧化铁胶体粒子带正电荷
加入电解质,电解质使胶粒大量聚集形成大块不溶物
↓
聚沉最后还要看加入的物质能否溶解胶体,如向氢氧化铁胶体中加入HCl
聚沉的其他方法
四.物质的性质与变化
判断方法为:是否有新物质生成
从微观上判断:有旧化学键断裂,同时有新化学键形成的是化学变化;只有化学键断裂的不一定是化学变化,如NaCl晶体的熔化
化学反应的微观实质就是组成元素间的化学键断裂,元素重新组合并形成新的化学键
B
c
(1)布朗运动:胶体粒子在不停地做无规则的运动。
D
B
电泳现象:胶体粒子带电荷(淀粉胶体等除外),胶体粒子在电场的作用下发生定向移动。
电解:向溶液当中通电,利用直流电进行 氧化还原反应 的方法
凝聚是指分散的物质聚集成为一个集合体;
聚沉是指分散的物质在胶体体系中聚合成为沉淀
渗析:溶质分子在浓度差推动下扩散透过半透膜的过程
问题:哪些属于碱性氧化物?
氧化物
碱性氧化物
氧化物包括酸碱性氧化物、两性氧化物、超氧化物、过氧化物等
B
A
问题A:分散系中哪些带电?
CD
溶液、胶体都是呈现电中性的分散系
胶体带正电荷?
胶体微粒吸附带电荷粒子
聚沉
H2SO4 + BaCl2
C
吸附性
D
C
胶体的聚沉
丁达尔效应
复分解
纳米级别微粒物质
胶体
AC
C
能产生沉淀的物质
ABCD 电解质
都能与胶体混合引起沉淀
沉淀能溶解
Fe(OH)3
碱!!!
酸碱中和
AC
C
BD 能聚沉,产生沉淀,但无法溶解
三价铁离子溶液是黄褐色!
C
过滤
渗析
萃取
过滤
蒸发
加热分解
(NH4 )2 CO3
NH4 NO3
(NH4 )2 SO4
NH4 Cl
(NH4 )2 CO3
NH4 NO3
陶土
②
氧化铁
饱和
稀
浓度!!!
区别在哪?
答案:浓度过稀,不利于胶体形成
必修一化学
第一节 物质的分类方法及分散系、胶体的概念
2023
物质分类
树状分类
分散系的定义:把一种(或多种)物质以粒子的形式分散到另一种(或多种)物质中所形成的混合物
溶液
溶质
溶剂
分散系
溶液
胶体
浊液
∴溶液 分散系
分散系的分类依据是?
1nm = 1×10-9m
纳米级别的微粒
产生现象
丁达尔效应
形成一条
“光亮”的通路
描述
放着没事,一搅变成糊(△)
滤纸
半透膜
浊液
胶体
溶液
由上表可以总结出:(1) 区分浊液与胶体、溶液的方法是:①看外观,若液体是不透明,其中的物质不均匀的则是浊液;②把液体倒入带有一个装有滤纸的漏斗的烧杯中,若其分散质不能通过漏斗,则证明该液体是浊液。
区分胶体与溶液的方法是:①用激光笔照射通过胶体,若形成一条“光亮”的通路,则证明该液体是胶体;②把液体通入半透膜中,若其分散质不能透过半透膜,则证明该液体是胶体。
物理特性
三角杯 · 微粒大小
现象
如何区分物体是分散系中的哪一种?
(2) Fe(OH)3 胶体的配制
试剂:蒸馏水、饱和FeCl3溶液
过程:向沸水中逐滴滴加饱和FeCl3溶液,加热直到溶液变为红褐色时,
停止加热,即得到Fe(OH)3 胶体。
纯净水
水在达到沸点时会沸腾(不定向移动),有利于减少Fe(OH)3 粒子大量的聚集
不能使用玻璃棒搅拌
会使水流定向移动
不能加热时间过长
粒子在高温环境下也容易大量聚集
如果对Fe(OH)3胶体进行半透膜过滤,过滤后的液体再用激光笔照射,有什么现象?
无明显现象
丁达尔效应的实例:放电影、光线透过树叶间的缝隙射入密林等。
电解质?
在水溶液或熔融状态下能产生自由移动离子的化合物
判断依据:
化合物
能否产生自由移动的离子
易错:氯化钠是电解质,但盐酸不是电解质!
常见电解质:
强酸、强碱、绝大多数盐
试判断:已知盐酸中的HCl在水溶液中能电离出自由移动的离子,则盐酸是电解质( √ /× )
3. 胶体的其他性质及其应用
A.胶体的介稳性
B.胶体的电泳现象
C 胶体的聚沉
胶体有吸附性
带电
同性相斥
保持距离 !
把氢氧化铁胶体注入U形管中,插入两个碳棒,接通直流电源。
微粒定向移动→正负相吸
现象:一段时间后,与电源负极相连接的碳棒(阴极)附近的现象是颜色变深
氢氧化铁胶体粒子带正电荷
加入电解质,电解质使胶粒大量聚集形成大块不溶物
↓
聚沉最后还要看加入的物质能否溶解胶体,如向氢氧化铁胶体中加入HCl
聚沉的其他方法
四.物质的性质与变化
判断方法为:是否有新物质生成
从微观上判断:有旧化学键断裂,同时有新化学键形成的是化学变化;只有化学键断裂的不一定是化学变化,如NaCl晶体的熔化
化学反应的微观实质就是组成元素间的化学键断裂,元素重新组合并形成新的化学键
B
c
(1)布朗运动:胶体粒子在不停地做无规则的运动。
D
B
电泳现象:胶体粒子带电荷(淀粉胶体等除外),胶体粒子在电场的作用下发生定向移动。
电解:向溶液当中通电,利用直流电进行 氧化还原反应 的方法
凝聚是指分散的物质聚集成为一个集合体;
聚沉是指分散的物质在胶体体系中聚合成为沉淀
渗析:溶质分子在浓度差推动下扩散透过半透膜的过程
问题:哪些属于碱性氧化物?
氧化物
碱性氧化物
氧化物包括酸碱性氧化物、两性氧化物、超氧化物、过氧化物等
B
A
问题A:分散系中哪些带电?
CD
溶液、胶体都是呈现电中性的分散系
胶体带正电荷?
胶体微粒吸附带电荷粒子
聚沉
H2SO4 + BaCl2
C
吸附性
D
C
胶体的聚沉
丁达尔效应
复分解
纳米级别微粒物质
胶体
AC
C
能产生沉淀的物质
ABCD 电解质
都能与胶体混合引起沉淀
沉淀能溶解
Fe(OH)3
碱!!!
酸碱中和
AC
C
BD 能聚沉,产生沉淀,但无法溶解
三价铁离子溶液是黄褐色!
C
过滤
渗析
萃取
过滤
蒸发
加热分解
(NH4 )2 CO3
NH4 NO3
(NH4 )2 SO4
NH4 Cl
(NH4 )2 CO3
NH4 NO3
陶土
②
氧化铁
饱和
稀
浓度!!!
区别在哪?
答案:浓度过稀,不利于胶体形成
