化学苏教版(2019)必修第一册 1.3.2电解质溶液课件
文档属性
| 名称 | 化学苏教版(2019)必修第一册 1.3.2电解质溶液课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 77.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-19 15:30:52 | ||
图片预览





文档简介
(共13张PPT)
1.3.2 电解质溶液
思考1:
你所知道的能导电的物质有哪些?
金属单质、石墨、氯化钠溶液、氢氧化钠溶液等都能导电。
思考2:
NaC1、NaOH和HC1、CH3COOH、NH3·H2O的水溶液能导电,但导电能力为什么不同呢?
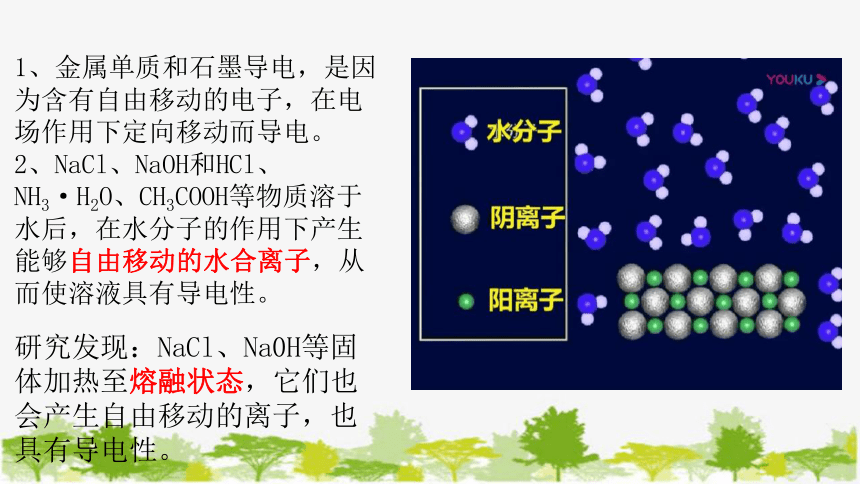
1、金属单质和石墨导电,是因为含有自由移动的电子,在电场作用下定向移动而导电。
2、NaCl、NaOH和HCl、NH3·H2O、CH3COOH等物质溶于水后,在水分子的作用下产生能够自由移动的水合离子,从而使溶液具有导电性。
研究发现:NaCl、Na0H等固体加热至熔融状态,它们也会产生自由移动的离子,也具有导电性。
定义
(1)电解质:在 状态下能够导电的化合物
(2)非电解质:在 状态下都不导电的化合物
一、电解质和非电解质
水溶液里或熔融
水溶液里和熔融
思考:
怎样判断哪些物质属于电解质还是呢非电解质?
2、电解质和非电解质的判断方法
(1)电解质
(2)非电解质
酸、碱、盐、绝大多数盐、水、活泼金属氧化物等
①蔗糖、酒精、葡萄糖、淀粉、油脂等大多数有机物
②CO2、SO2、SO3、NH3、NOx等也属于非电解质。
3、注意事项:
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电,必须提供出自由移动的离子。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨气等是非电解质),必须是电解质本身提供出自由移动的离子。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
(4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
二、电离和电离方程式
1、电离:____________________________________________________
电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
电离方程式是用化学式和离子符号表示电解质电离过程的式子。
2、表示方法——电离方程式
硫酸(H2SO4):H2SO4==2H++SO42-
氢氧化钠(NaOH):NaOH==Na++OH-
硫酸钠(Na2SO4):Na2SO4==2Na++SO42-
课堂练习
1、写出盐酸、硝酸的电离方程式
HCl== H+ + Cl- HNO3== H+ + NO3-
酸:电离时生成的 阳离子全部是氢离子的化合物。
2、写出氢氧化钾、氢氧化钙的电离方程式
KOH== K+ + OH- Ca(OH)2== Ca2+ + 2OH-
碱:电离时生成的阴离子全部是氢氧根离子的化合物
从电离角度理解酸、碱、盐:
3、写出氯化钾、硫酸铵的电离方程式
KCl== K+ + Cl- (NH4)2SO4== 2NH4+ + SO42-
盐:电离时生成金属离子(或NH4+)和酸根离子的化合物。
学以致用:
1.下列物质中,哪些溶于水后能够发生电离?请写出相应的电离方程式。
氯化氢(HCl)、硝酸铵(NH4NO3)、氢氧化钡[Ba(OH)2]、
葡萄糖(C6H12O6)、硝酸银(AgNO3)、氯化钡(BaCl2)、
明矾[KAl(SO4)2 12H2O](一种可溶性硫酸盐)。
2.下列四组物质的水溶液中,哪几组含有的离子种类完全相同?
①NH4Cl KNO3 Na2SO4
②K2SO4 NaNO3 NH4Cl
③NH4NO3 K2CO3,(NH4)2SO4 NaCl
④NaCl (NH4)2SO4 K2SO4 NaNO3
3. ① NaOH 溶液 ②铜丝 ③ 液态 HCl ④盐酸
⑤硫酸 ⑥稀硫酸 ⑦液氨 ⑧氨水
⑨ SO2 ⑩胆矾晶体
(1) 上述状态下可导电的是_____________。
(2) 属于电解质的是___________________。
(3) 属于非电解质的是_________________。
(4) 上述状态下的电解质不能导电的是_________。
① ② ④ ⑥ ⑧
③ ⑤ ⑩
⑦ ⑨
③ ⑤ ⑩
课堂小结:
1.3.2 电解质溶液
思考1:
你所知道的能导电的物质有哪些?
金属单质、石墨、氯化钠溶液、氢氧化钠溶液等都能导电。
思考2:
NaC1、NaOH和HC1、CH3COOH、NH3·H2O的水溶液能导电,但导电能力为什么不同呢?
1、金属单质和石墨导电,是因为含有自由移动的电子,在电场作用下定向移动而导电。
2、NaCl、NaOH和HCl、NH3·H2O、CH3COOH等物质溶于水后,在水分子的作用下产生能够自由移动的水合离子,从而使溶液具有导电性。
研究发现:NaCl、Na0H等固体加热至熔融状态,它们也会产生自由移动的离子,也具有导电性。
定义
(1)电解质:在 状态下能够导电的化合物
(2)非电解质:在 状态下都不导电的化合物
一、电解质和非电解质
水溶液里或熔融
水溶液里和熔融
思考:
怎样判断哪些物质属于电解质还是呢非电解质?
2、电解质和非电解质的判断方法
(1)电解质
(2)非电解质
酸、碱、盐、绝大多数盐、水、活泼金属氧化物等
①蔗糖、酒精、葡萄糖、淀粉、油脂等大多数有机物
②CO2、SO2、SO3、NH3、NOx等也属于非电解质。
3、注意事项:
(1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电,必须提供出自由移动的离子。
(2)溶于水能导电的化合物不一定是电解质(如二氧化碳、氨气等是非电解质),必须是电解质本身提供出自由移动的离子。
(3)电解质溶于水能导电,但熔融状态下不一定能导电(如氯化氢等)。
(4)电解质不一定易溶于水(如硫酸钡等),易溶于水的化合物不一定是电解质(如酒精等)。
二、电离和电离方程式
1、电离:____________________________________________________
电解质在水溶液中或熔融状态下产生自由移动的离子的过程。
电离方程式是用化学式和离子符号表示电解质电离过程的式子。
2、表示方法——电离方程式
硫酸(H2SO4):H2SO4==2H++SO42-
氢氧化钠(NaOH):NaOH==Na++OH-
硫酸钠(Na2SO4):Na2SO4==2Na++SO42-
课堂练习
1、写出盐酸、硝酸的电离方程式
HCl== H+ + Cl- HNO3== H+ + NO3-
酸:电离时生成的 阳离子全部是氢离子的化合物。
2、写出氢氧化钾、氢氧化钙的电离方程式
KOH== K+ + OH- Ca(OH)2== Ca2+ + 2OH-
碱:电离时生成的阴离子全部是氢氧根离子的化合物
从电离角度理解酸、碱、盐:
3、写出氯化钾、硫酸铵的电离方程式
KCl== K+ + Cl- (NH4)2SO4== 2NH4+ + SO42-
盐:电离时生成金属离子(或NH4+)和酸根离子的化合物。
学以致用:
1.下列物质中,哪些溶于水后能够发生电离?请写出相应的电离方程式。
氯化氢(HCl)、硝酸铵(NH4NO3)、氢氧化钡[Ba(OH)2]、
葡萄糖(C6H12O6)、硝酸银(AgNO3)、氯化钡(BaCl2)、
明矾[KAl(SO4)2 12H2O](一种可溶性硫酸盐)。
2.下列四组物质的水溶液中,哪几组含有的离子种类完全相同?
①NH4Cl KNO3 Na2SO4
②K2SO4 NaNO3 NH4Cl
③NH4NO3 K2CO3,(NH4)2SO4 NaCl
④NaCl (NH4)2SO4 K2SO4 NaNO3
3. ① NaOH 溶液 ②铜丝 ③ 液态 HCl ④盐酸
⑤硫酸 ⑥稀硫酸 ⑦液氨 ⑧氨水
⑨ SO2 ⑩胆矾晶体
(1) 上述状态下可导电的是_____________。
(2) 属于电解质的是___________________。
(3) 属于非电解质的是_________________。
(4) 上述状态下的电解质不能导电的是_________。
① ② ④ ⑥ ⑧
③ ⑤ ⑩
⑦ ⑨
③ ⑤ ⑩
课堂小结:
