化学人教版(2019)选择性必修1 1.1.1反应热及其测定(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.1反应热及其测定(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 36.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-19 16:17:56 | ||
图片预览











文档简介
(共30张PPT)
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热及其测定
学习目标
(1)了解反应热的概念;了解反应热的定义,知道化学反应、热效应)与反应焓变之间的关系
(2)能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热
(3)理解热化学方程式的意义,能正确书写热化学方程式。
情境创设
自热食品利用化学反应
放出的热量加热食物
目前市面上的“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物(发热包主要成分)。使用时打开隔离层,即发生以下反应:Mg+2H2O═Mg(OH)2+H2↑ 。
实际生产中需要严格把控发热包中有效成分的含量。发热包中有效成份含量过少,放热不足;含量过多占用空间,且有安全隐患。
化学能
热能
定量描述?
任务一:了解反应热概念
1、反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:即反应前后体系的温度相等
体系:被研究的物质系统称为体系
环境:与体系相互影响的其他部分称为环境
以盐酸与NaOH溶液的反应为例
体系
环境
体系
反应物:盐酸、NaOH溶液
发生的反应:HCl+NaOH=NaCl+H2O
生成物:NaCl、H2O
环境:如试管、空气等
热量
通过热成像仪直观感受感受中和反应的反应热
任务二:中和反应反应热的测定
1881年,法国化学家贝特罗,在法兰西学院的实验室里,利用自己发明弹式量热计测出了不同反应的反应热。
法国化学家贝特罗
中和反应反应热的测定
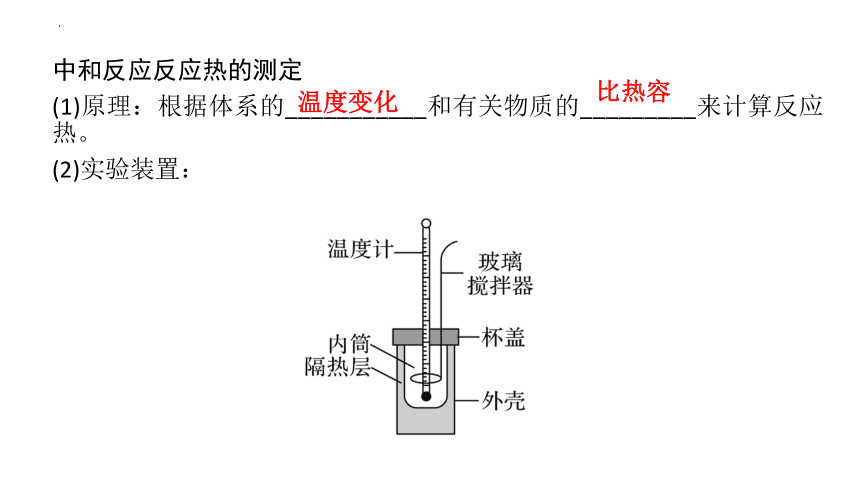
(1)原理:根据体系的___________和有关物质的_________来计算反应热。
(2)实验装置:
温度变化
比热容
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(3)实验试剂
0.5 mol/L
的稀盐酸
0.55 mol/L
的NaOH溶液
50 mL
50 mL
H+(aq)+OH (aq)=H2O(l)
思考:所用HCl和NaOH的物质的量比为何不是1:1,而是NaOH稍过量?
在空气中稀盐酸相对碱稳定,碱极易与空气中CO2反应,消耗了一部分NaOH,为了保证盐酸完全被中和,需要采用稍过量的NaOH溶液
(4)实验测量。
①反应前体系温度(t1)的测量:用一个量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用;用另一个量筒量取50 mL 0.55 mol·L-1NaOH溶液,用温度计测量并记录NaOH溶液的温度。取两温度的平均值记为t1。
②反应后体系温度(t2)的测量:打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。准确读取混合溶液的______________,记录为t2。
③重复上述实验操作,取三次测量所得温度差的平均值作为计算依据。
最高温度
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(5)数据收集
反应前酸、碱的温度,取平均值t1
酸碱混合
充分反应后
体系温度t2
重复三次实验,减少实验误差
实验
次数
1
2
3
反应物的温度
盐酸
NaOH溶液
反应前体
系的温度
反应后体
系的温度
温度差
(t2 t1)/℃
t1/℃
t2/℃
【实验探究】:
测定酸碱中和反应的反应热
【学习任务二】中和反应反应热的测定
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(6)数据处理
热量的计算公式:Q=cmΔt
c:反应混合液的比热容 c=4.18×10 3 kJ/(g·℃)
50mL 0.50 mol/L 盐酸的质量m1=50 g,
50mL 0.55 mol/L NaOH溶液的质量m2=50 g。
m=(m1+m2)=100 g
Δt:三次测量所得温度差(t2 t1)的平均值
H+(aq)+OH (aq)=H2O(l) Q(kJ)
0.025mol
0.025mol
0.418(t2 t1)
1 mol
0.025
0.418(t2 t1)
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1molH2O时,放出57.3kJ的热量。
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(7)误差分析
为了准确测出升高的温度,实验过程中已采取了哪些措施?
1、使用碎泡沫塑料、盖板等做隔热材料,减少热量损失;
2、使用玻璃搅拌棒匀速搅拌,保证反应完全;
3、混合两种反应物时动作迅速、操作规范;
4、重复三次实验,减少误差。
课堂小结
反应热
反应热概念
中和反应反应热的测定
体系
环境
实验装置
实验试剂
数据收集与处理
误差分析
实验改进
[深化理解]
1.中和反应反应热测定原理的理解
(1)中和反应的对象为酸、碱的稀溶液。这是因为浓酸和浓碱相互混合时因稀释会放出热量。
(2)中和热(在25℃、101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应,生成1 mol H2O放出的热量)与参加反应的强酸和强碱的种类、用量无关。
(3)弱酸或弱碱在溶液中不能完全电离,随着反应的进行,继续电离并吸收热量,所以它们的中和热数值小于57.3 kJ·mol-1。例如:利用同样的方法测定氨水与盐酸、NaOH溶液与醋酸的反应热,则所测ΔH>-57.3 kJ·mol-1。
(4)若测定硫酸与Ba(OH)2溶液的反应热,则所测ΔH偏小,即中和热数值大于57.3 kJ·mol-1,这主要是因为Ba2+和SO生成难溶物BaSO4也会放出热量。
【答案】(1)183 (2)A
【解析】(1)1 mol H2在2 mol Cl2中燃烧,参加反应的H2和Cl2的物质的量都是1 mol,生成2 mol HCl,则放出的热量为431 kJ·mol-1×2 mol-(436 kJ·mol-1×1 mol+243 kJ·mol-1×1 mol)=183 kJ。(2)反应H2+X2===2HX中,若1 mol H2和1 mol X2反应生成2 mol HX,就有1 mol H—H和1 mol X—X断裂,有2 mol H—X形成。放出的热量Q(HX)=2E(H—X)-E(H—H)-E(X—X),将题中数据代入计算可得:Q(HCl)>Q(HBr)>Q(HI)。
(1)用含0.5 mol H2SO4的浓硫酸和含1 mol HCl的稀盐酸分别与含1 mol NaOH的稀溶液发生反应,所测得的反应热相等吗?
【答案】不相等;因为浓硫酸稀释时会放热。
(2)测定中和反应反应热的实验中引起误差的因素有哪些?
【答案】量热计的隔热效果差;量取溶液的体积不准确;配制的溶液浓度不准确;温度未到达最高点就读数;实验操作动作较慢等。
(3)测定中和反应反应热的实验中为什么碱要稍过量?
【答案】碱过量是为了保证酸完全反应。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热(在25℃、101 kPa下,强酸稀溶液与强碱稀溶液反应生成1 mol H2O时放出的热量叫中和热)。回答下列问题:
[典例精练]
(1)烧杯间填满碎泡沫塑料的作用是___________________________。
(2)大烧杯上如不盖硬纸板,求得中和热的绝对值__________(填“偏大”“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由:___________________________。
【答案】 (1)减少实验过程中的热量损失 (2)偏小
(3)不相等 相等 因为中和热是指在稀溶液中强酸与强碱发生中和反应生成1 mol H2O时的反应热,与酸和碱的用量无关
在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)该实验常用0.50 mol·L-1盐酸和0.55 mol·L-1NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是_________________ ___________。当室温低于10 ℃时进行实验,对实验结果会造成较大误差的原因是______________。
(2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量为______________________kJ(填表达式)。
【答案】(1)保证盐酸完全被中和 散热太快
(2)0.418(t2-t1)
随堂练习
1.在日常生活和学习中,我们经常接触到下列反应:
①化石燃料燃烧 ②强酸、强碱的中和反应 ③用C和H2O在高温下制水煤气 ④锌和盐酸反应制氢气 ⑤氢氧化钡晶体和氯化铵晶体研磨放出氨气 ⑥煅烧石灰石
其中属于放热反应的有 ,吸热反应的有 。
随堂练习
2.请判断下列说法正误。
(1)浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量为57.3 kJ( )
(2)同一中和反应的反应热与酸碱的用量有关( )
(3)中和反应反应热的测定实验中的玻璃搅拌器换成铜质搅拌器效果更好( )
(4)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液分多次倒入小烧杯( )
(5)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度( )
随堂练习
3.某同学通过实验测出稀盐酸与稀NaOH溶液反应生成1mol水放出的热量为52.3kJ,造成这一结果的原因不可能是的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
随堂练习
4.用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列关于实验和中和反应的说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25 ℃和101 kPa下,强酸和强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ·mol-1的热量
随堂练习
5.某同学设计如图所示实验探究反应中的能量变化。下列判断正确的是( )
A.实验(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将玻璃搅拌器改为铁质搅拌棒对实验结果没有影响
D.实验(c)中若用NaOH固体测定,则测定数值偏高
随堂练习
答案:1. ①②④ ③⑤⑥
2. × √ × × ×
3.B
4.C
5.D
谢谢
第一章 化学反应的热效应
第一节 反应热
第1课时 反应热及其测定
学习目标
(1)了解反应热的概念;了解反应热的定义,知道化学反应、热效应)与反应焓变之间的关系
(2)能解释中和反应反应热的测定原理;能根据实验中测定并记录的数据计算反应热
(3)理解热化学方程式的意义,能正确书写热化学方程式。
情境创设
自热食品利用化学反应
放出的热量加热食物
目前市面上的“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物(发热包主要成分)。使用时打开隔离层,即发生以下反应:Mg+2H2O═Mg(OH)2+H2↑ 。
实际生产中需要严格把控发热包中有效成分的含量。发热包中有效成份含量过少,放热不足;含量过多占用空间,且有安全隐患。
化学能
热能
定量描述?
任务一:了解反应热概念
1、反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:即反应前后体系的温度相等
体系:被研究的物质系统称为体系
环境:与体系相互影响的其他部分称为环境
以盐酸与NaOH溶液的反应为例
体系
环境
体系
反应物:盐酸、NaOH溶液
发生的反应:HCl+NaOH=NaCl+H2O
生成物:NaCl、H2O
环境:如试管、空气等
热量
通过热成像仪直观感受感受中和反应的反应热
任务二:中和反应反应热的测定
1881年,法国化学家贝特罗,在法兰西学院的实验室里,利用自己发明弹式量热计测出了不同反应的反应热。
法国化学家贝特罗
中和反应反应热的测定
(1)原理:根据体系的___________和有关物质的_________来计算反应热。
(2)实验装置:
温度变化
比热容
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(3)实验试剂
0.5 mol/L
的稀盐酸
0.55 mol/L
的NaOH溶液
50 mL
50 mL
H+(aq)+OH (aq)=H2O(l)
思考:所用HCl和NaOH的物质的量比为何不是1:1,而是NaOH稍过量?
在空气中稀盐酸相对碱稳定,碱极易与空气中CO2反应,消耗了一部分NaOH,为了保证盐酸完全被中和,需要采用稍过量的NaOH溶液
(4)实验测量。
①反应前体系温度(t1)的测量:用一个量筒量取50 mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用;用另一个量筒量取50 mL 0.55 mol·L-1NaOH溶液,用温度计测量并记录NaOH溶液的温度。取两温度的平均值记为t1。
②反应后体系温度(t2)的测量:打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。准确读取混合溶液的______________,记录为t2。
③重复上述实验操作,取三次测量所得温度差的平均值作为计算依据。
最高温度
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(5)数据收集
反应前酸、碱的温度,取平均值t1
酸碱混合
充分反应后
体系温度t2
重复三次实验,减少实验误差
实验
次数
1
2
3
反应物的温度
盐酸
NaOH溶液
反应前体
系的温度
反应后体
系的温度
温度差
(t2 t1)/℃
t1/℃
t2/℃
【实验探究】:
测定酸碱中和反应的反应热
【学习任务二】中和反应反应热的测定
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(6)数据处理
热量的计算公式:Q=cmΔt
c:反应混合液的比热容 c=4.18×10 3 kJ/(g·℃)
50mL 0.50 mol/L 盐酸的质量m1=50 g,
50mL 0.55 mol/L NaOH溶液的质量m2=50 g。
m=(m1+m2)=100 g
Δt:三次测量所得温度差(t2 t1)的平均值
H+(aq)+OH (aq)=H2O(l) Q(kJ)
0.025mol
0.025mol
0.418(t2 t1)
1 mol
0.025
0.418(t2 t1)
大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1molH2O时,放出57.3kJ的热量。
任务二:中和反应反应热的测定
教材P5·探究:中和反应反应热的测定
(7)误差分析
为了准确测出升高的温度,实验过程中已采取了哪些措施?
1、使用碎泡沫塑料、盖板等做隔热材料,减少热量损失;
2、使用玻璃搅拌棒匀速搅拌,保证反应完全;
3、混合两种反应物时动作迅速、操作规范;
4、重复三次实验,减少误差。
课堂小结
反应热
反应热概念
中和反应反应热的测定
体系
环境
实验装置
实验试剂
数据收集与处理
误差分析
实验改进
[深化理解]
1.中和反应反应热测定原理的理解
(1)中和反应的对象为酸、碱的稀溶液。这是因为浓酸和浓碱相互混合时因稀释会放出热量。
(2)中和热(在25℃、101 kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应,生成1 mol H2O放出的热量)与参加反应的强酸和强碱的种类、用量无关。
(3)弱酸或弱碱在溶液中不能完全电离,随着反应的进行,继续电离并吸收热量,所以它们的中和热数值小于57.3 kJ·mol-1。例如:利用同样的方法测定氨水与盐酸、NaOH溶液与醋酸的反应热,则所测ΔH>-57.3 kJ·mol-1。
(4)若测定硫酸与Ba(OH)2溶液的反应热,则所测ΔH偏小,即中和热数值大于57.3 kJ·mol-1,这主要是因为Ba2+和SO生成难溶物BaSO4也会放出热量。
【答案】(1)183 (2)A
【解析】(1)1 mol H2在2 mol Cl2中燃烧,参加反应的H2和Cl2的物质的量都是1 mol,生成2 mol HCl,则放出的热量为431 kJ·mol-1×2 mol-(436 kJ·mol-1×1 mol+243 kJ·mol-1×1 mol)=183 kJ。(2)反应H2+X2===2HX中,若1 mol H2和1 mol X2反应生成2 mol HX,就有1 mol H—H和1 mol X—X断裂,有2 mol H—X形成。放出的热量Q(HX)=2E(H—X)-E(H—H)-E(X—X),将题中数据代入计算可得:Q(HCl)>Q(HBr)>Q(HI)。
(1)用含0.5 mol H2SO4的浓硫酸和含1 mol HCl的稀盐酸分别与含1 mol NaOH的稀溶液发生反应,所测得的反应热相等吗?
【答案】不相等;因为浓硫酸稀释时会放热。
(2)测定中和反应反应热的实验中引起误差的因素有哪些?
【答案】量热计的隔热效果差;量取溶液的体积不准确;配制的溶液浓度不准确;温度未到达最高点就读数;实验操作动作较慢等。
(3)测定中和反应反应热的实验中为什么碱要稍过量?
【答案】碱过量是为了保证酸完全反应。
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热(在25℃、101 kPa下,强酸稀溶液与强碱稀溶液反应生成1 mol H2O时放出的热量叫中和热)。回答下列问题:
[典例精练]
(1)烧杯间填满碎泡沫塑料的作用是___________________________。
(2)大烧杯上如不盖硬纸板,求得中和热的绝对值__________(填“偏大”“偏小”或“无影响”)。
(3)实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),所求中和热________(填“相等”或“不相等”),简述理由:___________________________。
【答案】 (1)减少实验过程中的热量损失 (2)偏小
(3)不相等 相等 因为中和热是指在稀溶液中强酸与强碱发生中和反应生成1 mol H2O时的反应热,与酸和碱的用量无关
在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)该实验常用0.50 mol·L-1盐酸和0.55 mol·L-1NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是_________________ ___________。当室温低于10 ℃时进行实验,对实验结果会造成较大误差的原因是______________。
(2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量为______________________kJ(填表达式)。
【答案】(1)保证盐酸完全被中和 散热太快
(2)0.418(t2-t1)
随堂练习
1.在日常生活和学习中,我们经常接触到下列反应:
①化石燃料燃烧 ②强酸、强碱的中和反应 ③用C和H2O在高温下制水煤气 ④锌和盐酸反应制氢气 ⑤氢氧化钡晶体和氯化铵晶体研磨放出氨气 ⑥煅烧石灰石
其中属于放热反应的有 ,吸热反应的有 。
随堂练习
2.请判断下列说法正误。
(1)浓硫酸与NaOH溶液反应生成1 mol H2O(l),放出的热量为57.3 kJ( )
(2)同一中和反应的反应热与酸碱的用量有关( )
(3)中和反应反应热的测定实验中的玻璃搅拌器换成铜质搅拌器效果更好( )
(4)中和反应反应热的测定实验中,应将50 mL 0.55 mol·L-1 NaOH溶液分多次倒入小烧杯( )
(5)中和反应反应热的测定实验中,测定盐酸后的温度计没有冲洗干净,立即测NaOH溶液的温度( )
随堂练习
3.某同学通过实验测出稀盐酸与稀NaOH溶液反应生成1mol水放出的热量为52.3kJ,造成这一结果的原因不可能是的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
随堂练习
4.用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列关于实验和中和反应的说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25 ℃和101 kPa下,强酸和强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ·mol-1的热量
随堂练习
5.某同学设计如图所示实验探究反应中的能量变化。下列判断正确的是( )
A.实验(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将玻璃搅拌器改为铁质搅拌棒对实验结果没有影响
D.实验(c)中若用NaOH固体测定,则测定数值偏高
随堂练习
答案:1. ①②④ ③⑤⑥
2. × √ × × ×
3.B
4.C
5.D
谢谢
