化学人教版(2019)选择性必修1 2.2.3影响化学平衡的因素(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.3影响化学平衡的因素(共34张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 42.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-20 00:00:00 | ||
图片预览





文档简介
(共34张PPT)
meiyangyang8602
meiyangyang8602
时间/min 0 1 2 3 4 5 6 7 8
c(N2) 1 0.9 0.8 0.75 0.7 0.7 0.7 0.7 0.7
c(H2) 3 2.7 2.4 2.25 2.1 2.1 2.1 2.1 2.1
c(NH3) 0 0.2 0.4 0.5 0.6 0.6 0.6 0.6 0.6
meiyangyang8602
请你回忆!
通过上节课计算分析,改变反应物或生成物的浓度化学平衡移动的结果
若其他条件不变时,增大反应物浓度或减小生成物的浓度,Q 减小,使得Q < K,反应不再平衡,向正反应方向移动。
若其他条件不变时,减小反应物浓度或增大生成物的浓度,Q 变大,使得Q > K,反应不再平衡,向逆反应方向移动。
meiyangyang8602
meiyangyang8602
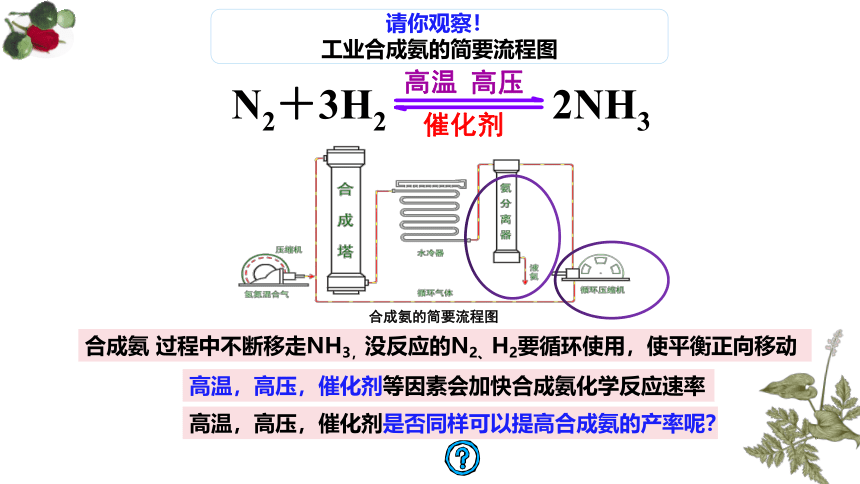
请你观察!
工业合成氨的简要流程图
meiyangyang8602
合成氨的简要流程图
合成氨 过程中不断移走NH3,没反应的N2、H2要循环使用,使平衡正向移动
高温,高压,催化剂等因素会加快合成氨化学反应速率
高温,高压,催化剂是否同样可以提高合成氨的产率呢?
第二节
化学平衡
第二章 化学反应速率与化学平衡
第3课时 影响化学平衡移动的因素
meiy angy ang8602
赵健
meiyangyang8602
01
浓度对化学平衡的影响
meiyangyang8602
赵健
meiyangyang8602
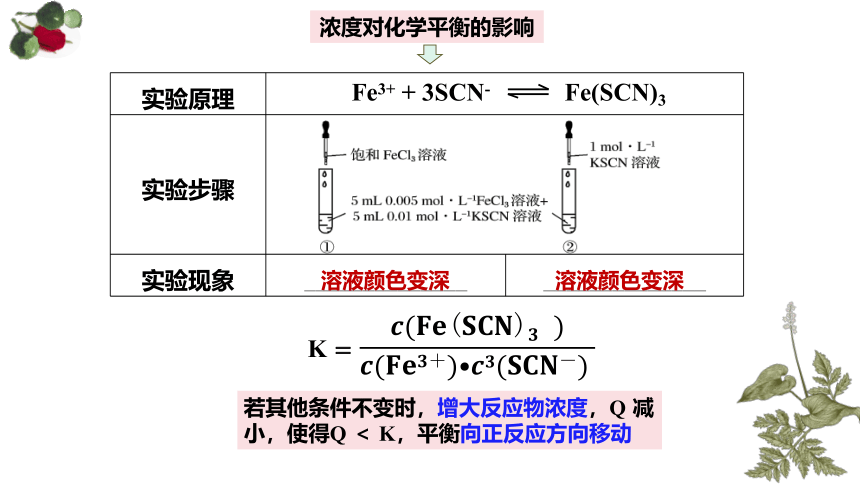
浓度对化学平衡的影响
研究体系:
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
黄色
请你设计实验方案
变量控制:温度等其他因素不变,只改变一种物质的浓度
增加反应物的浓度
饱和FeCl3溶液或高的浓度KSCN溶液
meiyangyang8602
实验原理 实验步骤 实验现象 ______________ ______________
溶液颜色变深
溶液颜色变深
meiyangyang8602
浓度对化学平衡的影响
Fe3+ + 3SCN- Fe(SCN)3
K
=
若其他条件不变时,增大反应物浓度,Q 减小,使得Q < K,平衡向正反应方向移动
meiyangyang8602
meiyangyang8602
meiyangyang8602
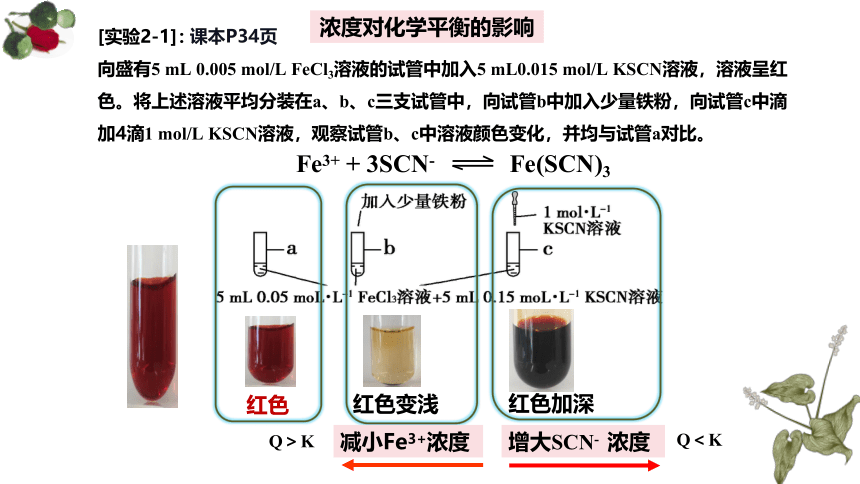
浓度对化学平衡的影响
课本P34页
[实验2-1]:
向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL0.015 mol/L KSCN溶液,溶液呈红色。将上述溶液平均分装在a、b、c三支试管中,向试管b中加入少量铁粉,向试管c中滴加4滴1 mol/L KSCN溶液,观察试管b、c中溶液颜色变化,并均与试管a对比。
Fe3+ + 3SCN- Fe(SCN)3
红色
红色变浅
红色加深
减小Fe3+浓度
增大SCN- 浓度
Q<K
Q>K
meiyangyang8602(1)化学平衡状态发生了变化,通过溶液颜色发生变化可以判断出化学平衡状态发生了变化。(2)在其他条件不变的情况下,反应物浓度减小或者生成物浓度增加,化学平衡向逆反应方向移动;反应物浓度增加或者生成物浓度减小,化学平衡向正反应方向移动。(3)Q<K,化学平衡向正反应方向移动;Q>K,化学平衡向逆反应方向移动。【思考与讨论】(1)在上述实验中,化学平衡状态是否发生变化?你是如何判断的?(2)反应物或生成物浓度的改变是怎样影响化学平衡状态的?(3)在一定温度下,当可逆反应达到平衡时,若浓度商增大或减小,化学平衡状态是否发生变化?如何变化meiyangyang8602浓度对化学平衡的影响课本P35页meiyangyang8602
赵健
Fe3+ + 3SCN- Fe(SCN)3
meiyangyang8602
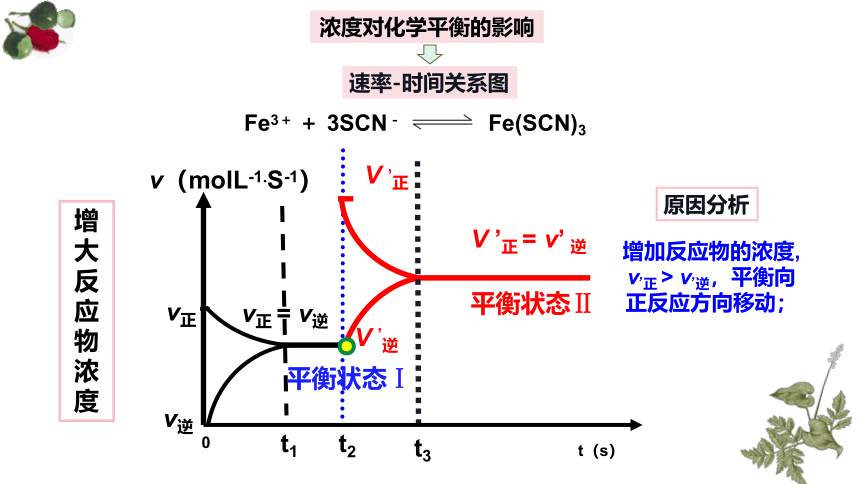
浓度对化学平衡的影响
速率-时间关系图
t2
V ’正 = v’ 逆
V ’逆
V ,正
t3
v正 = v逆
v正
v逆
t(s)
v(molL-1.S-1)
t1
0
平衡状态Ⅰ
平衡状态Ⅱ
增大反应物浓度
原因分析
增加反应物的浓度, v,正 > v,逆,平衡向正反应方向移动;
●
meiyangyang8602
meiyangyang8602
Fe3+ + 3SCN- Fe(SCN)3
meiyangyang8602
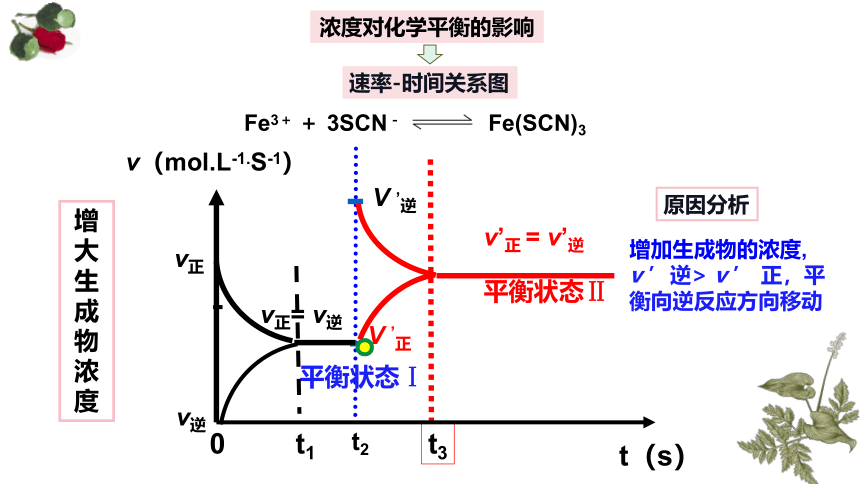
浓度对化学平衡的影响
速率-时间关系图
V ,逆
V ’正
t3
平衡状态Ⅰ
v’正 = v’逆
平衡状态Ⅱ
t2
v正= v逆
v正
v逆
t1
t(s)
v(mol.L-1.S-1)
0
增大生成物浓度
原因分析
增加生成物的浓度, v ’逆> v ’ 正,平衡向逆反应方向移动
●
meiyangyang8602
meiyangyang8602
meiyangyang8602
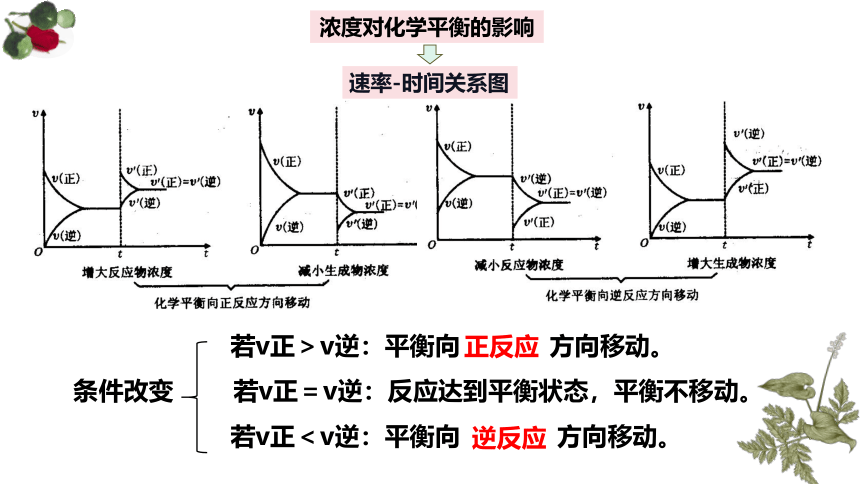
浓度对化学平衡的影响
速率-时间关系图
若v正>v逆:平衡向 方向移动。
条件改变 若v正=v逆:反应达到平衡状态,平衡不移动。
若v正<v逆:平衡向 方向移动。
正反应
逆反应
meiyangyang8602
meiyangyang8602
练习
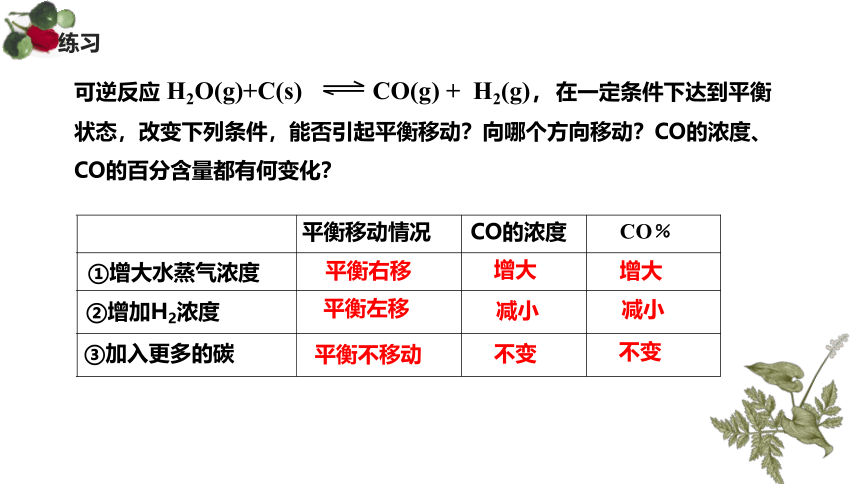
可逆反应 H2O(g)+C(s) CO(g) + H2(g),在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?向哪个方向移动?CO的浓度、CO的百分含量都有何变化?
平衡右移
增大
平衡左移
减小
平衡不移动
不变
增大
减小
不变
CO的浓度
CO﹪
平衡移动情况
①增大水蒸气浓度
②增加H2浓度
③加入更多的碳
02
压强对化学平衡的影响
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
请你预测实验现象
研究体系:
无色
红棕色
2NO2(g) N2O4(g)
实验:
如图所示,用50 mL注射器吸入约20 mL NO2与N2O4的混合气体(使注射器的活塞处于Ⅰ处),将细管端用橡胶塞封闭。然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化。当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
课本P36页
【实验现象】
【实验解释】
(1)压强增大:气体颜色先变深,后变浅。
(2)压强减少:气体颜色先变浅,后变深。
压缩体积,使得c(NO2)瞬间变大反应正方向移动
增大体积,使得c(NO2)瞬间变小反应逆方向移动
meiyangyang8602
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
研究体系:
无色
红棕色
2NO2(g) N2O4(g)
容积减小
颜色又变浅
向正反应
方向移动
物质浓度瞬间增大
加压
NO2浓度比②中的减小,但比①中的增大
原平衡气
①
颜色变深
②
容积增大
颜色又变深
向逆反应
方向移动
物质浓度瞬间减小
减压
NO2浓度比②中的增大,但比①中的减小
原平衡气
①
颜色变浅
②
meiyangyang8602
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
压缩容积至V/2 (加压)
扩大容积至2V (减压)
b
a2
K =
2p1
2a
2b
2b
(2a)2
b
2a2
Q =
=
同温度:
2NO2(g) N2O4(g)
1
2
1
2
b
( a)2
=
2b
a2
Q=
p1
1
2
a
1
2
b
1
2
meiyangyang8602
压强对化学平衡的影响
Q与K的大小定量分析
QQ >K 向逆反应(气体分子数增大)方向移动
Q与K的大小定量分析
在其他条件不变的情况下压强对化学平衡的影响
①增大压强,化学平衡向气体体积减小的方向移动。
②减小压强,化学平衡向气体体积增大的方向移动。
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
速率-时间关系图
t
0
v
V(正)
V(逆)
原平衡
V’ (正)
V’ (逆)
新平衡
增大压强
同温度:
2NO2(g) N2O4(g)
meiyangyang8602
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
速率-时间关系图
aA(g)+bB(g) cC(g)
在其他条件不变的情况下压强对化学平衡的影响
①增大压强,化学平衡向气体体积减小的方向移动。
②减小压强,化学平衡向气体体积增大的方向移动。
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
压强改变,化学平衡一定会移动吗
H2O+CO H2+CO2
高温
催化剂
V(molL-1S-1)
T(s)
0
V正= V逆
V’正= V’逆
t2
增大压强,正逆反应速率均增大,但增大倍数一样,V’正= V’逆,平衡不移动。
meiyangyang8602
meiyangyang8602
思考与讨论:
(1)有气体参加的反应可能出现反应后气体体积增大、减小或不变三种情况。请根据三种不同的情况进行分析,体系压强增大会使化学平衡状态发生怎样的变化?
(2)对于只有固体或液体参加的反应,体系压强的改变会使化学平衡状态发生变化吗?
meiyangyang8602
压强对化学平衡的影响
课本P36页
固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
有气体参加的可逆反应,当达到平衡时,在其他条件不变时:
①增大压强(减小容器的容积)会使化学平衡向气体体积______的方向移动;
②减小压强(增大容器的体积会使化学平衡向气体体积______的方向移动。
③反应后气体的总体积没有变化的可逆反应,增大或减小压强,平衡 _______ 移动。
缩小
增大
不发生
03
温度对化学平衡的影响
meiyangyang8602meiyangyang8602实验:如图所示,把NO2和N2O4的混合气体通入两只连通的烧瓶里,然后用弹簧夹夹住乳胶管;把一只烧瓶浸泡在热水中,另一只浸泡在冰水中。观察混合气体的颜色变化。meiyangyang8602温度对化学平衡的影响2NO2(g)N2O4(g)56.9kJ/mol 研究体系:红棕色无色课本P37页meiyangyang8602meiyangyang8602温度对化学平衡的影响2NO2(g)N2O4(g)56.9kJ/mol 研究体系:红棕色无色实验浸泡在热水中浸泡在冷水中现象平衡移动结论颜色加深颜色变浅平衡逆移平衡正移其他条件不变时,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。meiyangyang8602
meiyangyang8602
V正= V逆
V正
V逆
t1
t(s)
V(molL-1S-1)
0
t2
V”正 = V”逆
V’逆
V‘正
(正反应是放热反应)
meiyangyang8602
温度对化学平衡的影响
速率-时间关系图
2NO2(g) N2O4(g) 56.9kJ/mol
升高温度
meiyangyang8602
meiyangyang8602
meiyangyang8602
温度对化学平衡的影响
速率-时间关系图
aA(g)+bB(g) cC(g) ΔH>0
在其他条件不变的情况下,温度对化学平衡的影响
①升高温度,平衡向吸热的方向移动。
②降低温度,平衡向放热的方向移动。
03
催化剂对化学平衡的影响
meiyangyang8602
meiyangyang8602
meiyangyang8602
催化剂对化学平衡的影响
速率-时间关系图
催化剂降低反应的活化能,可以大大提高反应速率
v (正)= v (逆)
即加入催化剂,化学平衡不移动
催化剂可同等程度地改变正、逆反应速率
当其他条件不变时:加入催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。
meiyangyang8602
请你观察!
仔细观察改变压强之后,气体颜色的变化得出什么结论?
平衡向颜色变浅的方向移动
原平衡气加压容积减小
颜色变深
平衡向颜色变深的方向移动
原平衡气碱压容积增大
颜色变浅
NO2浓度比变深的减小,但比原浓度增大
NO2浓度比变浅的增大,但比原浓度减小
04
勒夏特列原理
meiyangyang8602
meiyangyang8602
勒夏特列原理
法国化学家勒夏特列曾总结一条经验规律:如果改变影响平衡的一个因素(如参加反应物质的浓度、温度、或压强等),平衡就能够向减弱这种改变的方向移动。
平衡移动的结果
“减弱”外界条件的影响,而不能“消除”外界条件的影响。
在一密闭容器中发生N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2) =1 mol·L-1,容器内压强为p,温度为T。
(1)再向容器中通入N2,使其浓度变为2 mol·L-1,并保持容积不变,再次达到平衡时c(N2)的范围是__________________________。
1 mol·L-1meiyangyang8602
meiyangyang8602
pT在一密闭容器中发生N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2)=1 mol·L-1,容器内压强为p,温度为T。
(2)缩小体积至平衡时的一半,并保持容积不变,再次达到平衡时压强p′的范围是__________。
(3)迅速升温至T1,并保持容积不变,且不与外界进行热交换,再次达到平衡时,温度T′的范围是__________。
meiyangyang8602
勒夏特列原理
meiyangyang8602
meiyangyang8602
合成氨工艺条件的选择
2.8:1
meiyangyang8602
合成氨的简要流程图
meiyangyang8602
meiyangyang8602
练习
1. 一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来的1/2但达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )
A. m + n > p
B. A 的转化率降低
C. 平衡向正反应方向移动
D. C的体积分数增加
B
meiyangyang8602
2,压强的变化不会使下列反应的平衡发生移动的是( )
A、H2(g)+I2(g) 2HI(g)
B、 N2(g)+3H2(g) 2NH3(g)
C、2SO2(g)+O2(g) 2SO3(g)
D、 C(s)+CO2(g) 2CO(g)
E 、 Fe3++n SCN- [Fe(SCN)n] 3-n
A E
meiyangyang8602
meiyangyang8602
时间/min 0 1 2 3 4 5 6 7 8
c(N2) 1 0.9 0.8 0.75 0.7 0.7 0.7 0.7 0.7
c(H2) 3 2.7 2.4 2.25 2.1 2.1 2.1 2.1 2.1
c(NH3) 0 0.2 0.4 0.5 0.6 0.6 0.6 0.6 0.6
meiyangyang8602
请你回忆!
通过上节课计算分析,改变反应物或生成物的浓度化学平衡移动的结果
若其他条件不变时,增大反应物浓度或减小生成物的浓度,Q 减小,使得Q < K,反应不再平衡,向正反应方向移动。
若其他条件不变时,减小反应物浓度或增大生成物的浓度,Q 变大,使得Q > K,反应不再平衡,向逆反应方向移动。
meiyangyang8602
meiyangyang8602
请你观察!
工业合成氨的简要流程图
meiyangyang8602
合成氨的简要流程图
合成氨 过程中不断移走NH3,没反应的N2、H2要循环使用,使平衡正向移动
高温,高压,催化剂等因素会加快合成氨化学反应速率
高温,高压,催化剂是否同样可以提高合成氨的产率呢?
第二节
化学平衡
第二章 化学反应速率与化学平衡
第3课时 影响化学平衡移动的因素
meiy angy ang8602
赵健
meiyangyang8602
01
浓度对化学平衡的影响
meiyangyang8602
赵健
meiyangyang8602
浓度对化学平衡的影响
研究体系:
红色
Fe3+ + 3SCN- Fe(SCN)3
无色
黄色
请你设计实验方案
变量控制:温度等其他因素不变,只改变一种物质的浓度
增加反应物的浓度
饱和FeCl3溶液或高的浓度KSCN溶液
meiyangyang8602
实验原理 实验步骤 实验现象 ______________ ______________
溶液颜色变深
溶液颜色变深
meiyangyang8602
浓度对化学平衡的影响
Fe3+ + 3SCN- Fe(SCN)3
K
=
若其他条件不变时,增大反应物浓度,Q 减小,使得Q < K,平衡向正反应方向移动
meiyangyang8602
meiyangyang8602
meiyangyang8602
浓度对化学平衡的影响
课本P34页
[实验2-1]:
向盛有5 mL 0.005 mol/L FeCl3溶液的试管中加入5 mL0.015 mol/L KSCN溶液,溶液呈红色。将上述溶液平均分装在a、b、c三支试管中,向试管b中加入少量铁粉,向试管c中滴加4滴1 mol/L KSCN溶液,观察试管b、c中溶液颜色变化,并均与试管a对比。
Fe3+ + 3SCN- Fe(SCN)3
红色
红色变浅
红色加深
减小Fe3+浓度
增大SCN- 浓度
Q<K
Q>K
meiyangyang8602(1)化学平衡状态发生了变化,通过溶液颜色发生变化可以判断出化学平衡状态发生了变化。(2)在其他条件不变的情况下,反应物浓度减小或者生成物浓度增加,化学平衡向逆反应方向移动;反应物浓度增加或者生成物浓度减小,化学平衡向正反应方向移动。(3)Q<K,化学平衡向正反应方向移动;Q>K,化学平衡向逆反应方向移动。【思考与讨论】(1)在上述实验中,化学平衡状态是否发生变化?你是如何判断的?(2)反应物或生成物浓度的改变是怎样影响化学平衡状态的?(3)在一定温度下,当可逆反应达到平衡时,若浓度商增大或减小,化学平衡状态是否发生变化?如何变化meiyangyang8602浓度对化学平衡的影响课本P35页meiyangyang8602
赵健
Fe3+ + 3SCN- Fe(SCN)3
meiyangyang8602
浓度对化学平衡的影响
速率-时间关系图
t2
V ’正 = v’ 逆
V ’逆
V ,正
t3
v正 = v逆
v正
v逆
t(s)
v(molL-1.S-1)
t1
0
平衡状态Ⅰ
平衡状态Ⅱ
增大反应物浓度
原因分析
增加反应物的浓度, v,正 > v,逆,平衡向正反应方向移动;
●
meiyangyang8602
meiyangyang8602
Fe3+ + 3SCN- Fe(SCN)3
meiyangyang8602
浓度对化学平衡的影响
速率-时间关系图
V ,逆
V ’正
t3
平衡状态Ⅰ
v’正 = v’逆
平衡状态Ⅱ
t2
v正= v逆
v正
v逆
t1
t(s)
v(mol.L-1.S-1)
0
增大生成物浓度
原因分析
增加生成物的浓度, v ’逆> v ’ 正,平衡向逆反应方向移动
●
meiyangyang8602
meiyangyang8602
meiyangyang8602
浓度对化学平衡的影响
速率-时间关系图
若v正>v逆:平衡向 方向移动。
条件改变 若v正=v逆:反应达到平衡状态,平衡不移动。
若v正<v逆:平衡向 方向移动。
正反应
逆反应
meiyangyang8602
meiyangyang8602
练习
可逆反应 H2O(g)+C(s) CO(g) + H2(g),在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?向哪个方向移动?CO的浓度、CO的百分含量都有何变化?
平衡右移
增大
平衡左移
减小
平衡不移动
不变
增大
减小
不变
CO的浓度
CO﹪
平衡移动情况
①增大水蒸气浓度
②增加H2浓度
③加入更多的碳
02
压强对化学平衡的影响
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
请你预测实验现象
研究体系:
无色
红棕色
2NO2(g) N2O4(g)
实验:
如图所示,用50 mL注射器吸入约20 mL NO2与N2O4的混合气体(使注射器的活塞处于Ⅰ处),将细管端用橡胶塞封闭。然后把活塞拉到Ⅱ处,观察管内混合气体颜色的变化。当反复将活塞从Ⅱ处推到Ⅰ处及从Ⅰ处拉到Ⅱ处时,观察管内混合气体颜色的变化。
课本P36页
【实验现象】
【实验解释】
(1)压强增大:气体颜色先变深,后变浅。
(2)压强减少:气体颜色先变浅,后变深。
压缩体积,使得c(NO2)瞬间变大反应正方向移动
增大体积,使得c(NO2)瞬间变小反应逆方向移动
meiyangyang8602
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
研究体系:
无色
红棕色
2NO2(g) N2O4(g)
容积减小
颜色又变浅
向正反应
方向移动
物质浓度瞬间增大
加压
NO2浓度比②中的减小,但比①中的增大
原平衡气
①
颜色变深
②
容积增大
颜色又变深
向逆反应
方向移动
物质浓度瞬间减小
减压
NO2浓度比②中的增大,但比①中的减小
原平衡气
①
颜色变浅
②
meiyangyang8602
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4 原化学平衡容器容积为V p1 a b
压缩容积至V/2 (加压)
扩大容积至2V (减压)
b
a2
K =
2p1
2a
2b
2b
(2a)2
b
2a2
Q =
=
同温度:
2NO2(g) N2O4(g)
1
2
1
2
b
( a)2
=
2b
a2
Q=
p1
1
2
a
1
2
b
1
2
meiyangyang8602
压强对化学平衡的影响
Q与K的大小定量分析
Q
Q与K的大小定量分析
在其他条件不变的情况下压强对化学平衡的影响
①增大压强,化学平衡向气体体积减小的方向移动。
②减小压强,化学平衡向气体体积增大的方向移动。
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
速率-时间关系图
t
0
v
V(正)
V(逆)
原平衡
V’ (正)
V’ (逆)
新平衡
增大压强
同温度:
2NO2(g) N2O4(g)
meiyangyang8602
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
速率-时间关系图
aA(g)+bB(g) cC(g)
在其他条件不变的情况下压强对化学平衡的影响
①增大压强,化学平衡向气体体积减小的方向移动。
②减小压强,化学平衡向气体体积增大的方向移动。
meiyangyang8602
meiyangyang8602
压强对化学平衡的影响
压强改变,化学平衡一定会移动吗
H2O+CO H2+CO2
高温
催化剂
V(molL-1S-1)
T(s)
0
V正= V逆
V’正= V’逆
t2
增大压强,正逆反应速率均增大,但增大倍数一样,V’正= V’逆,平衡不移动。
meiyangyang8602
meiyangyang8602
思考与讨论:
(1)有气体参加的反应可能出现反应后气体体积增大、减小或不变三种情况。请根据三种不同的情况进行分析,体系压强增大会使化学平衡状态发生怎样的变化?
(2)对于只有固体或液体参加的反应,体系压强的改变会使化学平衡状态发生变化吗?
meiyangyang8602
压强对化学平衡的影响
课本P36页
固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
有气体参加的可逆反应,当达到平衡时,在其他条件不变时:
①增大压强(减小容器的容积)会使化学平衡向气体体积______的方向移动;
②减小压强(增大容器的体积会使化学平衡向气体体积______的方向移动。
③反应后气体的总体积没有变化的可逆反应,增大或减小压强,平衡 _______ 移动。
缩小
增大
不发生
03
温度对化学平衡的影响
meiyangyang8602meiyangyang8602实验:如图所示,把NO2和N2O4的混合气体通入两只连通的烧瓶里,然后用弹簧夹夹住乳胶管;把一只烧瓶浸泡在热水中,另一只浸泡在冰水中。观察混合气体的颜色变化。meiyangyang8602温度对化学平衡的影响2NO2(g)N2O4(g)56.9kJ/mol 研究体系:红棕色无色课本P37页meiyangyang8602meiyangyang8602温度对化学平衡的影响2NO2(g)N2O4(g)56.9kJ/mol 研究体系:红棕色无色实验浸泡在热水中浸泡在冷水中现象平衡移动结论颜色加深颜色变浅平衡逆移平衡正移其他条件不变时,升高温度,化学平衡向吸热反应方向移动;降低温度,化学平衡向放热反应方向移动。meiyangyang8602
meiyangyang8602
V正= V逆
V正
V逆
t1
t(s)
V(molL-1S-1)
0
t2
V”正 = V”逆
V’逆
V‘正
(正反应是放热反应)
meiyangyang8602
温度对化学平衡的影响
速率-时间关系图
2NO2(g) N2O4(g) 56.9kJ/mol
升高温度
meiyangyang8602
meiyangyang8602
meiyangyang8602
温度对化学平衡的影响
速率-时间关系图
aA(g)+bB(g) cC(g) ΔH>0
在其他条件不变的情况下,温度对化学平衡的影响
①升高温度,平衡向吸热的方向移动。
②降低温度,平衡向放热的方向移动。
03
催化剂对化学平衡的影响
meiyangyang8602
meiyangyang8602
meiyangyang8602
催化剂对化学平衡的影响
速率-时间关系图
催化剂降低反应的活化能,可以大大提高反应速率
v (正)= v (逆)
即加入催化剂,化学平衡不移动
催化剂可同等程度地改变正、逆反应速率
当其他条件不变时:加入催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。
meiyangyang8602
请你观察!
仔细观察改变压强之后,气体颜色的变化得出什么结论?
平衡向颜色变浅的方向移动
原平衡气加压容积减小
颜色变深
平衡向颜色变深的方向移动
原平衡气碱压容积增大
颜色变浅
NO2浓度比变深的减小,但比原浓度增大
NO2浓度比变浅的增大,但比原浓度减小
04
勒夏特列原理
meiyangyang8602
meiyangyang8602
勒夏特列原理
法国化学家勒夏特列曾总结一条经验规律:如果改变影响平衡的一个因素(如参加反应物质的浓度、温度、或压强等),平衡就能够向减弱这种改变的方向移动。
平衡移动的结果
“减弱”外界条件的影响,而不能“消除”外界条件的影响。
在一密闭容器中发生N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2) =1 mol·L-1,容器内压强为p,温度为T。
(1)再向容器中通入N2,使其浓度变为2 mol·L-1,并保持容积不变,再次达到平衡时c(N2)的范围是__________________________。
1 mol·L-1
meiyangyang8602
p
(2)缩小体积至平衡时的一半,并保持容积不变,再次达到平衡时压强p′的范围是__________。
(3)迅速升温至T1,并保持容积不变,且不与外界进行热交换,再次达到平衡时,温度T′的范围是__________。
meiyangyang8602
勒夏特列原理
meiyangyang8602
meiyangyang8602
合成氨工艺条件的选择
2.8:1
meiyangyang8602
合成氨的简要流程图
meiyangyang8602
meiyangyang8602
练习
1. 一定量的混合气体在密闭容器中发生反应:
m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来的1/2但达到平衡时,C的浓度为原来的1.8倍,则下列说法正确的是( )
A. m + n > p
B. A 的转化率降低
C. 平衡向正反应方向移动
D. C的体积分数增加
B
meiyangyang8602
2,压强的变化不会使下列反应的平衡发生移动的是( )
A、H2(g)+I2(g) 2HI(g)
B、 N2(g)+3H2(g) 2NH3(g)
C、2SO2(g)+O2(g) 2SO3(g)
D、 C(s)+CO2(g) 2CO(g)
E 、 Fe3++n SCN- [Fe(SCN)n] 3-n
A E
