化学人教版(2019)必修1 1.3.2氧化剂与还原剂(共32张ppt)
文档属性
| 名称 | 化学人教版(2019)必修1 1.3.2氧化剂与还原剂(共32张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 137.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-20 10:36:15 | ||
图片预览










文档简介
(共32张PPT)
氧化还原反应
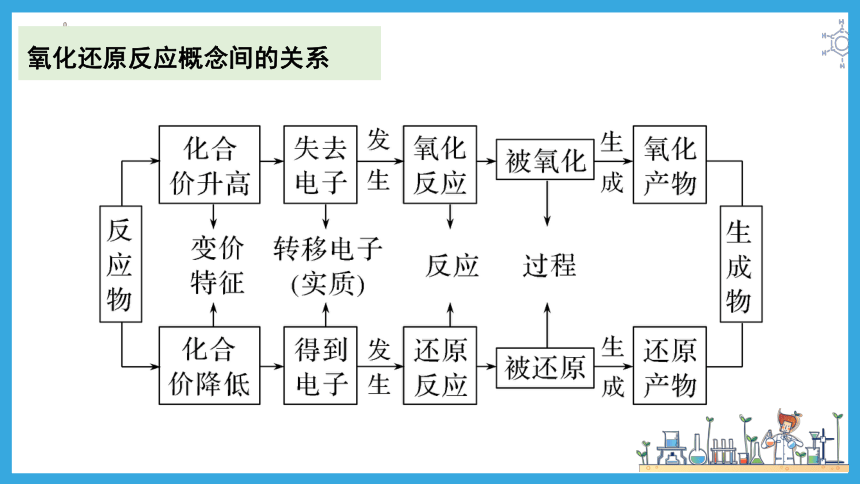
多角度认识氧化还原反应
双线桥和单线桥
得失氧的角度(初中)
化合价的角度(特征)
电子转移角度(本质)
双线桥
单线桥)
【温故知新,可以为师】
氧化还原反应概念间的关系
1.3 氧化还原反应
第二课时 氧化剂与还原剂
素养要求
1.知道常见的氧化剂和还原剂。能从构成物质的粒子等方面说明常见氧化剂和还原剂的主要性质,培养宏观辨识与微观探析的核心素养。
2.认识元素在物质中可以具有不同价态,能从元素价态变化的视角说明物质的转化路径。
【情境再现】
酒精、含氯消毒剂(如“84”消毒液)均可有效灭活病毒。“84”消毒液是一种高效消毒液(见下图)
【问题讨论】
1.“84”消毒液的主要成分是NaClO,其中氯元素的化合价是多少?用“84”消毒液灭杀病毒,利用的是NaClO的什么性质?
提示 NaClO中氯元素的化合价是+1价,“84”消毒液能灭杀病毒是利用了NaClO的强氧化性。
1
氧化剂与还原剂
1.氧化还原反应的相关概念
(1)氧化剂与还原剂
氧化剂:化合价 (即 电子)的反应物
还原剂:化合价 (即 电子)的反应物
降低
得到
升高
失去
e-
氧化性:
还原性:
氧化剂具有的性质
即物质得电子的性质,越容易得电子,氧化性越强
还原剂具有的性质
即物质失电子的性质,越容易失电子,还原性越强
(2)氧化性与还原性
还原剂 氧化产物。
氧化剂 还原产物。
(3)氧化产物与还原产物
氧化产物:
还原产物:
失去电子,被氧化
得到电子,被还原
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 == 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
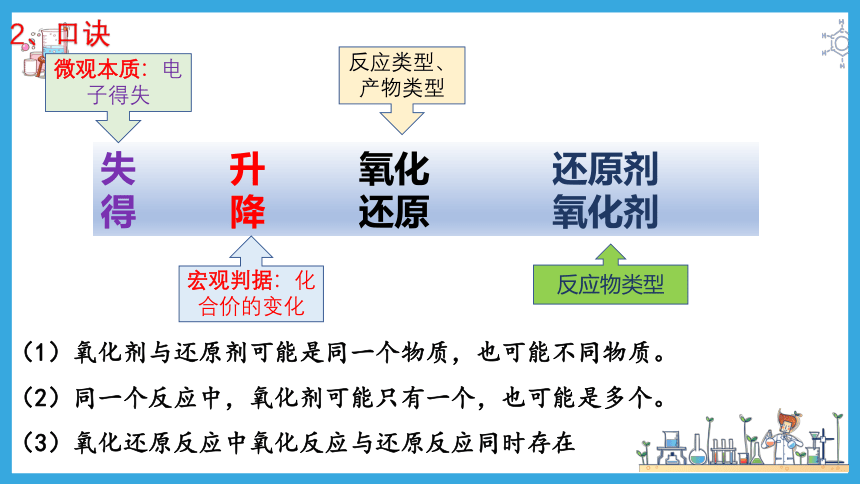
【概念汇总】
失 升 氧化 还原剂
得 降 还原 氧化剂
微观本质:电子得失
宏观判据:化合价的变化
反应类型、产物类型
反应物类型
2、口诀
(1)氧化剂与还原剂可能是同一个物质,也可能不同物质。
(2)同一个反应中,氧化剂可能只有一个,也可能是多个。
(3)氧化还原反应中氧化反应与还原反应同时存在
已知反应:5H2O2+2KMnO4+3H2SO4 = K2SO4+2MnSO4+5O2↑+8H2O,回答下列问题。
(1)反应中H2O2→O2,氧元素的化合价由 到0价,因而H2O2 是 ,O2是 。
(2)反应中KMnO4→MnSO4,Mn元素的化合价由 到+2价,因而KMnO4 是 ,MnSO4是 。
-1价升高
还原剂
氧化产物
+7价降低
氧化剂
还原产物
【例1】
典例分析
3.常见的氧化剂和还原剂
分类 实例
常见氧化剂
常见还原剂
活泼的非金属单质
F2、O2、Cl2、Br2等
含较高价态元素的物质
某些含氧化合物
大多含氧酸
某些盐
MnO2、H2O2等
浓硫酸、HNO3、HClO等
KMnO4、KClO3、FeCl3等
活泼的金属单质
非金属单质
含较低价
态元素的物质
某些氧化物
非金属氢化物
某些盐
Al、Zn、Fe、Na、Mg等
C、H2等
CO、SO2等
HCl、H2S、NH3等
KI、Na2S、FeCl2、Na2SO3等
4.氧化剂和还原剂的判断
①氧化剂
a.变价元素的高价态化合物常作氧化剂,如KMnO4、FeCl3、HNO3等。
(1)从价态的变化判断氧化剂和还原剂
②还原剂
a.含有较低价态元素的化合物常作还原剂,如H2S、CO、SO2等。
(2)从物质的类别判断氧化剂和还原剂
①活泼性较强的非金属单质(如O2、Cl2等)和过氧化物(如H2O2、Na2O2等)通常作氧化剂。
②活泼的金属单质(如Fe、Zn等)和某些非金属单质(如H2、C等)通常作还原剂。
(3)氧化还原反应中基本概念之间的关系
5.氧化性与还原性的强弱比较
(1)根据氧化还原反应方程式比较
氧化性:
还原性:
(2)根据金属的活动性顺序判断
氧化剂>氧化产物
还原剂>还原产物
(3)一般地说,同种变价元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。
例如:
判断氧化性强弱: Fe3+与Fe2+;
KMnO4与MnO2
还原性强弱:S2-、S与SO3
(4)某一元素的最高价只有氧化性,没有还原性;最低价只有还原性,没有氧化性;中间价态既有氧化性又有还原性。
氧化性: Fe3+>Fe2+
KMnO4>MnO2 还原性: S2->S>SO3
(5)根据反应条件判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)发生反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。
如,酸性KMnO4溶液与浓盐酸在常温下反应,MnO2与浓盐酸在加热条件下反应,均产生氯气,故氧化性:KMnO4>MnO2。
(6)根据氧化产物的价态高低判断
同一物质在相同条件下被不同氧化剂氧化,氧化的程度越大,氧化剂的氧化性越强
氧化性:
Cl2>S
如2Fe+3Cl2 == 2FeCl3
Fe+S == FeS
点燃
△
【点拨思路】氧化性和还原性比较的一般思路
6.生产、生活中的氧化还原反应
二氧化硫在葡萄洒中的作用
未成年人不可以喝酒呦
二氧化硫在葡萄酒中起到抑菌、抗氧化的作用,可以抑制微生物和酶的活性,防止葡萄酒变酸。二氧化硫在食品中还起到漂白剂、防腐剂、抗氧化剂和护色剂等。在葡萄酒中,二氧化硫是抗氧化剂,体现了二氧化硫的还原性。
脱氧剂
|
|
铁
什么是自由基?怎样抗氧化才有效?
课堂小结
氧化剂还原剂
氧化剂与还原剂
氧化还原反应的应用
氧化剂和还原剂
氧化产物和还原产物
氧化性和还原性及其强弱比较
2
课堂检测
1.下列古代技术的应用中,不涉及氧化还原反应的是
A.古法炼铁 B.化丹(Pb3O4)为铅
C.煅烧贝壳 D.火药爆炸
C
铁元素的化合价降低
Pb元素化合价降低为0
N、C、S元素化合价改变
2.(2023·临沂十九中高一月考)下列物质间的转化,需要加入氧化剂才能实现的是( )
A.Fe2O3→Fe B.KClO3→KCl
C.H2SO4→SO2 D.NH3→NO
D
3.(2022·天津蓟州高一检测)下列对于NaH+H2O===H2↑+NaOH的说法正确的是
A.该反应属于置换反应
B.若该反应中有2个电子转移,则生成1个H2
C.水是氧化剂
D.H2只是氧化产物
C
B
4.已知下列反应:2Fe3++2I-= I2+2Fe2+,
Br2+2Fe2+= 2Br-+2Fe3+,
I2+SO32-+H2O = 2I-+SO42-+2H+
下列反应说法正确的是( )
A.还原性强弱关系:I->Br->Fe2+>SO32-B.向FeI2溶液中滴加少量溴水,I-优先被氧化C.I2+2Br- = Br2+2I-可以顺利发生D.物质得电子越多,氧化性越强;失去电子越多,还原性越强
5.已知酸性条件下可发生反应:ClO3-+2M3++4H2O===M2O7n-+Cl-+8H+,下列说法错误的是( )
C
6.(1)铁在氯气中燃烧生成棕褐色物质(FeCl3),而在盐酸中生成浅绿色溶液(FeCl2)。则在Cl2、Cl-、H+中,________具有氧化性,____的氧化性较强。
Cl2、H+
Cl2
(2)为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。
①该反应中,氧化剂是_______,氧化产物是______。
KIO3
I2
②用双线桥标出该反应中电子转移的方向和数目:
_____________________________________。
氧化还原反应
多角度认识氧化还原反应
双线桥和单线桥
得失氧的角度(初中)
化合价的角度(特征)
电子转移角度(本质)
双线桥
单线桥)
【温故知新,可以为师】
氧化还原反应概念间的关系
1.3 氧化还原反应
第二课时 氧化剂与还原剂
素养要求
1.知道常见的氧化剂和还原剂。能从构成物质的粒子等方面说明常见氧化剂和还原剂的主要性质,培养宏观辨识与微观探析的核心素养。
2.认识元素在物质中可以具有不同价态,能从元素价态变化的视角说明物质的转化路径。
【情境再现】
酒精、含氯消毒剂(如“84”消毒液)均可有效灭活病毒。“84”消毒液是一种高效消毒液(见下图)
【问题讨论】
1.“84”消毒液的主要成分是NaClO,其中氯元素的化合价是多少?用“84”消毒液灭杀病毒,利用的是NaClO的什么性质?
提示 NaClO中氯元素的化合价是+1价,“84”消毒液能灭杀病毒是利用了NaClO的强氧化性。
1
氧化剂与还原剂
1.氧化还原反应的相关概念
(1)氧化剂与还原剂
氧化剂:化合价 (即 电子)的反应物
还原剂:化合价 (即 电子)的反应物
降低
得到
升高
失去
e-
氧化性:
还原性:
氧化剂具有的性质
即物质得电子的性质,越容易得电子,氧化性越强
还原剂具有的性质
即物质失电子的性质,越容易失电子,还原性越强
(2)氧化性与还原性
还原剂 氧化产物。
氧化剂 还原产物。
(3)氧化产物与还原产物
氧化产物:
还原产物:
失去电子,被氧化
得到电子,被还原
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 == 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
【概念汇总】
失 升 氧化 还原剂
得 降 还原 氧化剂
微观本质:电子得失
宏观判据:化合价的变化
反应类型、产物类型
反应物类型
2、口诀
(1)氧化剂与还原剂可能是同一个物质,也可能不同物质。
(2)同一个反应中,氧化剂可能只有一个,也可能是多个。
(3)氧化还原反应中氧化反应与还原反应同时存在
已知反应:5H2O2+2KMnO4+3H2SO4 = K2SO4+2MnSO4+5O2↑+8H2O,回答下列问题。
(1)反应中H2O2→O2,氧元素的化合价由 到0价,因而H2O2 是 ,O2是 。
(2)反应中KMnO4→MnSO4,Mn元素的化合价由 到+2价,因而KMnO4 是 ,MnSO4是 。
-1价升高
还原剂
氧化产物
+7价降低
氧化剂
还原产物
【例1】
典例分析
3.常见的氧化剂和还原剂
分类 实例
常见氧化剂
常见还原剂
活泼的非金属单质
F2、O2、Cl2、Br2等
含较高价态元素的物质
某些含氧化合物
大多含氧酸
某些盐
MnO2、H2O2等
浓硫酸、HNO3、HClO等
KMnO4、KClO3、FeCl3等
活泼的金属单质
非金属单质
含较低价
态元素的物质
某些氧化物
非金属氢化物
某些盐
Al、Zn、Fe、Na、Mg等
C、H2等
CO、SO2等
HCl、H2S、NH3等
KI、Na2S、FeCl2、Na2SO3等
4.氧化剂和还原剂的判断
①氧化剂
a.变价元素的高价态化合物常作氧化剂,如KMnO4、FeCl3、HNO3等。
(1)从价态的变化判断氧化剂和还原剂
②还原剂
a.含有较低价态元素的化合物常作还原剂,如H2S、CO、SO2等。
(2)从物质的类别判断氧化剂和还原剂
①活泼性较强的非金属单质(如O2、Cl2等)和过氧化物(如H2O2、Na2O2等)通常作氧化剂。
②活泼的金属单质(如Fe、Zn等)和某些非金属单质(如H2、C等)通常作还原剂。
(3)氧化还原反应中基本概念之间的关系
5.氧化性与还原性的强弱比较
(1)根据氧化还原反应方程式比较
氧化性:
还原性:
(2)根据金属的活动性顺序判断
氧化剂>氧化产物
还原剂>还原产物
(3)一般地说,同种变价元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。
例如:
判断氧化性强弱: Fe3+与Fe2+;
KMnO4与MnO2
还原性强弱:S2-、S与SO3
(4)某一元素的最高价只有氧化性,没有还原性;最低价只有还原性,没有氧化性;中间价态既有氧化性又有还原性。
氧化性: Fe3+>Fe2+
KMnO4>MnO2 还原性: S2->S>SO3
(5)根据反应条件判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)发生反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。
如,酸性KMnO4溶液与浓盐酸在常温下反应,MnO2与浓盐酸在加热条件下反应,均产生氯气,故氧化性:KMnO4>MnO2。
(6)根据氧化产物的价态高低判断
同一物质在相同条件下被不同氧化剂氧化,氧化的程度越大,氧化剂的氧化性越强
氧化性:
Cl2>S
如2Fe+3Cl2 == 2FeCl3
Fe+S == FeS
点燃
△
【点拨思路】氧化性和还原性比较的一般思路
6.生产、生活中的氧化还原反应
二氧化硫在葡萄洒中的作用
未成年人不可以喝酒呦
二氧化硫在葡萄酒中起到抑菌、抗氧化的作用,可以抑制微生物和酶的活性,防止葡萄酒变酸。二氧化硫在食品中还起到漂白剂、防腐剂、抗氧化剂和护色剂等。在葡萄酒中,二氧化硫是抗氧化剂,体现了二氧化硫的还原性。
脱氧剂
|
|
铁
什么是自由基?怎样抗氧化才有效?
课堂小结
氧化剂还原剂
氧化剂与还原剂
氧化还原反应的应用
氧化剂和还原剂
氧化产物和还原产物
氧化性和还原性及其强弱比较
2
课堂检测
1.下列古代技术的应用中,不涉及氧化还原反应的是
A.古法炼铁 B.化丹(Pb3O4)为铅
C.煅烧贝壳 D.火药爆炸
C
铁元素的化合价降低
Pb元素化合价降低为0
N、C、S元素化合价改变
2.(2023·临沂十九中高一月考)下列物质间的转化,需要加入氧化剂才能实现的是( )
A.Fe2O3→Fe B.KClO3→KCl
C.H2SO4→SO2 D.NH3→NO
D
3.(2022·天津蓟州高一检测)下列对于NaH+H2O===H2↑+NaOH的说法正确的是
A.该反应属于置换反应
B.若该反应中有2个电子转移,则生成1个H2
C.水是氧化剂
D.H2只是氧化产物
C
B
4.已知下列反应:2Fe3++2I-= I2+2Fe2+,
Br2+2Fe2+= 2Br-+2Fe3+,
I2+SO32-+H2O = 2I-+SO42-+2H+
下列反应说法正确的是( )
A.还原性强弱关系:I->Br->Fe2+>SO32-B.向FeI2溶液中滴加少量溴水,I-优先被氧化C.I2+2Br- = Br2+2I-可以顺利发生D.物质得电子越多,氧化性越强;失去电子越多,还原性越强
5.已知酸性条件下可发生反应:ClO3-+2M3++4H2O===M2O7n-+Cl-+8H+,下列说法错误的是( )
C
6.(1)铁在氯气中燃烧生成棕褐色物质(FeCl3),而在盐酸中生成浅绿色溶液(FeCl2)。则在Cl2、Cl-、H+中,________具有氧化性,____的氧化性较强。
Cl2、H+
Cl2
(2)为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。
①该反应中,氧化剂是_______,氧化产物是______。
KIO3
I2
②用双线桥标出该反应中电子转移的方向和数目:
_____________________________________。
