浙教版科学2023-2024学年上学期八年级“冲刺重高”讲义(五):物质的溶解(1)(含解析)
文档属性
| 名称 | 浙教版科学2023-2024学年上学期八年级“冲刺重高”讲义(五):物质的溶解(1)(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 936.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-08-21 22:59:09 | ||
图片预览





文档简介
例1、下列影响固体物质溶解性大小的因素是( )
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥是否搅拌 ⑦温度
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
例2、如图为小温探究a物质溶解性的实验过程,下图各烧杯中的液体一定属于饱和溶液的是( )
A.乙 B.丙 C.乙、丙 D.丙、丁
例3、20℃时,将硝酸钾饱和溶液100克和200克,分别加热蒸发掉20克水后,冷却到原来的温度,各析出了晶体a克和b克,则a和b的关系是( )
A.a<b B.2a=b C.2b=a D.a=b
例4、表是在不同温度时硝酸钾的溶解度,下列说法正确的是( )
温度/℃ 0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
A.KNO3的溶解度受温度影响明显,其随温度的升高而增大
B.20℃时,200克水中,KNO3的溶解度是63.2克
C.40℃时,100克KNO3饱和溶液中含有溶质63.9克
D.100℃时水中溶解的硝酸钾一定比80℃时水中溶解的硝酸钾多
例5、小科发现很多物质都能在水中溶解,但溶解的速度有快有慢,她想:影响同种物质溶解速度的因素有哪些呢?小科根据生活经验以冰糖为例,提出了她的一些猜想:A与水的温度有关,B与冰糖颗粒的大小有关,C与是否搅拌有关。为了验证猜想是否正确,她设计了实验方案(实验中的烧杯完全相同),并进行了探究。下表是她在探究过程中记录的实验数据。
颗粒大小 水及温度 是否搅拌 溶解快慢
① 5克块状冰糖 100毫升、10℃的水 是 缓慢
② 5克块状冰糖 100毫升、80℃的水 是 较快
③ 5克粉末状冰糖 100毫升、80℃的水 是 快速
④ 5克粉末状冰糖 100毫升、80℃的水 否 较慢
(1)通过对比实验①和实验②的实验现象,可验证猜想 (填字母)。
(2)通过对比实验②和实验③的实验现象,得到的结论是:当水温等其他条件一定时, 。
(3)为了验证猜想C,应选择 进行比较。
(4)通过该实验得出物质的溶解快慢与 有关。
1.如图,这是市面上常见的感冒药,食用前需要将药粉倒入水中充分溶解。下面几个选项中能作为判断溶解后的感冒药溶液是饱和溶液的依据是( )
A.该溶液颜色很深 B.该溶液味道很苦
C.感冒药溶解的很快 D.感冒药固体有剩余
2.一木块漂浮于50℃的硝酸钾饱和溶液中,某一条件改变时,木块排开液体的体积随时间发生了如图所示的变化,下列条件可以达到目的是( )
①增加溶质②蒸发溶剂③增加溶剂④升高温度⑤降低温度
A.②④ B.①④ C.②③ D.③⑤
3.小明设计了一个比较物质溶解能力大小的实验方案,实验结果如下:
温度 溶质 溶剂 实验结果
20℃ 碘2g 酒精10g 全部溶解
20℃ 碘2g 水10g 部分溶解
从表格分析可知,影响物质溶解能力大小的因素是( )
A.温度 B.溶质的性质 C.溶剂的性质 D.溶液的质量
4.溶液的浓稀与饱和,不饱和之间的关系.
(1)不同溶质的溶液饱和,不饱和与浓稀之间没有必然联系,稀溶液 是不饱和溶液,浓溶液 是饱和溶液.
(2)同一溶质的溶液在同一温度下,饱和溶液一定比不饱和溶液要 .
5.某兴趣小组利用家中的调味品研究影响物质溶解性的因素,实验步骤设计如下:
①准备足量的白糖、食盐和冰糖,并将它们研磨成粉末待用。
②按下表进行实验并记录实验数据。(实验器材略)
试管编号 1号 2号 3号 4号
实验温度 20℃ 20℃ 20℃ 40℃
溶质种类 白糖 冰糖 食盐 冰糖
水的质量 10克 10克 10克 10克
(1)请在表中最后一行的第1个空格中填写需要记录的项目。
(2)从这个表格看,他们准备研究的影响因素为: 。
(3) 两支试管的数据可以为“白糖和冰糖是不是同一种物质这个问题提供证据”。
6.仔细阅读下面的探究实验信息,回答相关问题.
【实验目的】探究溶解过程中,溶液温度的变化情况.
【查阅资料】
(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程.
(2)实验条件下,水的凝固点为0℃、沸点为100℃.
【提出猜想】物质溶解过程中,溶液的温度可能升高或降低或不变.
【实验探究】某探究小组的同学设计了如图所示的两种方案.在图2所示方案中,每次加入物质b之前均使用温度计控制热水温度,使之保持在99℃.
【实验结论】
(1)图1所示实验中,若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度 (填“升高”或“降低”或“不变”,下同).
(2)图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度 .
【拓展实验】按照图3所示进行实验.若物质c为NaOH,则U形管内的左边液面将 (填“高于”或“低于”或“等于”)右边液面.
【反思交流】
(1)该小组的同学进一步就物质溶解过程中溶液温度变化的原因展开了讨论,分析得出:若Q吸 Q放(填“>”或“<”或“=”),则溶液温度下降;若Q吸与Q放的相对大小与之相反,则溶液温度上升.
(2)在图2所示方案中,小张同学对实验现象很感兴趣,他继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象.请解释不再产生沸腾现象的原因 .
1.把一定量的硝酸铵固体加入装有蒸馏水的烧杯中,不断搅拌,用温度传感器记录溶解过程的温度变化(如图),实验中发现:a点烧杯中固体完全消失,b点有固体出现。由此可知( )
A.硝酸铵固体溶于水是放热过程 B.硝酸铵固体的溶解度随温度升高而增大
C.a点时,该溶液一定是不饱和溶液 D.c点时,烧杯中也一定有固体
2.许多科学知识在逻辑上存在如图所示关系,下列关于溶液说法正确的是( )
A.饱和溶液包含浓溶液
B.饱和溶液与稀溶液属于并列关系
C.饱和溶液与不饱和溶液属于交叉关系
D.不饱和溶液与稀溶液属于交叉关系
3.同学们在学习《物质的溶解》知识时,进行了如下实验。
(1)小组同学配制了一杯如图所示的食盐溶液,同学们认为该溶液为食盐的饱和溶液。他们的证据是 。
(2)关于上述食盐溶液是否能溶解蔗糖展开了讨论,根据你所学过的知识,你认为该溶液 (选填“能”或“不能”)继续溶解蔗糖。
4.某兴趣小组利用家中的材料研究影响物质溶解性的因素,实验步骤设计如下:
Ⅰ.称取六份冰糖和一份食盐,每10克为一份,并将其中五份冰糖研磨成粉末。
Ⅱ.按照表进行实验(实验所需仪器略)。
第一组 第二组 第三组 第四组
实验温度 20℃ 20℃ 20℃ 20℃ 20℃ 20℃ 80℃
固体种类 冰糖 冰糖 冰糖(粉末) 冰糖(块状) 冰糖 食盐 冰糖(粉末)
固体质量 10克 10克 10克 10克 10克 10克 10克
溶剂种类 水 植物油 水 水 水 水 水
溶剂质量 50克 50克 10克 10克 10克 10克 10克
请你对他们的实验设计进行分析:
(1)根据上述设计,你认为他们准备研究的影响因素有 ,其中不影响物质溶解性的因素是 。
(2)请你预测一下,冰糖溶解速率最快的是第 组。
答案及解析
例1、B
【分析】固体物质的溶解度受温度、溶质种类、溶解种类影响;
【解析】由分析可知:①溶质的多少、③溶剂的多少、⑤溶液是否饱和、 ⑥是否搅拌不会影响溶解度;
②溶质的性质、④溶剂的性质、⑦温度会影响物质的溶解度;
故选B。
例2、D
【解答】解:甲中溶液可能是恰好饱和的溶液,也可能是不饱和溶液;加热后温度升高,得到溶液乙,乙一定是不饱和溶液;冷却后,有晶体析出,则丙一定是饱和溶液;过滤后得到溶液丁,溶液丁一定是饱和溶液;则一定属于饱和溶液的是丙、丁。
故选:D。
例3、D
【解答】解:根据题意“20℃时,分别将200克硝酸钾饱和溶液与100克硝酸钾饱和溶液各蒸发掉20克水后,再降温到20℃,分别析出硝酸钾晶体a克与b克”,所析出晶体的质量均为20℃时20g水所溶解硝酸钾的最大质量,因此析出晶体质量相等,即a=b.所以,A、B、C错误。D正确。
故选:D。
例4、A
【解答】解:A、由在不同温度时硝酸钾的溶解度,KNO3的溶解度受温度影响明显,其随温度的升高而增大,故选项说法正确。
B、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;20℃时,硝酸钾的溶解度为31.6g,故选项说法错误。
C、40℃时,硝酸钾的溶解度为63.9g,含义是40℃时,100g水中最多能溶解硝酸钾63.9g,溶液达到饱和状态,形成饱和溶液163.9g;则40℃时,100克KNO3饱和溶液中含有溶质的质量小于63.9g,故选项说法错误。
D、选项说法没有指明温度,100℃时水中溶解的硝酸钾不一定比80℃时水中溶解的硝酸钾多,故选项说法错误。
故选:A。
例5、解:(1)实验①和实验②其他条件相同,只有温度不同,通过对比实验①和实验②的实验现象,温度高的溶解快,所以可验证猜想与水的温度有关;故答案为:A;
(2)通过对比实验②和实验③的实验现象,得到的结论是:当水温等其他条件一定时,粉末状冰糖溶解快,所以与冰糖颗粒的大小有关;故答案为:粉末状冰糖溶解快;
(3)为了验证猜想C与是否搅拌有关,通过观察表中的数据,应选择其他条件相同,只有搅拌与否,故可以选择③和④进行比较;故答案为:③和④;
(4)通过以上分析,该实验得出物质的溶解快慢与温度、颗粒的大小、以及是否搅拌有关;故答案为:温度、颗粒的大小、是否搅拌。
1.D
【解析】饱和溶液是指在一定温度下,一定量的溶剂中溶解,某种物质,当溶质不能继续溶解时形成的溶液是该温度下的饱和溶液,故判断溶解后的感冒药溶液是饱和溶液的依据是感冒药固体有剩余。故选D。
2.D
【解答】解:观察图象可知,木块排开液体的体积增大,由F=ρgV排,则液体的密度减小。
①增加溶质,不能继续溶解,溶液的密度不变,不符合要求。
②蒸发溶剂,有硝酸钾晶体析出,溶液仍是该温度下的饱和溶液,溶液的密度不变,不符合要求。
③增加溶剂,溶液的密度变小,符合要求。
④升高温度,硝酸钾的溶解度增大,但溶液的组成没有发生改变,不符合要求。
⑤硝酸钾的溶解度随着温度的升高而增大,温度降低,有硝酸钾晶体析出,溶液的密度变小,可采用降低温度的方法。
故③⑤符合题意。
故选:D。
3.C
【解答】解:除探究要素不同之外,其它条件都应该是相同的,从表格分析可知,除了溶剂的种类不同外,其它条件均相同,影响物质溶解能力大小的因素是溶剂的种类,即溶剂的性质。
故选:C。
4.解:(1)不同溶质的溶液饱和,不饱和与浓稀之间没有必然联系,稀溶液 不一定是不饱和溶液,浓溶液 不一定是饱和溶液.
(2)同一溶质的溶液在同一温度下,饱和溶液一定比不饱和溶液要 浓.
5.(1)研究影响物质溶解性的因素,表中最后一行的第1个空格中填写需要记录的项目溶解时间;根据溶解时间的长短,判断溶解速率的快慢;
(2)根据表格数据,水的质量相同,温度不同,溶质种类不同,故准备研究的影响因素为温度、溶质种类;
(3)1号和2号两支试管中实验温度、水的质量相同,溶质是白糖和冰糖,故两支试管的数据可以为“白糖和冰糖是不是同一种物质这个问题提供证据”。
故答案为:(1)溶解时间;(2)温度、溶质种类;(3)1号和2号。
6.解:(1)若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度下降,故填:下降.
(2)若加入物质b后,热水会突然沸腾,说明溶液的温度升高,故填:升高.
【拓展实验】若物质c为NaOH,氢氧化钠溶于水放热,装置内的气压升高,则U形管内的左边液面将低于右边液面;故填:低于;
【反思交流】(1)若Q吸>Q放则溶液温度降低;
(2)继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热,因此就看不到沸腾现象,故填:至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热.
故答案为:【实验结论】(1)降低;(2)升高.【拓展实验】低于.【反思交流】(1)>.(2)至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热
1.B
【解析】A、根据图示可知硝酸铵溶于水后溶液中温度降低,则说明硝酸铵溶解过程吸热,故选项说法错误;
B、a点烧杯中固体完全消失,b点有固体析出,且ab段溶液温度降低,说明硝酸铵固体的溶解度随温度的降低而降低,则硝酸铵固体的溶解度随温度的升高而增大,故选项说法正确;
C、a点时固体完全溶解,也可能是恰好饱和的溶液,故选项说法错误;
D、a点时固体完全消失,a、c点的温度相同,则溶解度相同,c点溶液中一定没有固体,故选项说法错误。
故选B。
2.D
【解答】解:A、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液不包含浓溶液,故选项说法错误。
B、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液与稀溶液属于交叉关系,故选项说法错误。
C、饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液;还能继续溶解这种溶质的溶液,叫做不饱和溶液;饱和溶液与不饱和溶液属于并列关系,故选项说法错误。
D、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,不饱和溶液可能是稀溶液,不饱和溶液与稀溶液属于交叉关系,故选项说法正确。
故选:D。
3.解:(1)小组同学配制了一杯如图所示的食盐溶液,同学们认为该溶液为食盐的饱和溶液。他们的证据是烧杯底部还有未溶解的固体,故答案为:烧杯底部还有未溶解的固体。
(2)上述食盐溶液只是食盐的饱和溶液,无法继续溶解食盐,该溶液还能继续溶解蔗糖,故答案为:能。
4.解:(1)通过对实验设计表格的分析,重点是看几组实验的条件发现探究的问题,主要有温度的改变;物质的改变;状态的改变;溶剂的改变等,由于物质的溶解性是物质本身的一种属性不受外界干扰,所以溶质的状态对物质溶解性无影响。故答案为:溶质的种类、溶剂的种类、温度、溶质的状态;溶质的状态;
(2)粉末状比块状的冰糖溶解速度快,温度越高,冰糖溶解速率更快,故冰糖溶解速率最快的是第四组;
故答案为:(1)溶质的种类、溶剂的种类、温度、溶质的状态;溶质的状态;
(2)四。
2023-2024学年上学期浙教版科学八年级“冲刺重高”讲义(五)
物质的溶解(1)
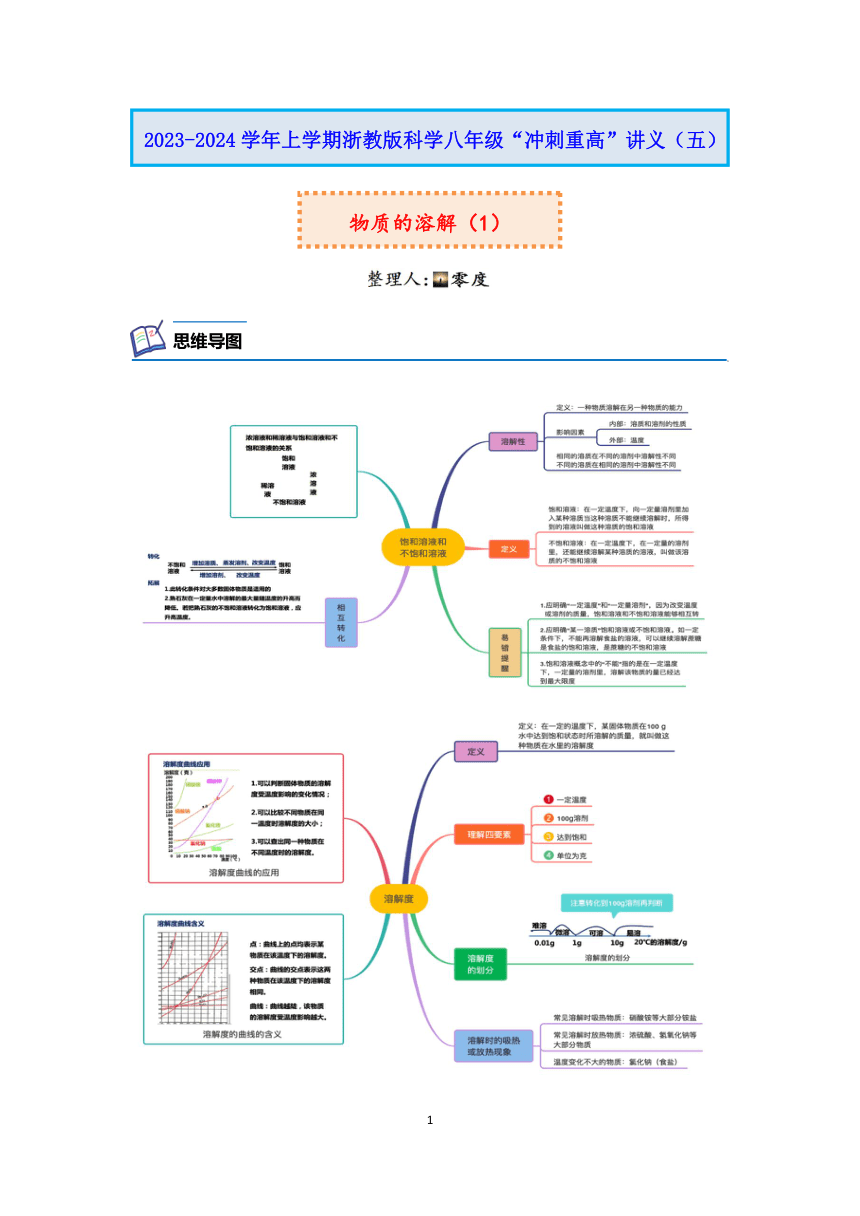
思维导图
①溶质的多少 ②溶质的性质 ③溶剂的多少 ④溶剂的性质
⑤溶液是否饱和 ⑥是否搅拌 ⑦温度
A.全部 B.②④⑦ C.②④⑤⑦ D.②③④⑤⑥
例2、如图为小温探究a物质溶解性的实验过程,下图各烧杯中的液体一定属于饱和溶液的是( )
A.乙 B.丙 C.乙、丙 D.丙、丁
例3、20℃时,将硝酸钾饱和溶液100克和200克,分别加热蒸发掉20克水后,冷却到原来的温度,各析出了晶体a克和b克,则a和b的关系是( )
A.a<b B.2a=b C.2b=a D.a=b
例4、表是在不同温度时硝酸钾的溶解度,下列说法正确的是( )
温度/℃ 0 20 40 60 80 100
溶解度/克 13.3 31.6 63.9 110 169 246
A.KNO3的溶解度受温度影响明显,其随温度的升高而增大
B.20℃时,200克水中,KNO3的溶解度是63.2克
C.40℃时,100克KNO3饱和溶液中含有溶质63.9克
D.100℃时水中溶解的硝酸钾一定比80℃时水中溶解的硝酸钾多
例5、小科发现很多物质都能在水中溶解,但溶解的速度有快有慢,她想:影响同种物质溶解速度的因素有哪些呢?小科根据生活经验以冰糖为例,提出了她的一些猜想:A与水的温度有关,B与冰糖颗粒的大小有关,C与是否搅拌有关。为了验证猜想是否正确,她设计了实验方案(实验中的烧杯完全相同),并进行了探究。下表是她在探究过程中记录的实验数据。
颗粒大小 水及温度 是否搅拌 溶解快慢
① 5克块状冰糖 100毫升、10℃的水 是 缓慢
② 5克块状冰糖 100毫升、80℃的水 是 较快
③ 5克粉末状冰糖 100毫升、80℃的水 是 快速
④ 5克粉末状冰糖 100毫升、80℃的水 否 较慢
(1)通过对比实验①和实验②的实验现象,可验证猜想 (填字母)。
(2)通过对比实验②和实验③的实验现象,得到的结论是:当水温等其他条件一定时, 。
(3)为了验证猜想C,应选择 进行比较。
(4)通过该实验得出物质的溶解快慢与 有关。
1.如图,这是市面上常见的感冒药,食用前需要将药粉倒入水中充分溶解。下面几个选项中能作为判断溶解后的感冒药溶液是饱和溶液的依据是( )
A.该溶液颜色很深 B.该溶液味道很苦
C.感冒药溶解的很快 D.感冒药固体有剩余
2.一木块漂浮于50℃的硝酸钾饱和溶液中,某一条件改变时,木块排开液体的体积随时间发生了如图所示的变化,下列条件可以达到目的是( )
①增加溶质②蒸发溶剂③增加溶剂④升高温度⑤降低温度
A.②④ B.①④ C.②③ D.③⑤
3.小明设计了一个比较物质溶解能力大小的实验方案,实验结果如下:
温度 溶质 溶剂 实验结果
20℃ 碘2g 酒精10g 全部溶解
20℃ 碘2g 水10g 部分溶解
从表格分析可知,影响物质溶解能力大小的因素是( )
A.温度 B.溶质的性质 C.溶剂的性质 D.溶液的质量
4.溶液的浓稀与饱和,不饱和之间的关系.
(1)不同溶质的溶液饱和,不饱和与浓稀之间没有必然联系,稀溶液 是不饱和溶液,浓溶液 是饱和溶液.
(2)同一溶质的溶液在同一温度下,饱和溶液一定比不饱和溶液要 .
5.某兴趣小组利用家中的调味品研究影响物质溶解性的因素,实验步骤设计如下:
①准备足量的白糖、食盐和冰糖,并将它们研磨成粉末待用。
②按下表进行实验并记录实验数据。(实验器材略)
试管编号 1号 2号 3号 4号
实验温度 20℃ 20℃ 20℃ 40℃
溶质种类 白糖 冰糖 食盐 冰糖
水的质量 10克 10克 10克 10克
(1)请在表中最后一行的第1个空格中填写需要记录的项目。
(2)从这个表格看,他们准备研究的影响因素为: 。
(3) 两支试管的数据可以为“白糖和冰糖是不是同一种物质这个问题提供证据”。
6.仔细阅读下面的探究实验信息,回答相关问题.
【实验目的】探究溶解过程中,溶液温度的变化情况.
【查阅资料】
(1)物质溶解于水的过程包括吸收热量(Q吸)的扩散过程和放出热量(Q放)的水合过程.
(2)实验条件下,水的凝固点为0℃、沸点为100℃.
【提出猜想】物质溶解过程中,溶液的温度可能升高或降低或不变.
【实验探究】某探究小组的同学设计了如图所示的两种方案.在图2所示方案中,每次加入物质b之前均使用温度计控制热水温度,使之保持在99℃.
【实验结论】
(1)图1所示实验中,若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度 (填“升高”或“降低”或“不变”,下同).
(2)图2所示实验中,若加入物质b后,热水会突然沸腾,说明溶液的温度 .
【拓展实验】按照图3所示进行实验.若物质c为NaOH,则U形管内的左边液面将 (填“高于”或“低于”或“等于”)右边液面.
【反思交流】
(1)该小组的同学进一步就物质溶解过程中溶液温度变化的原因展开了讨论,分析得出:若Q吸 Q放(填“>”或“<”或“=”),则溶液温度下降;若Q吸与Q放的相对大小与之相反,则溶液温度上升.
(2)在图2所示方案中,小张同学对实验现象很感兴趣,他继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,再继续加入相同质量的物质b,就看不到沸腾现象.请解释不再产生沸腾现象的原因 .
1.把一定量的硝酸铵固体加入装有蒸馏水的烧杯中,不断搅拌,用温度传感器记录溶解过程的温度变化(如图),实验中发现:a点烧杯中固体完全消失,b点有固体出现。由此可知( )
A.硝酸铵固体溶于水是放热过程 B.硝酸铵固体的溶解度随温度升高而增大
C.a点时,该溶液一定是不饱和溶液 D.c点时,烧杯中也一定有固体
2.许多科学知识在逻辑上存在如图所示关系,下列关于溶液说法正确的是( )
A.饱和溶液包含浓溶液
B.饱和溶液与稀溶液属于并列关系
C.饱和溶液与不饱和溶液属于交叉关系
D.不饱和溶液与稀溶液属于交叉关系
3.同学们在学习《物质的溶解》知识时,进行了如下实验。
(1)小组同学配制了一杯如图所示的食盐溶液,同学们认为该溶液为食盐的饱和溶液。他们的证据是 。
(2)关于上述食盐溶液是否能溶解蔗糖展开了讨论,根据你所学过的知识,你认为该溶液 (选填“能”或“不能”)继续溶解蔗糖。
4.某兴趣小组利用家中的材料研究影响物质溶解性的因素,实验步骤设计如下:
Ⅰ.称取六份冰糖和一份食盐,每10克为一份,并将其中五份冰糖研磨成粉末。
Ⅱ.按照表进行实验(实验所需仪器略)。
第一组 第二组 第三组 第四组
实验温度 20℃ 20℃ 20℃ 20℃ 20℃ 20℃ 80℃
固体种类 冰糖 冰糖 冰糖(粉末) 冰糖(块状) 冰糖 食盐 冰糖(粉末)
固体质量 10克 10克 10克 10克 10克 10克 10克
溶剂种类 水 植物油 水 水 水 水 水
溶剂质量 50克 50克 10克 10克 10克 10克 10克
请你对他们的实验设计进行分析:
(1)根据上述设计,你认为他们准备研究的影响因素有 ,其中不影响物质溶解性的因素是 。
(2)请你预测一下,冰糖溶解速率最快的是第 组。
答案及解析
例1、B
【分析】固体物质的溶解度受温度、溶质种类、溶解种类影响;
【解析】由分析可知:①溶质的多少、③溶剂的多少、⑤溶液是否饱和、 ⑥是否搅拌不会影响溶解度;
②溶质的性质、④溶剂的性质、⑦温度会影响物质的溶解度;
故选B。
例2、D
【解答】解:甲中溶液可能是恰好饱和的溶液,也可能是不饱和溶液;加热后温度升高,得到溶液乙,乙一定是不饱和溶液;冷却后,有晶体析出,则丙一定是饱和溶液;过滤后得到溶液丁,溶液丁一定是饱和溶液;则一定属于饱和溶液的是丙、丁。
故选:D。
例3、D
【解答】解:根据题意“20℃时,分别将200克硝酸钾饱和溶液与100克硝酸钾饱和溶液各蒸发掉20克水后,再降温到20℃,分别析出硝酸钾晶体a克与b克”,所析出晶体的质量均为20℃时20g水所溶解硝酸钾的最大质量,因此析出晶体质量相等,即a=b.所以,A、B、C错误。D正确。
故选:D。
例4、A
【解答】解:A、由在不同温度时硝酸钾的溶解度,KNO3的溶解度受温度影响明显,其随温度的升高而增大,故选项说法正确。
B、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;20℃时,硝酸钾的溶解度为31.6g,故选项说法错误。
C、40℃时,硝酸钾的溶解度为63.9g,含义是40℃时,100g水中最多能溶解硝酸钾63.9g,溶液达到饱和状态,形成饱和溶液163.9g;则40℃时,100克KNO3饱和溶液中含有溶质的质量小于63.9g,故选项说法错误。
D、选项说法没有指明温度,100℃时水中溶解的硝酸钾不一定比80℃时水中溶解的硝酸钾多,故选项说法错误。
故选:A。
例5、解:(1)实验①和实验②其他条件相同,只有温度不同,通过对比实验①和实验②的实验现象,温度高的溶解快,所以可验证猜想与水的温度有关;故答案为:A;
(2)通过对比实验②和实验③的实验现象,得到的结论是:当水温等其他条件一定时,粉末状冰糖溶解快,所以与冰糖颗粒的大小有关;故答案为:粉末状冰糖溶解快;
(3)为了验证猜想C与是否搅拌有关,通过观察表中的数据,应选择其他条件相同,只有搅拌与否,故可以选择③和④进行比较;故答案为:③和④;
(4)通过以上分析,该实验得出物质的溶解快慢与温度、颗粒的大小、以及是否搅拌有关;故答案为:温度、颗粒的大小、是否搅拌。
1.D
【解析】饱和溶液是指在一定温度下,一定量的溶剂中溶解,某种物质,当溶质不能继续溶解时形成的溶液是该温度下的饱和溶液,故判断溶解后的感冒药溶液是饱和溶液的依据是感冒药固体有剩余。故选D。
2.D
【解答】解:观察图象可知,木块排开液体的体积增大,由F=ρgV排,则液体的密度减小。
①增加溶质,不能继续溶解,溶液的密度不变,不符合要求。
②蒸发溶剂,有硝酸钾晶体析出,溶液仍是该温度下的饱和溶液,溶液的密度不变,不符合要求。
③增加溶剂,溶液的密度变小,符合要求。
④升高温度,硝酸钾的溶解度增大,但溶液的组成没有发生改变,不符合要求。
⑤硝酸钾的溶解度随着温度的升高而增大,温度降低,有硝酸钾晶体析出,溶液的密度变小,可采用降低温度的方法。
故③⑤符合题意。
故选:D。
3.C
【解答】解:除探究要素不同之外,其它条件都应该是相同的,从表格分析可知,除了溶剂的种类不同外,其它条件均相同,影响物质溶解能力大小的因素是溶剂的种类,即溶剂的性质。
故选:C。
4.解:(1)不同溶质的溶液饱和,不饱和与浓稀之间没有必然联系,稀溶液 不一定是不饱和溶液,浓溶液 不一定是饱和溶液.
(2)同一溶质的溶液在同一温度下,饱和溶液一定比不饱和溶液要 浓.
5.(1)研究影响物质溶解性的因素,表中最后一行的第1个空格中填写需要记录的项目溶解时间;根据溶解时间的长短,判断溶解速率的快慢;
(2)根据表格数据,水的质量相同,温度不同,溶质种类不同,故准备研究的影响因素为温度、溶质种类;
(3)1号和2号两支试管中实验温度、水的质量相同,溶质是白糖和冰糖,故两支试管的数据可以为“白糖和冰糖是不是同一种物质这个问题提供证据”。
故答案为:(1)溶解时间;(2)温度、溶质种类;(3)1号和2号。
6.解:(1)若加入物质a后,发现玻璃片与烧杯底部之间的水结冰,说明溶液的温度下降,故填:下降.
(2)若加入物质b后,热水会突然沸腾,说明溶液的温度升高,故填:升高.
【拓展实验】若物质c为NaOH,氢氧化钠溶于水放热,装置内的气压升高,则U形管内的左边液面将低于右边液面;故填:低于;
【反思交流】(1)若Q吸>Q放则溶液温度降低;
(2)继续向热水中加入相同质量的物质b,又看到沸腾现象,至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热,因此就看不到沸腾现象,故填:至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热.
故答案为:【实验结论】(1)降低;(2)升高.【拓展实验】低于.【反思交流】(1)>.(2)至烧杯中出现固体物质后,说明溶液达到饱和状态,再继续加入相同质量的物质b,不再溶解放热
1.B
【解析】A、根据图示可知硝酸铵溶于水后溶液中温度降低,则说明硝酸铵溶解过程吸热,故选项说法错误;
B、a点烧杯中固体完全消失,b点有固体析出,且ab段溶液温度降低,说明硝酸铵固体的溶解度随温度的降低而降低,则硝酸铵固体的溶解度随温度的升高而增大,故选项说法正确;
C、a点时固体完全溶解,也可能是恰好饱和的溶液,故选项说法错误;
D、a点时固体完全消失,a、c点的温度相同,则溶解度相同,c点溶液中一定没有固体,故选项说法错误。
故选B。
2.D
【解答】解:A、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液不包含浓溶液,故选项说法错误。
B、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液与稀溶液属于交叉关系,故选项说法错误。
C、饱和溶液是指在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液;还能继续溶解这种溶质的溶液,叫做不饱和溶液;饱和溶液与不饱和溶液属于并列关系,故选项说法错误。
D、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,不饱和溶液可能是稀溶液,不饱和溶液与稀溶液属于交叉关系,故选项说法正确。
故选:D。
3.解:(1)小组同学配制了一杯如图所示的食盐溶液,同学们认为该溶液为食盐的饱和溶液。他们的证据是烧杯底部还有未溶解的固体,故答案为:烧杯底部还有未溶解的固体。
(2)上述食盐溶液只是食盐的饱和溶液,无法继续溶解食盐,该溶液还能继续溶解蔗糖,故答案为:能。
4.解:(1)通过对实验设计表格的分析,重点是看几组实验的条件发现探究的问题,主要有温度的改变;物质的改变;状态的改变;溶剂的改变等,由于物质的溶解性是物质本身的一种属性不受外界干扰,所以溶质的状态对物质溶解性无影响。故答案为:溶质的种类、溶剂的种类、温度、溶质的状态;溶质的状态;
(2)粉末状比块状的冰糖溶解速度快,温度越高,冰糖溶解速率更快,故冰糖溶解速率最快的是第四组;
故答案为:(1)溶质的种类、溶剂的种类、温度、溶质的状态;溶质的状态;
(2)四。
2023-2024学年上学期浙教版科学八年级“冲刺重高”讲义(五)
物质的溶解(1)
思维导图
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
