浙教版科学2023-2024学年上学期八年级“冲刺重高”讲义(六):物质的溶解(2)(含解析)
文档属性
| 名称 | 浙教版科学2023-2024学年上学期八年级“冲刺重高”讲义(六):物质的溶解(2)(含解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 827.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-08-21 23:01:47 | ||
图片预览



文档简介
例1、25℃时向一定量不饱和KNO3(硝酸钾)溶液中逐渐加入KNO3(硝酸钾)固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )
A. B.
C. D.
例2、农业上常用溶质质量分数为16%的氯化钠溶液选种,如图所示为实验室配制该溶液的过程。下列分析错误的是( )
A.正确的实验操作顺序为④②①⑤③
B.③中玻璃棒的作用是搅拌,加快溶解
C.在称量氯化钠的过程中,若天平指针左偏,应向右移游码
D.再用量筒量取水时仰视读数,会使得溶液的质量分数偏小
例3、小明在配制一定溶质质量分数的氯化钠溶液时,向一定量的氯化钠颗粒中按如图方式加水,并充分搅拌。下列关于该过程中,溶液溶质质量分数与加入水的质量的关系图可能合理的是( )
A. B.
C. D.
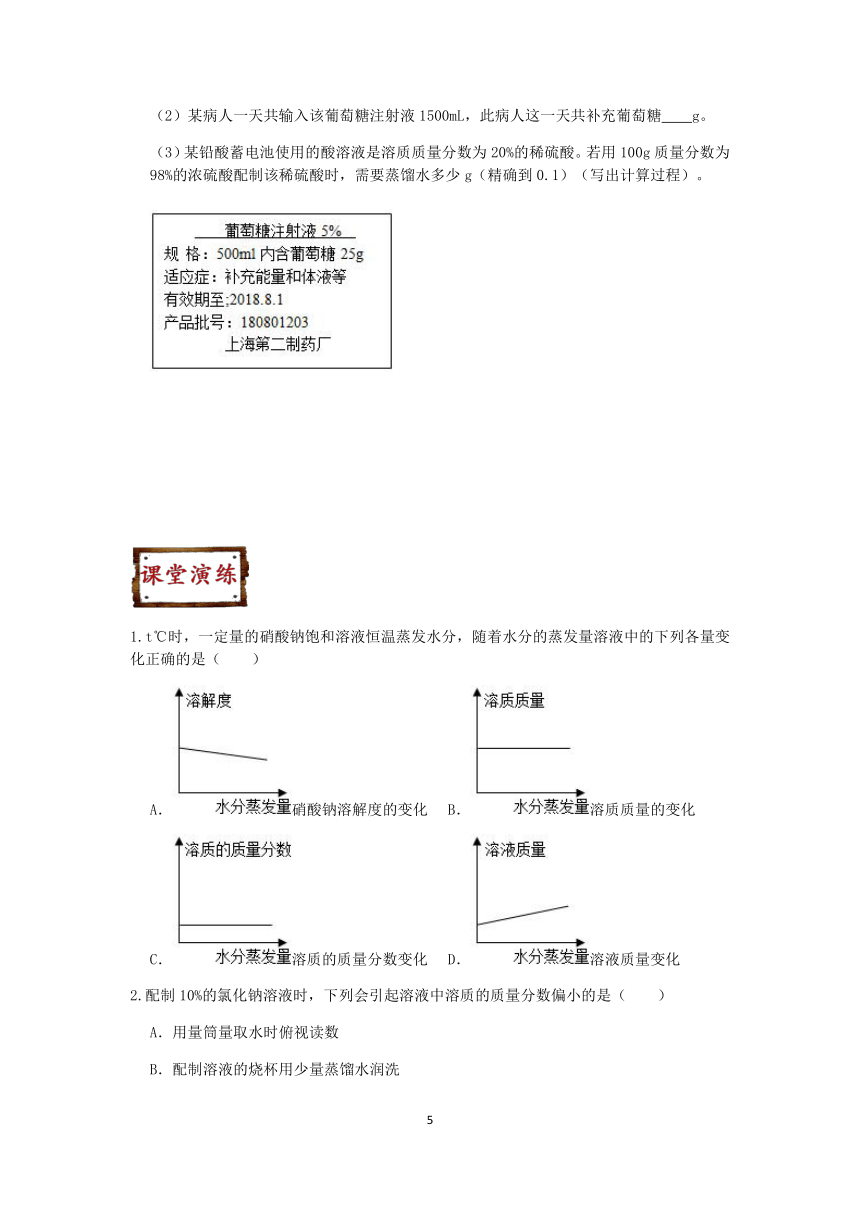
例4、向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )
资料:A的溶解度
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
A.②中A的质量分数最大 B.③⑤中A的质量分数相等
C.②④⑤的溶液为饱和溶液 D.①③④⑤中没有固体存在
例5、室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液( )
A.溶质质量相同 B.溶质质量分数相同
C.均为不饱和溶液 D.溶剂质量相同
例6、要使一定量20℃时的硝酸钾饱和溶液的浓度发生改变,可采取的措施有( )
①升高温度至30℃、②降低温度至10℃、③加2克硝酸钾、④加入2克水、⑤蒸发掉2克水,再恢复到20℃、⑥加入20℃的硝酸钾饱和溶液2克.
A.①②③④⑤ B.①④⑤ C.②④ D.全部
例7、下图是配制50克质量分数为10%的氯化钠溶液的操作过程。请回答:
(1)实验所需氯化钠的质量为 克。
(2)称量时,若天平指针偏右,则下一步的操作是 。
例8、医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)从该溶液中取出10mL,则取出溶液中溶质的质量分数为 。
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖 g。
(3)某铅酸蓄电池使用的酸溶液是溶质质量分数为20%的稀硫酸。若用100g质量分数为98%的浓硫酸配制该稀硫酸时,需要蒸馏水多少g(精确到0.1)(写出计算过程)。
1.t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发量溶液中的下列各量变化正确的是( )
A.硝酸钠溶解度的变化 B.溶质质量的变化
C.溶质的质量分数变化 D.溶液质量变化
2.配制10%的氯化钠溶液时,下列会引起溶液中溶质的质量分数偏小的是( )
A.用量筒量取水时俯视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.用天平称量氯化钠时,指针左偏,其他操作均正常
D.转移已配好的溶液时,有少量的溶液溅出
3.如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图,下列分析中,不正确的是( )
A.图乙中,若指针偏向分度盘的右侧,下一步操作是在左盘中继续加氯化钠直到天平平衡
B.图丙中,该烧杯用少量蒸馏水润洗过,制得溶液的溶质质量分数偏小
C.图丁中,若量取水的体积时俯视读数,则制得溶液的溶质质量分数偏大
D.图戊中,玻璃棒的作用是通过搅拌提高氯化钠的溶解度
4.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致其质量分数偏小的是( )
①称量的氯化钠固体中含有不溶性杂质
②用量筒量取水时仰视读数
③往烧杯中加水时有水洒出
④将配制好的溶液装入试剂瓶中时有少量溅出
A.①② B.①③ C.②④ D.③④
5.如图是配制50g质量分数为5%的氯化钠溶液的操作过程示意图:
(1)B操作,在称量中发现指针偏向左边,接下来的操作是___________;
(2)E操作中玻璃棒的作用是___________。
(3)如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是___________。
A.所用氯化钠药品不纯 B.配完后将溶液转移至试剂瓶时洒出了一些
C.量取水时仰视读数 D.将量好的水从量筒里倒入烧杯时,洒出一些水
1.2021年3月12日温州市初中毕业生进行综合素质测评之实验操作考查,小科同学抽到的实验是配制50克5%的NaCl溶液,下列操作会导致所配溶液溶质质量分数大于5%的是( )
A.称取氯化钠 B.转移氯化钠时,有固体洒出
C.量取水 D.装瓶时,有液体洒出
2.海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入淡水池,而海水中的各种溶质不能通过淡化膜,从而得到淡水。对加压后右侧海水成分进行分析,正确的是( )
A.海水的溶质质量分数增大
B.溶剂质量增多
C.海水质量不变
D.溶质质量增多
3.小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。
(1)需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。
(2)量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。
(3)丙中玻璃棒的作用是 。
(4)下列操作会导致配制的氯化钠溶液质量分数偏小的有 。
A.砝码磨损
B.氯化钠固体不纯
C.按照图乙的方法读数
D.将量筒中的水倒入烧杯时,有水洒出
答案及解析
例1、C解:A、不饱和(硝酸钾)溶液中含有一定量的溶质硝酸钾;
B、向一定量不饱和(硝酸钾)溶液中逐渐加入(硝酸钾)固体时,硝酸钾能够继续溶解,直到达到饱和状态;
C、向一定量不饱和(硝酸钾)溶液中逐渐加入(硝酸钾)固体时,硝酸钾能够继续溶解,达到饱和状态时不再溶解;
D、在一定温度下,在一定量的溶剂里,硝酸钾不能无限溶解。
故选:C。
例2、C
【解析】A、配制一定溶质质量分数溶液的实验步骤为计算、称量、量取、溶解、装瓶,分析图示可知,实验操作顺序为④②①⑤③,故说法正确;
B、用玻璃棒搅拌的目的是加快溶解速率,故说法正确;
C、配制100g 16%氯化钠溶液,称取氯化钠的质量为100g×16%=16g,是定值,②中称量氯化钠的过程中,若天平指针左偏,说明氯化钠多了,需减少氯化钠使天平平衡,故说法错误;
D、量筒的读数“仰小俯大”,用量筒量取水时仰视读数,量取水的体积偏大,则所得溶液的溶质质量分数偏小,故说法正确。
故选C。
例3、D解:A、加入75克水后烧杯中已无固体,再加25克水,溶质质量不变,溶剂质量加大,溶质的质量分数应该降低,故A错误;
B、加入75克水后烧杯中无固体,此时溶液可能为不饱和溶液,如图B所示加水75克时接近饱和溶液,再加水25克,溶质质量不变,溶剂质量只增加了25%,溶质的质量分数应稍降低,图B显示溶质的质量分数降低了约50%,故B错误;
C、加入75克水后烧杯中无固体,此时溶液可能为饱和溶液,如图C所示加水75克时为饱和溶液,再加水25克,溶质质量不变,溶剂质量只增加了25%,溶质的质量分数应稍降低,图C显示溶质的质量分数降低了约50%,故C错误;
D、加入75克水后烧杯中无固体,此时溶液可能为饱和溶液,如图D所示加水75克时为饱和溶液,再加水25克,溶质质量不变,溶剂质量只增加了25%,溶质的质量分数稍降低,故D正确;
故应选:D。
例4、D解:A、由表格数据可知,A物质的溶解度随着温度的升高而增大,30℃时A的溶解度为41.4g,则25℃时A的溶解度小于41.4g;则②中A固体不能全部溶解;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g;50℃时A的溶解度为50.4g,所得溶液恰好饱和;则④⑤中A的质量分数最大,故选项说法错误。
B、③⑤中溶剂的质量相等,⑤中溶解的A固体多,③⑤中A的质量分数不相等,故选项说法错误。
C、根据A选项的分析,②⑤的溶液为饱和溶液;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g,为不饱和溶液,故选项说法错误。
D、20℃时A的溶解度为37.2g,A物质的溶解度随着温度的升高而增大,则①中固体能全部溶解;根据A选项的分析,③④⑤中没有固体存在,即①③④⑤中没有固体存在,故选项说法正确。
故选:D。
例5、A解:A、由于溶液有均一性,在将甲转移溶液50mL时,甲、乙溶液中溶质质量相同。故A正确;
B、由题意可知,甲、乙溶液中溶质质量相同,溶剂的质量不同,溶质质量分数不同。故B错误;
C、由题可知,甲溶液是饱和溶液,乙是不饱和溶液。故C错误;
D、由题意可知,甲、乙溶液中溶质质量相同,溶剂的质量不同,故D错误。
故选:A。
例6、C解:由于增加溶质、蒸发溶剂或者是加入同温度下的同一物质的饱和溶液,都还是20℃时的硝酸钾的饱和溶液,溶液中溶质的质量分数都相等;由于硝酸钾的溶解度随温度的升高而增大,因此给硝酸钾的饱和溶液升温,饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变;而降温溶液中就会有晶体析出,溶液中溶质的质量分数就会减小;往饱和溶液中加水,就会稀释溶液,溶液中溶质的质量分数也会减小,故选C。
例7、解:(1)由溶质质量=溶液质量×溶质质量分数可知,配制50克质量分数为10%的氯化钠溶液,所需氯化钠的质量为50g×10%=5g;
(2)天平称量正确的操作是左物右码,称量时,指针偏右说明所加左盘的氯化钠质量偏小,则下一步的操作是增加氯化钠的质量直至天平平衡。
故答案为:(1)5;
(2)增加氯化钠的质量直至天平平衡。
例8、解:(1)溶液具有均一性,从该溶液中取出10mL,则取出溶液中溶质的质量分数仍为5%。
(2)500ml含葡萄糖25g,某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖的质量为25g75g。
(3)设需要蒸馏水的质量为x,根据溶液稀释前后溶质的质量不变,
则100g×98%=(100g+x)×20% x=390.0g。
答:需要蒸馏水390.0g。
故答案为:(1)5%;(2)75;(3)390.0。
1.C
【解答】解:A、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,温度不变,溶解度不变,故选项图象错误。
B、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发,有硝酸钾晶体析出,溶质的质量逐渐减少,故选项图象错误。
C、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发,有硝酸钾晶体析出,所得溶液仍为该温度下的饱和溶液,溶质质量分数不变,故选项图象正确。
D、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发,有硝酸钾晶体析出,溶液的质量逐渐减少,故选项图象错误。
故选:C。
2.B
【解答】解:A、用量筒量取水时俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项错误。
B、配制溶液的烧杯用少量蒸馏水润洗,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确。
C、用天平称量氯化钠时,指针左偏,其他操作均正常,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项错误。
D、转移已配好的溶液时,有少量的溶液溅出,溶液具有均一性,溶质质量分数不变,故选项错误。
故选:B。
3.D
【解答】解:A、指针偏向分度盘的右侧,说明药品的质量小于砝码的质量,应进行的操作是继续向左盘添加氯化钠,直至天平平衡,故选项说法正确。
B、该烧杯用少量蒸馏水润洗过,会造成实际取用的水的体积偏大,则使溶质质量分数偏小,故选项说法正确。
C、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项说法正确。
D、玻璃棒的作用是通过搅拌,加快溶解速率,不能改变该温度下氯化钠在100g溶剂里达到饱和状态所溶解的溶质质量,不能提高氯化钠的溶解度,故选项说法错误。
故选:D。
4.A
【解答】解:①称量含不溶性杂质的氯化钠来配制溶液,溶质的质量偏小,溶质质量分数偏小。
②用量筒取水时仰视读数,水的实际体积偏大,溶质质量分数偏小。
③往烧杯中加水时有水酒出,会造成实际取用的水的体积偏小,则使溶质质量分数偏大。
④将配制好的溶液装入试剂瓶中时有少量溅出,溶液具有均一性,溶质质量分数不变。
故②①会导致结果偏小。
故选:A。
5.从左盘中取出一些氯化钠,直至托盘天平平衡 加快固体的溶解 AC/CA
【解析】(1)B操作是使用托盘天平称量一定质量的氯化钠,在称量中发现指针偏向左边,说明左盘中氯化钠的质量多余要求的质量,接下来的操作是从左盘中取出一些氯化钠,直至托盘天平平衡,故填从左盘中取出一些氯化钠,直至托盘天平平衡。
(2)E操作为溶解,其中玻璃棒的作用是搅拌,加快固体的溶解,故填加快固体的溶解。
(3)A 所用氯化钠药品不纯,即称取的氯化钠的质量偏小,则所配溶液的溶质质量分数偏小,选项正确;
B 溶液具有均一性,配完后将溶液转移至试剂瓶时洒出了一些,不影响溶液的溶质质量分数,至少试剂瓶中的溶液的质量少一些,选项错误;
C 量取水时仰视读数,读数小于水的实际体积,即量取的水的体积偏大,所配溶液的溶质质量分数偏小,选项正确;
D 将量好的水从量筒里倒入烧杯时,洒出一些水,烧杯中的水的质量偏小,所配溶液的溶质质量分数偏大,选项错误;
1.C
【解析】A.称取氯化钠时,将氯化钠放在左盘,砝码放在右盘 ,根据“砝码质量=氯化钠质量+游码质量”可知,此时得到氯化钠的质量偏小,故A不合题意。
B.转移氯化钠时,有固体洒出,则溶质氯化钠的质量偏小,故B不合题意。
C.量取水时俯视读数,根据“俯视大仰视小”的规律可知,此时读出的示数偏大,而实际得到水的质量偏小,会导致所配溶液溶质质量分数大于5%,故C符合题意。
D.装瓶时,有液体洒出,因为溶液具有均一性,所以不会影响溶液的溶质质量分数,故D不合题意。
故选C.
2.A解:A、加压后,溶质不能通过淡化膜,加压后的右侧海水中溶质不变,溶剂质量减少,溶质质量分数增大,故选项说法正确。
B、加压后,水分子可以透过淡化膜进入左侧淡化,故加压后的右侧海水中溶剂的质量减少,故选项说法错误。
C、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后海水质量减少,故选项说法错误。
D、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后,右侧海水中溶质的质量不变,故该选项说法错误。
故选:A。
3.解:(1)溶质质量=溶液质量×溶质的质量,溶质氯化钠的质量是80g×5%=4g;天平称量正确的操作是左物右码,称量时出现右盘略低说明左盘所加氯化钠的质量偏小,应在左盘增加氯化钠固体的质量直至天平平衡;
(2)溶剂的质量=溶液质量﹣溶质质量,溶剂水的质量为80g﹣80g×5%=76g,水的密度为1g/ml,所以水的体积为76ml,应选100ml量筒;
(3)溶解过程中玻璃棒的作用是搅拌,加速氯化钠的溶解速率;
(4)溶质质量分数100%,溶质氯化钠的质量偏小会导致氯化钠溶液质量分数偏小,溶剂质量增加会导致氯化钠溶液质量分数偏小,A、砝码磨损会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,B、氯化钠固体不纯会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,C、仰视会导致所取水的质量增加,氯化钠溶液质量分数偏小,D、将量筒中的水倒入烧杯时,有水洒出,导致溶液质量偏小,氯化钠溶质质量分数偏大。
故答案为:(1)4;左盘增加氯化钠固体的质量直至天平平衡;(2)100;
(3)搅拌,加速氯化钠的溶解速率;(4)ABC。
2023-2024学年上学期浙教版科学八年级“冲刺重高”讲义(六)
物质的溶解(2)
思维导图
A. B.
C. D.
例2、农业上常用溶质质量分数为16%的氯化钠溶液选种,如图所示为实验室配制该溶液的过程。下列分析错误的是( )
A.正确的实验操作顺序为④②①⑤③
B.③中玻璃棒的作用是搅拌,加快溶解
C.在称量氯化钠的过程中,若天平指针左偏,应向右移游码
D.再用量筒量取水时仰视读数,会使得溶液的质量分数偏小
例3、小明在配制一定溶质质量分数的氯化钠溶液时,向一定量的氯化钠颗粒中按如图方式加水,并充分搅拌。下列关于该过程中,溶液溶质质量分数与加入水的质量的关系图可能合理的是( )
A. B.
C. D.
例4、向100g水中不断加入固体A或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )
资料:A的溶解度
温度/℃ 20 30 40 50 60
溶解度/g 37.2 41.4 45.8 50.4 55.2
A.②中A的质量分数最大 B.③⑤中A的质量分数相等
C.②④⑤的溶液为饱和溶液 D.①③④⑤中没有固体存在
例5、室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液( )
A.溶质质量相同 B.溶质质量分数相同
C.均为不饱和溶液 D.溶剂质量相同
例6、要使一定量20℃时的硝酸钾饱和溶液的浓度发生改变,可采取的措施有( )
①升高温度至30℃、②降低温度至10℃、③加2克硝酸钾、④加入2克水、⑤蒸发掉2克水,再恢复到20℃、⑥加入20℃的硝酸钾饱和溶液2克.
A.①②③④⑤ B.①④⑤ C.②④ D.全部
例7、下图是配制50克质量分数为10%的氯化钠溶液的操作过程。请回答:
(1)实验所需氯化钠的质量为 克。
(2)称量时,若天平指针偏右,则下一步的操作是 。
例8、医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)从该溶液中取出10mL,则取出溶液中溶质的质量分数为 。
(2)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖 g。
(3)某铅酸蓄电池使用的酸溶液是溶质质量分数为20%的稀硫酸。若用100g质量分数为98%的浓硫酸配制该稀硫酸时,需要蒸馏水多少g(精确到0.1)(写出计算过程)。
1.t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发量溶液中的下列各量变化正确的是( )
A.硝酸钠溶解度的变化 B.溶质质量的变化
C.溶质的质量分数变化 D.溶液质量变化
2.配制10%的氯化钠溶液时,下列会引起溶液中溶质的质量分数偏小的是( )
A.用量筒量取水时俯视读数
B.配制溶液的烧杯用少量蒸馏水润洗
C.用天平称量氯化钠时,指针左偏,其他操作均正常
D.转移已配好的溶液时,有少量的溶液溅出
3.如图是配制50克质量分数为5%的氯化钠溶液的操作过程示意图,下列分析中,不正确的是( )
A.图乙中,若指针偏向分度盘的右侧,下一步操作是在左盘中继续加氯化钠直到天平平衡
B.图丙中,该烧杯用少量蒸馏水润洗过,制得溶液的溶质质量分数偏小
C.图丁中,若量取水的体积时俯视读数,则制得溶液的溶质质量分数偏大
D.图戊中,玻璃棒的作用是通过搅拌提高氯化钠的溶解度
4.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致其质量分数偏小的是( )
①称量的氯化钠固体中含有不溶性杂质
②用量筒量取水时仰视读数
③往烧杯中加水时有水洒出
④将配制好的溶液装入试剂瓶中时有少量溅出
A.①② B.①③ C.②④ D.③④
5.如图是配制50g质量分数为5%的氯化钠溶液的操作过程示意图:
(1)B操作,在称量中发现指针偏向左边,接下来的操作是___________;
(2)E操作中玻璃棒的作用是___________。
(3)如果配制过程中出现以下情况,可能导致所配溶液的溶质质量分数偏小的是___________。
A.所用氯化钠药品不纯 B.配完后将溶液转移至试剂瓶时洒出了一些
C.量取水时仰视读数 D.将量好的水从量筒里倒入烧杯时,洒出一些水
1.2021年3月12日温州市初中毕业生进行综合素质测评之实验操作考查,小科同学抽到的实验是配制50克5%的NaCl溶液,下列操作会导致所配溶液溶质质量分数大于5%的是( )
A.称取氯化钠 B.转移氯化钠时,有固体洒出
C.量取水 D.装瓶时,有液体洒出
2.海水淡化可采用膜分离技术。如图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入淡水池,而海水中的各种溶质不能通过淡化膜,从而得到淡水。对加压后右侧海水成分进行分析,正确的是( )
A.海水的溶质质量分数增大
B.溶剂质量增多
C.海水质量不变
D.溶质质量增多
3.小科欲配制80克5%的氯化钠溶液,该实验的部分操作如图所示。
(1)需要称取氯化钠的质量 克。称量时出现了右盘略低的现象,如图甲,接下来的具体操作是 。
(2)量取水时,选用规格为 (选填“100”或“200”)毫升的量筒更加合理。
(3)丙中玻璃棒的作用是 。
(4)下列操作会导致配制的氯化钠溶液质量分数偏小的有 。
A.砝码磨损
B.氯化钠固体不纯
C.按照图乙的方法读数
D.将量筒中的水倒入烧杯时,有水洒出
答案及解析
例1、C解:A、不饱和(硝酸钾)溶液中含有一定量的溶质硝酸钾;
B、向一定量不饱和(硝酸钾)溶液中逐渐加入(硝酸钾)固体时,硝酸钾能够继续溶解,直到达到饱和状态;
C、向一定量不饱和(硝酸钾)溶液中逐渐加入(硝酸钾)固体时,硝酸钾能够继续溶解,达到饱和状态时不再溶解;
D、在一定温度下,在一定量的溶剂里,硝酸钾不能无限溶解。
故选:C。
例2、C
【解析】A、配制一定溶质质量分数溶液的实验步骤为计算、称量、量取、溶解、装瓶,分析图示可知,实验操作顺序为④②①⑤③,故说法正确;
B、用玻璃棒搅拌的目的是加快溶解速率,故说法正确;
C、配制100g 16%氯化钠溶液,称取氯化钠的质量为100g×16%=16g,是定值,②中称量氯化钠的过程中,若天平指针左偏,说明氯化钠多了,需减少氯化钠使天平平衡,故说法错误;
D、量筒的读数“仰小俯大”,用量筒量取水时仰视读数,量取水的体积偏大,则所得溶液的溶质质量分数偏小,故说法正确。
故选C。
例3、D解:A、加入75克水后烧杯中已无固体,再加25克水,溶质质量不变,溶剂质量加大,溶质的质量分数应该降低,故A错误;
B、加入75克水后烧杯中无固体,此时溶液可能为不饱和溶液,如图B所示加水75克时接近饱和溶液,再加水25克,溶质质量不变,溶剂质量只增加了25%,溶质的质量分数应稍降低,图B显示溶质的质量分数降低了约50%,故B错误;
C、加入75克水后烧杯中无固体,此时溶液可能为饱和溶液,如图C所示加水75克时为饱和溶液,再加水25克,溶质质量不变,溶剂质量只增加了25%,溶质的质量分数应稍降低,图C显示溶质的质量分数降低了约50%,故C错误;
D、加入75克水后烧杯中无固体,此时溶液可能为饱和溶液,如图D所示加水75克时为饱和溶液,再加水25克,溶质质量不变,溶剂质量只增加了25%,溶质的质量分数稍降低,故D正确;
故应选:D。
例4、D解:A、由表格数据可知,A物质的溶解度随着温度的升高而增大,30℃时A的溶解度为41.4g,则25℃时A的溶解度小于41.4g;则②中A固体不能全部溶解;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g;50℃时A的溶解度为50.4g,所得溶液恰好饱和;则④⑤中A的质量分数最大,故选项说法错误。
B、③⑤中溶剂的质量相等,⑤中溶解的A固体多,③⑤中A的质量分数不相等,故选项说法错误。
C、根据A选项的分析,②⑤的溶液为饱和溶液;60℃时A的溶解度为55.2g,④中A固体能全部溶解,溶解的质量为37.2g+4.2g+9g=50.4g,为不饱和溶液,故选项说法错误。
D、20℃时A的溶解度为37.2g,A物质的溶解度随着温度的升高而增大,则①中固体能全部溶解;根据A选项的分析,③④⑤中没有固体存在,即①③④⑤中没有固体存在,故选项说法正确。
故选:D。
例5、A解:A、由于溶液有均一性,在将甲转移溶液50mL时,甲、乙溶液中溶质质量相同。故A正确;
B、由题意可知,甲、乙溶液中溶质质量相同,溶剂的质量不同,溶质质量分数不同。故B错误;
C、由题可知,甲溶液是饱和溶液,乙是不饱和溶液。故C错误;
D、由题意可知,甲、乙溶液中溶质质量相同,溶剂的质量不同,故D错误。
故选:A。
例6、C解:由于增加溶质、蒸发溶剂或者是加入同温度下的同一物质的饱和溶液,都还是20℃时的硝酸钾的饱和溶液,溶液中溶质的质量分数都相等;由于硝酸钾的溶解度随温度的升高而增大,因此给硝酸钾的饱和溶液升温,饱和溶液就会变成不饱和溶液,但溶液中溶质的质量分数不变;而降温溶液中就会有晶体析出,溶液中溶质的质量分数就会减小;往饱和溶液中加水,就会稀释溶液,溶液中溶质的质量分数也会减小,故选C。
例7、解:(1)由溶质质量=溶液质量×溶质质量分数可知,配制50克质量分数为10%的氯化钠溶液,所需氯化钠的质量为50g×10%=5g;
(2)天平称量正确的操作是左物右码,称量时,指针偏右说明所加左盘的氯化钠质量偏小,则下一步的操作是增加氯化钠的质量直至天平平衡。
故答案为:(1)5;
(2)增加氯化钠的质量直至天平平衡。
例8、解:(1)溶液具有均一性,从该溶液中取出10mL,则取出溶液中溶质的质量分数仍为5%。
(2)500ml含葡萄糖25g,某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖的质量为25g75g。
(3)设需要蒸馏水的质量为x,根据溶液稀释前后溶质的质量不变,
则100g×98%=(100g+x)×20% x=390.0g。
答:需要蒸馏水390.0g。
故答案为:(1)5%;(2)75;(3)390.0。
1.C
【解答】解:A、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,温度不变,溶解度不变,故选项图象错误。
B、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发,有硝酸钾晶体析出,溶质的质量逐渐减少,故选项图象错误。
C、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发,有硝酸钾晶体析出,所得溶液仍为该温度下的饱和溶液,溶质质量分数不变,故选项图象正确。
D、t℃时,一定量的硝酸钠饱和溶液恒温蒸发水分,随着水分的蒸发,有硝酸钾晶体析出,溶液的质量逐渐减少,故选项图象错误。
故选:C。
2.B
【解答】解:A、用量筒量取水时俯视读数,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项错误。
B、配制溶液的烧杯用少量蒸馏水润洗,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项正确。
C、用天平称量氯化钠时,指针左偏,其他操作均正常,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项错误。
D、转移已配好的溶液时,有少量的溶液溅出,溶液具有均一性,溶质质量分数不变,故选项错误。
故选:B。
3.D
【解答】解:A、指针偏向分度盘的右侧,说明药品的质量小于砝码的质量,应进行的操作是继续向左盘添加氯化钠,直至天平平衡,故选项说法正确。
B、该烧杯用少量蒸馏水润洗过,会造成实际取用的水的体积偏大,则使溶质质量分数偏小,故选项说法正确。
C、用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大,故选项说法正确。
D、玻璃棒的作用是通过搅拌,加快溶解速率,不能改变该温度下氯化钠在100g溶剂里达到饱和状态所溶解的溶质质量,不能提高氯化钠的溶解度,故选项说法错误。
故选:D。
4.A
【解答】解:①称量含不溶性杂质的氯化钠来配制溶液,溶质的质量偏小,溶质质量分数偏小。
②用量筒取水时仰视读数,水的实际体积偏大,溶质质量分数偏小。
③往烧杯中加水时有水酒出,会造成实际取用的水的体积偏小,则使溶质质量分数偏大。
④将配制好的溶液装入试剂瓶中时有少量溅出,溶液具有均一性,溶质质量分数不变。
故②①会导致结果偏小。
故选:A。
5.从左盘中取出一些氯化钠,直至托盘天平平衡 加快固体的溶解 AC/CA
【解析】(1)B操作是使用托盘天平称量一定质量的氯化钠,在称量中发现指针偏向左边,说明左盘中氯化钠的质量多余要求的质量,接下来的操作是从左盘中取出一些氯化钠,直至托盘天平平衡,故填从左盘中取出一些氯化钠,直至托盘天平平衡。
(2)E操作为溶解,其中玻璃棒的作用是搅拌,加快固体的溶解,故填加快固体的溶解。
(3)A 所用氯化钠药品不纯,即称取的氯化钠的质量偏小,则所配溶液的溶质质量分数偏小,选项正确;
B 溶液具有均一性,配完后将溶液转移至试剂瓶时洒出了一些,不影响溶液的溶质质量分数,至少试剂瓶中的溶液的质量少一些,选项错误;
C 量取水时仰视读数,读数小于水的实际体积,即量取的水的体积偏大,所配溶液的溶质质量分数偏小,选项正确;
D 将量好的水从量筒里倒入烧杯时,洒出一些水,烧杯中的水的质量偏小,所配溶液的溶质质量分数偏大,选项错误;
1.C
【解析】A.称取氯化钠时,将氯化钠放在左盘,砝码放在右盘 ,根据“砝码质量=氯化钠质量+游码质量”可知,此时得到氯化钠的质量偏小,故A不合题意。
B.转移氯化钠时,有固体洒出,则溶质氯化钠的质量偏小,故B不合题意。
C.量取水时俯视读数,根据“俯视大仰视小”的规律可知,此时读出的示数偏大,而实际得到水的质量偏小,会导致所配溶液溶质质量分数大于5%,故C符合题意。
D.装瓶时,有液体洒出,因为溶液具有均一性,所以不会影响溶液的溶质质量分数,故D不合题意。
故选C.
2.A解:A、加压后,溶质不能通过淡化膜,加压后的右侧海水中溶质不变,溶剂质量减少,溶质质量分数增大,故选项说法正确。
B、加压后,水分子可以透过淡化膜进入左侧淡化,故加压后的右侧海水中溶剂的质量减少,故选项说法错误。
C、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后海水质量减少,故选项说法错误。
D、由题意,水分子可以透过淡化膜进入左侧淡水池,而海水中其他各种溶质不能通过淡水膜,加压后,右侧海水中溶质的质量不变,故该选项说法错误。
故选:A。
3.解:(1)溶质质量=溶液质量×溶质的质量,溶质氯化钠的质量是80g×5%=4g;天平称量正确的操作是左物右码,称量时出现右盘略低说明左盘所加氯化钠的质量偏小,应在左盘增加氯化钠固体的质量直至天平平衡;
(2)溶剂的质量=溶液质量﹣溶质质量,溶剂水的质量为80g﹣80g×5%=76g,水的密度为1g/ml,所以水的体积为76ml,应选100ml量筒;
(3)溶解过程中玻璃棒的作用是搅拌,加速氯化钠的溶解速率;
(4)溶质质量分数100%,溶质氯化钠的质量偏小会导致氯化钠溶液质量分数偏小,溶剂质量增加会导致氯化钠溶液质量分数偏小,A、砝码磨损会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,B、氯化钠固体不纯会导致所取氯化钠的质量偏小,氯化钠溶液质量分数偏小,C、仰视会导致所取水的质量增加,氯化钠溶液质量分数偏小,D、将量筒中的水倒入烧杯时,有水洒出,导致溶液质量偏小,氯化钠溶质质量分数偏大。
故答案为:(1)4;左盘增加氯化钠固体的质量直至天平平衡;(2)100;
(3)搅拌,加速氯化钠的溶解速率;(4)ABC。
2023-2024学年上学期浙教版科学八年级“冲刺重高”讲义(六)
物质的溶解(2)
思维导图
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
