化学人教版(2019)选择性必修1 3.2.1水的电离(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2.1水的电离(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-21 21:35:13 | ||
图片预览









文档简介
(共31张PPT)
第三章·
水溶液中的离子反应与平衡
第二节
水的电离 溶液的酸碱性
第1课时 水的电离
H2O是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。
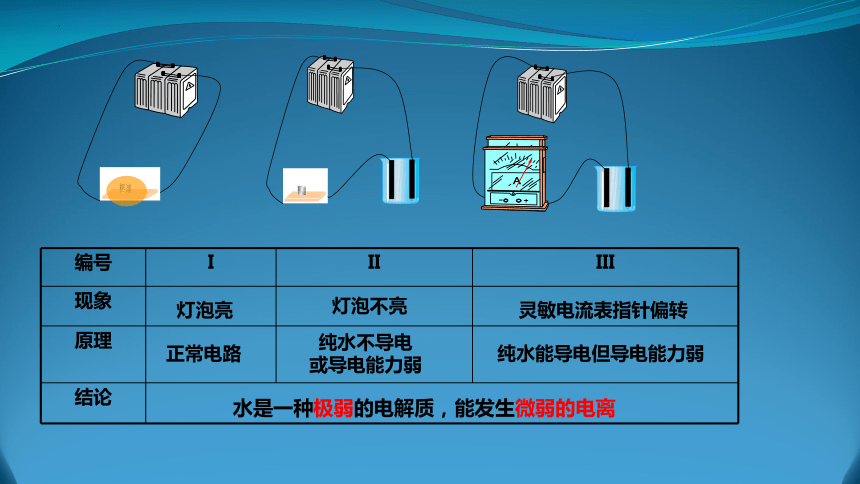
水的导电性实验
编号 I II III
现象
原理
结论
灯泡不亮
水是一种极弱的电解质,能发生微弱的电离
正常电路
纯水不导电
或导电能力弱
灯泡亮
灵敏电流表指针偏转
纯水能导电但导电能力弱
目录
水的电离与水的离子积常数
01
酸碱溶液中水电离的计算
02
习
学
目
标
1.认识水的电离
2.了解水的离子积常数
3.了解水的电离平衡及影响因素
NO.1
水的电离
与
水的离子积常数
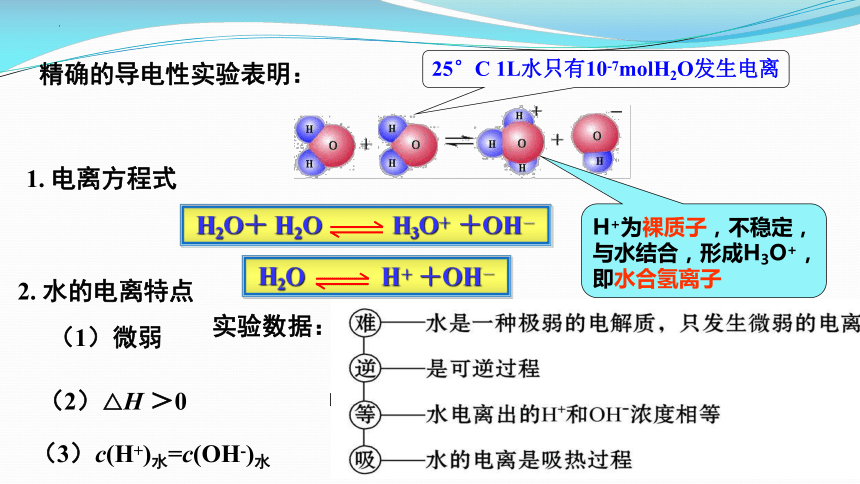
H2O+ H2O H3O+ +OH-
H2O H+ +OH-
H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
精确的导电性实验表明:
1. 电离方程式
2. 水的电离特点
(1)微弱
实验数据:25℃ 时 1 L 水约等于 55.6 mol
约有 10-7 mol H2O 分子发生电离
25°C 1L水只有10-7molH2O发生电离
电离程度 ≈ ≈ 2×10-9
10-7
55.6
(2)△H >0
(3)c(H+)水=c(OH-)水
K电离·c(H2O) = c ( H+)·c( OH-)
室温下1L(55.6mol)H2O中,只有1×10-7 molH2O电离,电离的水可以忽略不计,因此C(H2O)可视为常数
KW
表达式:KW=c(H+)·c(OH-)
1.定义:一定温度时,水(稀溶液)中c(H+)与c(OH-)的乘积是一个常数Kw,即水的离子积常数,简称水的离子积。
常温时,c(H+)=c(OH-)=1×10-7 mol/L
常温时,KW=c(H+)·c(OH-)=1×10-14
K电离=
c(H+)×c(OH-)
c(H2O)
H2O H+ + OH-
【思考】如何衡量水的电离的限度?
注:c(H2O)=
1 L
1000 g
18 g·mol-1
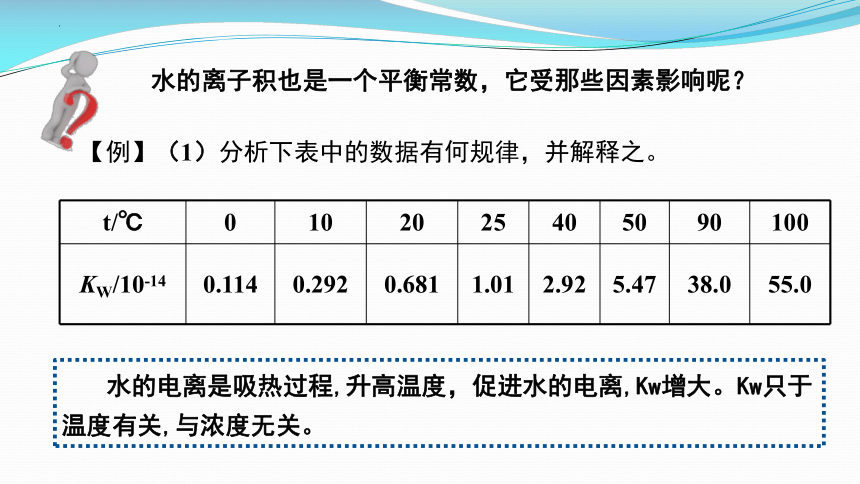
水的离子积也是一个平衡常数,它受那些因素影响呢?
【例】(1)分析下表中的数据有何规律,并解释之。
t/℃ 0 10 20 25 40 50 90 100
KW/10-14 0.114 0.292 0.681 1.01 2.92 5.47 38.0 55.0
水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
3. 在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由
电离产生的c(H+)、c(OH-)总是相等的。
4. Kw揭示了在任何水溶液中均存在H+和OH-,只要温
度不变,Kw不变。
水的离子积不仅适用于纯水,也适用于稀的电解质水溶液。
2.适用范围
4.影响水的电离平衡的因素
△H>0
⑴温度:
水的电离是吸热过程,升高温度,促进水电离。故升高温度,KW增大。
改变条件 平衡移动方向 c(H+) c(OH-) H+与OH- 浓度大小 Kw
升高温度
增大
增大
增大
(促进电离)
↑
=
⑵加入酸溶液或碱溶液:
改变条件 平衡移动方向 c(H+) c(OH-) H+与OH- 浓度大小 Kw
加HCl
加NaOH
增大
减小
不变
(抑制电离)
↑
cH+>cOH-
减小
增大
不变
(抑制电离)
↑
cH+ <cOH-
加入酸或碱,抑制水电离,Kw不变。
⑶加入活泼金属(Na、K):
改变条件 平衡移动方向 c(H+) c(OH-) H+与OH- 浓度大小 Kw
加Na
减小
增大
不变
(促进电离)
↑
cH+ <cOH-
水的电离方程式为:H2O H+ + OH-, H >0其平衡移动的分析,符合勒夏特列原理。
条件 移动方向 c(H+) c(OH-) 电离程度 Kw
升温
通入HCl(g)
通入氨气
加 Na2O
加FeCl3(s)
加入NaHSO4(s)
右移 增大 增大 增大 增大
左移 增大 减小 减小 不变
左移 减小 增大 减小 不变
左移 减小 增大 减小 不变
右移 增大 减小 增大 不变
左移 增大 减小 减小 不变
总结: 水的电离平衡的影响因素:
① 酸、碱:抑制水的电离,Kw不变。平衡逆向移动 ,水的电离程度变小。
② 温度:T↑,促进水的电离, Kw↑,平衡正向移动 ,水的电离程度变大。
③ 外加能消耗H+或OH-的物质:平衡正向移动 ,水的电离程度变大。
1.判断正误(正确的打“√”,错误的打“×”)
(1)升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。( )
(2)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。( )
(3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。 ( )
(4)向水中加入酸抑制水的电离,向水中加入碱促进水的电离。( )
×
×
×
√
2.在氨水中存在的粒子有 ;
在氯水中存在的粒子有 。
NH3、NH3 H2O、H2O、OH-、NH4+、H+
Cl2、H2O、H+、OH-、ClO-、HClO、Cl-
3.现有下列物质
①100 ℃纯水; ②25 ℃ 0.1 mol·L-1 盐酸;
③25 ℃ 0.1 mol·L-1 KOH溶液;④25 ℃ 0.1 mol·L-1 Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,
能促进水电离的是__________(填序号,下同),
能抑制水的电离的是__________,
水电离的c(OH-)等于溶液中c(OH-)的是__________,
水电离的c(H+)等于溶液中c(H+)的是__________。
(2)从②和③溶液中水的电离度相等,进而可推出的结论是同一温度下,__________时,水的电离度相等。
①
②③④
①②
①③④
酸溶液中的c(H+)等于碱溶液中的c(OH-)
4.如图中三条曲线表示不同温度下水的离子积常数,下列说法不正确的是 ( )
A.图中温度:T3>T2>T1
B.图中pH关系:pH(B)=pH(D)=pH(E)
C.图中五点Kw间的关系:E>D>A=B=C
D.C点的溶液可能显酸性
D
【解析】选。升高温度促进水的电离,根据图象知,离子积常数KW3>KW2>KW1,所以温度T3>T2>T1,A正确;根据图象知,B、D、E三点溶液的c(H+)相等,则pH相等,B正确;温度越高,离子积常数越大,KW间的关系:E>D>A=B=C,C正确;C点时,Kw=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,D错误。
1、酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
2、一定温度下,加水稀释盐酸,溶液中的c(H+)、c(OH-)都减小,对吗
不对;稀释盐酸,溶液中的c(H+)减小,但因为温度不变,KW=c(H+)·c(OH-)不变,所以c(OH-)增大。
思考与讨论
3、试分析酸性溶液中c(H+)、c(OH-)的来源,在酸或碱溶液中水电离出的c(H+)与c(OH-)还相等吗?及KW的计算方法。
c(H+)来源于酸电离和水电离,且c(H+)酸 c(H+)水 ,c(H+)水可以忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸·c(OH-)水。
思考与讨论
4.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?
因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。
5.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?
不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
思考与讨论
NO.2
酸碱溶液中
水电离的计算
水电离出的c(H+)或者c(OH-)的计算
【解析】
0.01 mol·L-1的盐酸中c酸(H+)=0.01 mol·L-1(HCl电离产生)。
根据25 ℃时水的离子积Kw=1.0×10-14,可得c酸(H+)·c水(OH-)=1.0×10-14,解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1[水电离出的c(H+)、c(OH-)在任何时候都是相等的]。
(1) 在25℃ 0.01mol/L盐酸溶液中:c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
提示:由于c(H+)溶液=0.01 mol·L-1,溶液中c(OH-)=Kw÷c(H+)溶液=(1.0×10-14÷0.01) mol·L-1=1.0×10-12 mol·L-1。由于溶液中的OH-只来源于水的电离,所以水电离出的c(H+)=1.0×10-12 mol·L-1。
(2) 在25℃ 0.01mol/L NaOH溶液中:c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
【解析】
0.01 mol·L-1NaOH溶液中c碱(OH-)=0.01 mol·L-1 (NaOH电离产生)。根据25 ℃时水的离子积Kw=1.0×
10-14,可得c碱(OH-)·c水(H+)=1.0×10-14,解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1。
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
1、在25℃, 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
(2)室温下, 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L=10-2
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
课堂练习
3、下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25”“<”或“=”)1×10-14,做出此判断的理由是_____。
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为_____。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_____mol·L-1。
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
(1)> 水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
(2)2.4×10-7mol·L-1 5.76×10-9
4、某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为_______________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4mol·L-1,则溶液中c(OH-)为___________________,此时温度___________(填“高于”“低于”或“等于”)25 ℃。
2×10-7 mol·L-1
8×10-11 mol·L-1
高于
思考:室温下,0.1 mol/L 的醋酸溶液,c(H+) = 0.001 mol/L
水电离的 c(H+)=___________
1.0×10-11 mol/L
水
醋酸溶液
冰醋酸
酸性溶液
c(H+)水 = c(OH-)水
H+
OH-
酸电离的+水电离的
水电离的
溶液中c(H+)增大,抑制水的电离,使水电离出来的c(OH-)减小
c(H+) 〉 c(OH-)
≈ 0.001mol/L
Kw = c(H+)×c(OH-)
= 1×10-14
水电离的 c(OH-)
1.0×10-11 mol/L
酸溶液中:c(H+)≈c酸(H+)、 c(OH-)=c水(OH-)
碱溶液中:c(H+)=c水(H+)、 c(OH-)=c碱(OH-)
提醒:
(1) 因为H2O H++OH-,所以由水电离出的c(H+)=c(OH-)。
(2)酸溶液中的OH-和碱溶液中的H+都是水电离出的。
(3)KW表达式中的c(H+)和c(OH-)是溶液中H+和OH-的总浓度。
(4)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度),即c(H+)水=c(OH-)水=Kw/c(H+)酸。
(5)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度),即c(H+)水=Kw/c(OH-)碱。
本课归纳总结
水的电离
H2O H++OH-
Kw=c(H+)·c(OH-)
外界条件对水电离平衡及Kw的影响
影响水的电离平衡的因素小结
H2O H+ +OH-
△H>0
影响因素 水的电离平衡移动 影响结果 方向 原因 KW c(H+)变化 c(OH-)变化 c(H+)与c(OH-)的关系
温度 升温 右移 水的电离过程吸热 增大 增大 增大 c(H+)=c(OH-)
降温 左移 减小 减小 减小 c(H+)=c(OH-)
加酸 左移 增大了c(H+) 不变 增大 减小 c(H+)>c(OH-)
加碱 左移 增大了c(OH-) 不变 减小 增大 c(H+)外加活泼金属 右移 金属消耗水电离出的H+ 不变 减小 增大 c(H+)
第三章·
水溶液中的离子反应与平衡
第二节
水的电离 溶液的酸碱性
第1课时 水的电离
H2O是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。
水的导电性实验
编号 I II III
现象
原理
结论
灯泡不亮
水是一种极弱的电解质,能发生微弱的电离
正常电路
纯水不导电
或导电能力弱
灯泡亮
灵敏电流表指针偏转
纯水能导电但导电能力弱
目录
水的电离与水的离子积常数
01
酸碱溶液中水电离的计算
02
习
学
目
标
1.认识水的电离
2.了解水的离子积常数
3.了解水的电离平衡及影响因素
NO.1
水的电离
与
水的离子积常数
H2O+ H2O H3O+ +OH-
H2O H+ +OH-
H+为裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
精确的导电性实验表明:
1. 电离方程式
2. 水的电离特点
(1)微弱
实验数据:25℃ 时 1 L 水约等于 55.6 mol
约有 10-7 mol H2O 分子发生电离
25°C 1L水只有10-7molH2O发生电离
电离程度 ≈ ≈ 2×10-9
10-7
55.6
(2)△H >0
(3)c(H+)水=c(OH-)水
K电离·c(H2O) = c ( H+)·c( OH-)
室温下1L(55.6mol)H2O中,只有1×10-7 molH2O电离,电离的水可以忽略不计,因此C(H2O)可视为常数
KW
表达式:KW=c(H+)·c(OH-)
1.定义:一定温度时,水(稀溶液)中c(H+)与c(OH-)的乘积是一个常数Kw,即水的离子积常数,简称水的离子积。
常温时,c(H+)=c(OH-)=1×10-7 mol/L
常温时,KW=c(H+)·c(OH-)=1×10-14
K电离=
c(H+)×c(OH-)
c(H2O)
H2O H+ + OH-
【思考】如何衡量水的电离的限度?
注:c(H2O)=
1 L
1000 g
18 g·mol-1
水的离子积也是一个平衡常数,它受那些因素影响呢?
【例】(1)分析下表中的数据有何规律,并解释之。
t/℃ 0 10 20 25 40 50 90 100
KW/10-14 0.114 0.292 0.681 1.01 2.92 5.47 38.0 55.0
水的电离是吸热过程,升高温度,促进水的电离,Kw增大。Kw只于温度有关,与浓度无关。
3. 在不同溶液中,c(H+)、c(OH-)可能不同,但任何溶液中由
电离产生的c(H+)、c(OH-)总是相等的。
4. Kw揭示了在任何水溶液中均存在H+和OH-,只要温
度不变,Kw不变。
水的离子积不仅适用于纯水,也适用于稀的电解质水溶液。
2.适用范围
4.影响水的电离平衡的因素
△H>0
⑴温度:
水的电离是吸热过程,升高温度,促进水电离。故升高温度,KW增大。
改变条件 平衡移动方向 c(H+) c(OH-) H+与OH- 浓度大小 Kw
升高温度
增大
增大
增大
(促进电离)
↑
=
⑵加入酸溶液或碱溶液:
改变条件 平衡移动方向 c(H+) c(OH-) H+与OH- 浓度大小 Kw
加HCl
加NaOH
增大
减小
不变
(抑制电离)
↑
cH+>cOH-
减小
增大
不变
(抑制电离)
↑
cH+ <cOH-
加入酸或碱,抑制水电离,Kw不变。
⑶加入活泼金属(Na、K):
改变条件 平衡移动方向 c(H+) c(OH-) H+与OH- 浓度大小 Kw
加Na
减小
增大
不变
(促进电离)
↑
cH+ <cOH-
水的电离方程式为:H2O H+ + OH-, H >0其平衡移动的分析,符合勒夏特列原理。
条件 移动方向 c(H+) c(OH-) 电离程度 Kw
升温
通入HCl(g)
通入氨气
加 Na2O
加FeCl3(s)
加入NaHSO4(s)
右移 增大 增大 增大 增大
左移 增大 减小 减小 不变
左移 减小 增大 减小 不变
左移 减小 增大 减小 不变
右移 增大 减小 增大 不变
左移 增大 减小 减小 不变
总结: 水的电离平衡的影响因素:
① 酸、碱:抑制水的电离,Kw不变。平衡逆向移动 ,水的电离程度变小。
② 温度:T↑,促进水的电离, Kw↑,平衡正向移动 ,水的电离程度变大。
③ 外加能消耗H+或OH-的物质:平衡正向移动 ,水的电离程度变大。
1.判断正误(正确的打“√”,错误的打“×”)
(1)升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。( )
(2)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。( )
(3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。 ( )
(4)向水中加入酸抑制水的电离,向水中加入碱促进水的电离。( )
×
×
×
√
2.在氨水中存在的粒子有 ;
在氯水中存在的粒子有 。
NH3、NH3 H2O、H2O、OH-、NH4+、H+
Cl2、H2O、H+、OH-、ClO-、HClO、Cl-
3.现有下列物质
①100 ℃纯水; ②25 ℃ 0.1 mol·L-1 盐酸;
③25 ℃ 0.1 mol·L-1 KOH溶液;④25 ℃ 0.1 mol·L-1 Ba(OH)2溶液。
(1)这些物质与25 ℃纯水相比,
能促进水电离的是__________(填序号,下同),
能抑制水的电离的是__________,
水电离的c(OH-)等于溶液中c(OH-)的是__________,
水电离的c(H+)等于溶液中c(H+)的是__________。
(2)从②和③溶液中水的电离度相等,进而可推出的结论是同一温度下,__________时,水的电离度相等。
①
②③④
①②
①③④
酸溶液中的c(H+)等于碱溶液中的c(OH-)
4.如图中三条曲线表示不同温度下水的离子积常数,下列说法不正确的是 ( )
A.图中温度:T3>T2>T1
B.图中pH关系:pH(B)=pH(D)=pH(E)
C.图中五点Kw间的关系:E>D>A=B=C
D.C点的溶液可能显酸性
D
【解析】选。升高温度促进水的电离,根据图象知,离子积常数KW3>KW2>KW1,所以温度T3>T2>T1,A正确;根据图象知,B、D、E三点溶液的c(H+)相等,则pH相等,B正确;温度越高,离子积常数越大,KW间的关系:E>D>A=B=C,C正确;C点时,Kw=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,D错误。
1、酸性溶液中是否存在OH- 碱性溶液中是否存在H+ 试解释原因。
酸性溶液中存在OH-,碱性溶液中存在H+。因这些溶液中都存在弱电解质水的电离。
2、一定温度下,加水稀释盐酸,溶液中的c(H+)、c(OH-)都减小,对吗
不对;稀释盐酸,溶液中的c(H+)减小,但因为温度不变,KW=c(H+)·c(OH-)不变,所以c(OH-)增大。
思考与讨论
3、试分析酸性溶液中c(H+)、c(OH-)的来源,在酸或碱溶液中水电离出的c(H+)与c(OH-)还相等吗?及KW的计算方法。
c(H+)来源于酸电离和水电离,且c(H+)酸 c(H+)水 ,c(H+)水可以忽略;c(OH-)来源于水的电离,且电离程度很小。由水电离出的c(H+)与c(OH-)仍然相等;KW=[c(H+)酸+c(H+)水]·c(OH-)水≈c(H+)酸·c(OH-)水。
思考与讨论
4.某温度时,水溶液中Kw=4×10-14,那么该温度比室温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?
因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。
5.水的离子积常数Kw=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?
不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
思考与讨论
NO.2
酸碱溶液中
水电离的计算
水电离出的c(H+)或者c(OH-)的计算
【解析】
0.01 mol·L-1的盐酸中c酸(H+)=0.01 mol·L-1(HCl电离产生)。
根据25 ℃时水的离子积Kw=1.0×10-14,可得c酸(H+)·c水(OH-)=1.0×10-14,解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1[水电离出的c(H+)、c(OH-)在任何时候都是相等的]。
(1) 在25℃ 0.01mol/L盐酸溶液中:c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
提示:由于c(H+)溶液=0.01 mol·L-1,溶液中c(OH-)=Kw÷c(H+)溶液=(1.0×10-14÷0.01) mol·L-1=1.0×10-12 mol·L-1。由于溶液中的OH-只来源于水的电离,所以水电离出的c(H+)=1.0×10-12 mol·L-1。
(2) 在25℃ 0.01mol/L NaOH溶液中:c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
【解析】
0.01 mol·L-1NaOH溶液中c碱(OH-)=0.01 mol·L-1 (NaOH电离产生)。根据25 ℃时水的离子积Kw=1.0×
10-14,可得c碱(OH-)·c水(H+)=1.0×10-14,解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1。
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
1、在25℃, 0.01mol/L盐酸溶液中:
c(H+) = , c(OH-) = ;
c(H+)水= , c(OH-)水= 。
(2)室温下, 0.01mol/L NaOH溶液中:
c(H+)= , c(OH-)= ;
c(H+)水= , c(OH-)水= 。
0.01mol/L=10-2
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/L
0.01mol/L
10-12mol/L
10-12mol/L
课堂练习
3、下表是不同温度下水的离子积数据:
试回答下列问题:
(1)若25
(2)在t1℃时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为_____。该温度下,测得某H2SO4溶液中c( )=5×10-6mol·L-1,该溶液中c(OH-)=_____mol·L-1。
温度/℃ 25 t1 t2
水的离子积常数 1×10-14 Kw 1×10-12
(1)> 水的电离是吸热过程,升高温度,平衡向电离方向移动,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),Kw增大
(2)2.4×10-7mol·L-1 5.76×10-9
4、某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为_______________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4mol·L-1,则溶液中c(OH-)为___________________,此时温度___________(填“高于”“低于”或“等于”)25 ℃。
2×10-7 mol·L-1
8×10-11 mol·L-1
高于
思考:室温下,0.1 mol/L 的醋酸溶液,c(H+) = 0.001 mol/L
水电离的 c(H+)=___________
1.0×10-11 mol/L
水
醋酸溶液
冰醋酸
酸性溶液
c(H+)水 = c(OH-)水
H+
OH-
酸电离的+水电离的
水电离的
溶液中c(H+)增大,抑制水的电离,使水电离出来的c(OH-)减小
c(H+) 〉 c(OH-)
≈ 0.001mol/L
Kw = c(H+)×c(OH-)
= 1×10-14
水电离的 c(OH-)
1.0×10-11 mol/L
酸溶液中:c(H+)≈c酸(H+)、 c(OH-)=c水(OH-)
碱溶液中:c(H+)=c水(H+)、 c(OH-)=c碱(OH-)
提醒:
(1) 因为H2O H++OH-,所以由水电离出的c(H+)=c(OH-)。
(2)酸溶液中的OH-和碱溶液中的H+都是水电离出的。
(3)KW表达式中的c(H+)和c(OH-)是溶液中H+和OH-的总浓度。
(4)酸溶液中Kw=c(H+)酸·c(OH-)水(忽略水电离出的H+的浓度),即c(H+)水=c(OH-)水=Kw/c(H+)酸。
(5)碱溶液中Kw=c(H+)水·c(OH-)碱(忽略水电离出的OH-的浓度),即c(H+)水=Kw/c(OH-)碱。
本课归纳总结
水的电离
H2O H++OH-
Kw=c(H+)·c(OH-)
外界条件对水电离平衡及Kw的影响
影响水的电离平衡的因素小结
H2O H+ +OH-
△H>0
影响因素 水的电离平衡移动 影响结果 方向 原因 KW c(H+)变化 c(OH-)变化 c(H+)与c(OH-)的关系
温度 升温 右移 水的电离过程吸热 增大 增大 增大 c(H+)=c(OH-)
降温 左移 减小 减小 减小 c(H+)=c(OH-)
加酸 左移 增大了c(H+) 不变 增大 减小 c(H+)>c(OH-)
加碱 左移 增大了c(OH-) 不变 减小 增大 c(H+)
