化学人教版(2019)选择性必修1 3.2.2溶液的酸碱性(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.2.2溶液的酸碱性(共29张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-21 21:35:59 | ||
图片预览







文档简介
(共29张PPT)
第三章·
水溶液中的离子反应与平衡
第二节 水的电离 溶液的酸碱性
第2课时 溶液的酸碱性及pH
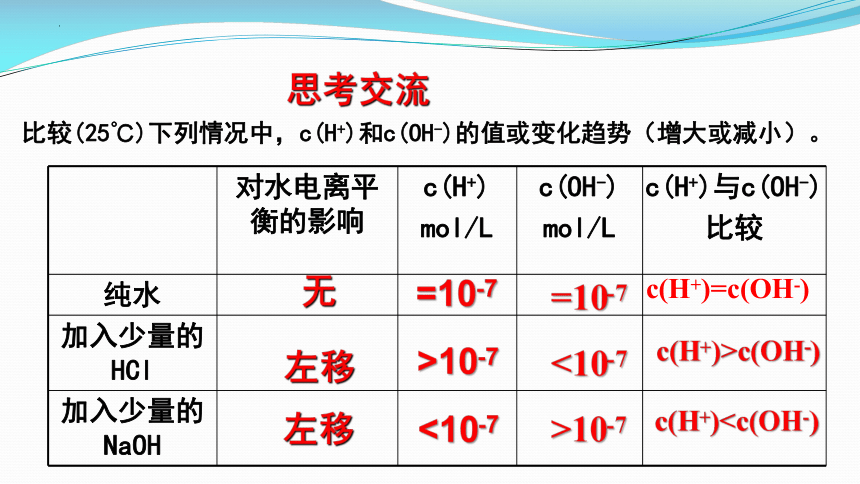
比较(25℃)下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减小)。
对水电离平衡的影响 c(H+) mol/L c(OH-) mol/L c(H+)与c(OH-)
比较
纯水
加入少量的 HCl
加入少量的NaOH
无
=10-7
=10-7
c(H+)=c(OH-)
>10-7
<10-7
c(H+)>c(OH-)
<10-7
>10-7
c(H+)左移
左移
思考交流
目录
溶液的酸碱性分析
01
单一溶液的PH计算
02
习
学
目
标
1.认识溶液的酸碱性及pH。
2.掌握检验溶液pH的方法
3,掌握单一溶液的pH计算。
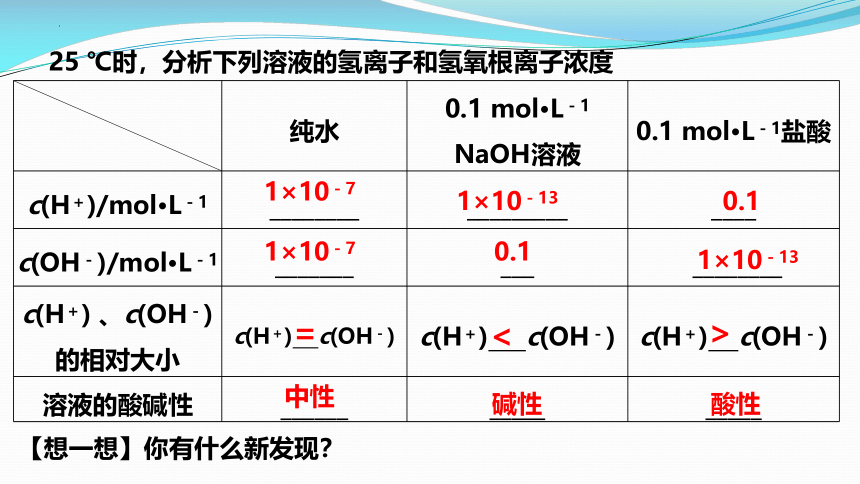
25 ℃时,分析下列溶液的氢离子和氢氧根离子浓度
纯水 0.1 mol·L-1 NaOH溶液 0.1 mol·L-1盐酸
c(H+)/mol·L-1 ________ _________ ____
c(OH-)/mol·L-1 _______ ___ ________
c(H+) 、c(OH-) 的相对大小 c(H+) c(OH-) c(H+) c(OH-) c(H+) c(OH-)
溶液的酸碱性 ______ _____ _____
1×10-7
中性
1×10-7
=
1×10-13
0.1
0.1
1×10-13
<
>
碱性
酸性
【想一想】你有什么新发现?
NO.1
溶液的酸碱性分析
溶液的酸碱性由c(H+)和c(OH-)相对大小决定
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性
酸性
碱性
常温下
c(H+)=1×10-7mol/L
c(OH-)=1×10-7mol/L
c(H+)>1×10-7mol/L
c(OH-)<1×10-7mol/L
c(H+)<1×10-7mol/L
c(OH-)>1×10-7mol/L
不能用c(H+)等于多少来判断溶液酸、碱性,只能通过c(H+) 、c(OH-)两者相对大小比较
讨论:100℃时KW=10-12
①在100 ℃ 时,纯水中c(H+)为多少?
②c(H+) >1×10-7mol/L是否说明100 ℃ 时纯水溶液呈酸性?
③100℃ 时,c(H+)=1×10-7mol/L溶液呈酸性还是碱性?
c(H+)=10-6mol/L
不是,此时的纯水仍然呈中性!
碱性!
c(H+)=1×10-7mol/L、c(OH-)=1×10-5mol/L,c(OH-)>c(H+)
“pH”是由丹麦化学家彼得·索仑森1909年提出的。索仑森当时在一家啤酒厂工作,经常要化验啤酒中所含H+浓度。每次化验结果都要记录许多个零,这使他感到很麻烦。经过长期潜心研究,他发现用H+浓度的负对数来表示酸碱性非常方便,并把它称为溶液的pH(p代表德语Potenz,意思是浓度,H代表H+)。就这样“pH”成为表述溶液酸碱度的一种重要数据。
化学史话
溶液的PH
②意义:
pH的大小能反映出溶液中c(H+)的高低,即表示稀溶液酸碱性的强弱。
【注意】当溶液中c(H+)或c(OH-)大于1mol/L时,使用pH值不方便,所以用物质的量浓度表示更好。
1、pH值
①计算公式:
pH=-lgc(H+)
pH 溶液的酸碱性
pH<7
pH=7
pH>7
溶液呈酸性,pH越小,溶液的酸性越强
pH与溶液的酸碱性(25℃时)
溶液呈碱性,pH越大,溶液的碱性越强
溶液呈中性
溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越强,碱性越弱,pH的适用范围是0~14。
③pH的适用范围:
c(H+)和c(OH-)都较小的稀溶液(小于1 mol/L)
c(H+)
1.pH=7的溶液一定呈中性吗
思考交流
不一定。25 ℃时,pH=7的溶液呈中性,温度高于25 ℃时,由于水的电离程度增大,KW>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
2、有甲、乙两种溶液,甲溶液的pH是乙溶液的两倍,则甲溶液中[H+]与乙溶液中[H+]的关系是
A. 2:1 B. 100:1
C. 1:100 D. 无法确定
3、已知浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧HF
其溶液pH由小到大的顺序是:
②①⑧③⑦⑥⑤④
D
1.判断标准是:c(H+)与c(OH-)的相对大小
根本依据 常用依据一(室温) 常用依据二(室温) 结论
2.溶液酸碱性判断“三判据”
c(H+) >c(OH-)
c(H+) >10-7 mol/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 mol/L
c(H+) < 1×10-7 mol/L
pH<7
溶液呈酸性
溶液呈碱性
溶液呈中性
pH=7
pH>7
小结
思考与交流:
常用的pH值的测定方法有哪些?
如何用pH试纸测定溶液的pH值?
酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
2、pH值测定方法
①定性测定:
3.1—4.4
常见指示剂的变色范围
5.0—8.0
8.0—10.0
②定量测定:pH试纸法、pH计法等
广泛pH试纸
精密pH试纸
广泛pH试纸
精密pH试纸
pH试纸法(定量粗略测量)
注 意:
使用pH试纸不能用蒸馏水润湿。润湿后相当于稀释了溶液。
若是酸性溶液,则润湿后测得pH偏大;
若是碱性溶液,则润湿后测得pH偏小;
若是中性溶液,则无影响;
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
pH计法
pH应用
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与
溶液的酸碱性有密切关系。因此,测试和调控溶液的pH,对工农业生产、
科学研究,以及日常生活和医疗保健等都具有重要意义。
身体健康
人体各种体液都有一定的pH。血液的pH是诊断疾病的一个重要参数,当体内的酸碱平衡失调时,利用药物控制pH则是辅助治疗的重要手段之一。
pH应用
日常生活
在日常生活中,人们洗发时使用的护发素具有调节头发的pH使之达到适宜酸碱度的功能。
NO.2
单一溶液的PH计算
溶液pH的计算(25℃)
(1)单一溶液pH的计算
步骤:
①强酸溶液(HnA)
设HnA的浓度为c mol/L,则c(H+)=nc mol/L,
pH=﹣lgc(H+)=﹣lg(nc)
②强碱溶液(B(OH)n)
设B(OH)n的浓度为c mol/L,则c(OH-)=nc mol/L,
pH=﹣lgc(H+)=14+lg(nc)
例:试计算常温下的
①0.005 mol/L H2SO4溶液;
②0.005 mol/L Ba(OH)2 溶液的pH值
解、①∵ c (H+) =0.005×2=0.01
∴ pH = - lg 0.01 = 2
解∵ c(OH-) =0.005×2=0.01
∴ pH = - lg 10-12 = 12
或∵ c (OH-) =0.005×2=0.01
∴ pOH = - lg 0.01 = 2
pH= 14 - 2 = 12
1.在常温下,(1)c(H+)=1.0×10-3 mol·L-1的某溶液中,
c(OH-)= 。pH为 。
(2)pH=4的盐酸中,c(H+)= , c(H+)水= 。
2.常温下,计算下列溶液的pH。
(1)1.0×10-3 mol·L-1的盐酸的pH为 。
(2)5.0×10-4 mol·L-1的H2SO4溶液的pH为 。
(3)将8 g NaOH固体溶于水得到2 L溶液,其pH为 。
(4)a mol·L-1的Ba(OH)2溶液的pH为 。
1.0×10-11 mol·L-1 3
2)1.0×10-4 mol·L-1 1.0×10-10 mol·L-1
3
3
13
15-lg5+lga
3.某温度下,纯水中c(H+)=1.0 ×10-6 mol/L。该温度时,0.01mol/L的HCl溶液中,pH=________;
0.01mol/L的NaOH溶液中,pH=________。
2
10
【提示】计算溶液的pH时,一定要注意溶液的温度。
③弱酸HA溶液(浓度为c mol·L-1,电离常数为Ka)
HA H+ + A-
Ka=
c(H+)·c(A-)
c(HA)
c(H+)=
mol·L-1
pH=-lg c(H+)= _________
- lg(Ka·c)
1
2
④弱酸BOH溶液(浓度为c mol·L-1,电离常数为Kb)
BOH B+ + OH-
Kb=
c(B+)·c(OH-)
c(BOH)
c(OH-)=
mol·L-1
c(H+)=
Kw
c(OH-)
=_________mol·L-1
(Kb·c)
Kw
pH=-lg c(H+)=
14+ lg(Kb·c)
1
2
本课归纳总结
溶液的酸碱性
判断依据 c(H+) 和c(OH-)的相对大小
表示方法
pH=-lg c(H+)
pH的测定
PH的计算
第三章·
水溶液中的离子反应与平衡
第二节 水的电离 溶液的酸碱性
第2课时 溶液的酸碱性及pH
比较(25℃)下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减小)。
对水电离平衡的影响 c(H+) mol/L c(OH-) mol/L c(H+)与c(OH-)
比较
纯水
加入少量的 HCl
加入少量的NaOH
无
=10-7
=10-7
c(H+)=c(OH-)
>10-7
<10-7
c(H+)>c(OH-)
<10-7
>10-7
c(H+)
左移
思考交流
目录
溶液的酸碱性分析
01
单一溶液的PH计算
02
习
学
目
标
1.认识溶液的酸碱性及pH。
2.掌握检验溶液pH的方法
3,掌握单一溶液的pH计算。
25 ℃时,分析下列溶液的氢离子和氢氧根离子浓度
纯水 0.1 mol·L-1 NaOH溶液 0.1 mol·L-1盐酸
c(H+)/mol·L-1 ________ _________ ____
c(OH-)/mol·L-1 _______ ___ ________
c(H+) 、c(OH-) 的相对大小 c(H+) c(OH-) c(H+) c(OH-) c(H+) c(OH-)
溶液的酸碱性 ______ _____ _____
1×10-7
中性
1×10-7
=
1×10-13
0.1
0.1
1×10-13
<
>
碱性
酸性
【想一想】你有什么新发现?
NO.1
溶液的酸碱性分析
溶液的酸碱性由c(H+)和c(OH-)相对大小决定
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性
酸性
碱性
常温下
c(H+)=1×10-7mol/L
c(OH-)=1×10-7mol/L
c(H+)>1×10-7mol/L
c(OH-)<1×10-7mol/L
c(H+)<1×10-7mol/L
c(OH-)>1×10-7mol/L
不能用c(H+)等于多少来判断溶液酸、碱性,只能通过c(H+) 、c(OH-)两者相对大小比较
讨论:100℃时KW=10-12
①在100 ℃ 时,纯水中c(H+)为多少?
②c(H+) >1×10-7mol/L是否说明100 ℃ 时纯水溶液呈酸性?
③100℃ 时,c(H+)=1×10-7mol/L溶液呈酸性还是碱性?
c(H+)=10-6mol/L
不是,此时的纯水仍然呈中性!
碱性!
c(H+)=1×10-7mol/L、c(OH-)=1×10-5mol/L,c(OH-)>c(H+)
“pH”是由丹麦化学家彼得·索仑森1909年提出的。索仑森当时在一家啤酒厂工作,经常要化验啤酒中所含H+浓度。每次化验结果都要记录许多个零,这使他感到很麻烦。经过长期潜心研究,他发现用H+浓度的负对数来表示酸碱性非常方便,并把它称为溶液的pH(p代表德语Potenz,意思是浓度,H代表H+)。就这样“pH”成为表述溶液酸碱度的一种重要数据。
化学史话
溶液的PH
②意义:
pH的大小能反映出溶液中c(H+)的高低,即表示稀溶液酸碱性的强弱。
【注意】当溶液中c(H+)或c(OH-)大于1mol/L时,使用pH值不方便,所以用物质的量浓度表示更好。
1、pH值
①计算公式:
pH=-lgc(H+)
pH 溶液的酸碱性
pH<7
pH=7
pH>7
溶液呈酸性,pH越小,溶液的酸性越强
pH与溶液的酸碱性(25℃时)
溶液呈碱性,pH越大,溶液的碱性越强
溶液呈中性
溶液的酸碱性与pH的关系(25℃)
pH越小,溶液的酸性越强,碱性越弱,pH的适用范围是0~14。
③pH的适用范围:
c(H+)和c(OH-)都较小的稀溶液(小于1 mol/L)
c(H+)
1.pH=7的溶液一定呈中性吗
思考交流
不一定。25 ℃时,pH=7的溶液呈中性,温度高于25 ℃时,由于水的电离程度增大,KW>1.0×10-14,此时pH=7呈碱性。判断溶液酸碱性的唯一标准是溶液中c(H+)和c(OH-)的相对大小,不应看pH的大小,因此只有满足c(H+)=c(OH-)的溶液才一定呈中性。
2、有甲、乙两种溶液,甲溶液的pH是乙溶液的两倍,则甲溶液中[H+]与乙溶液中[H+]的关系是
A. 2:1 B. 100:1
C. 1:100 D. 无法确定
3、已知浓度均为0.1mol/L的8种溶液:①HNO3 ②H2SO4 ③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧HF
其溶液pH由小到大的顺序是:
②①⑧③⑦⑥⑤④
D
1.判断标准是:c(H+)与c(OH-)的相对大小
根本依据 常用依据一(室温) 常用依据二(室温) 结论
2.溶液酸碱性判断“三判据”
c(H+) >c(OH-)
c(H+) >10-7 mol/L
c(H+) = c(OH-)
c(H+) < c(OH-)
c(H+)= 1×10-7 mol/L
c(H+) < 1×10-7 mol/L
pH<7
溶液呈酸性
溶液呈碱性
溶液呈中性
pH=7
pH>7
小结
思考与交流:
常用的pH值的测定方法有哪些?
如何用pH试纸测定溶液的pH值?
酸碱指示剂法(只能粗略测定溶液的pH范围,不能准确测定出pH的具体值)
pH 1 2 3.1 4.4 5 6 7 8 9 10 11 12 13 14 甲基橙 红色 橙色 黄色 石蕊 红色 紫色 蓝色 酚酞 无色 浅红色 红色
2、pH值测定方法
①定性测定:
3.1—4.4
常见指示剂的变色范围
5.0—8.0
8.0—10.0
②定量测定:pH试纸法、pH计法等
广泛pH试纸
精密pH试纸
广泛pH试纸
精密pH试纸
pH试纸法(定量粗略测量)
注 意:
使用pH试纸不能用蒸馏水润湿。润湿后相当于稀释了溶液。
若是酸性溶液,则润湿后测得pH偏大;
若是碱性溶液,则润湿后测得pH偏小;
若是中性溶液,则无影响;
pH计又叫酸度计,可用来精密测量溶液的pH,其量程为0~14。
pH计法
pH应用
工农业生产和科学实验中常常涉及溶液的酸碱性,人们的生活和健康也与
溶液的酸碱性有密切关系。因此,测试和调控溶液的pH,对工农业生产、
科学研究,以及日常生活和医疗保健等都具有重要意义。
身体健康
人体各种体液都有一定的pH。血液的pH是诊断疾病的一个重要参数,当体内的酸碱平衡失调时,利用药物控制pH则是辅助治疗的重要手段之一。
pH应用
日常生活
在日常生活中,人们洗发时使用的护发素具有调节头发的pH使之达到适宜酸碱度的功能。
NO.2
单一溶液的PH计算
溶液pH的计算(25℃)
(1)单一溶液pH的计算
步骤:
①强酸溶液(HnA)
设HnA的浓度为c mol/L,则c(H+)=nc mol/L,
pH=﹣lgc(H+)=﹣lg(nc)
②强碱溶液(B(OH)n)
设B(OH)n的浓度为c mol/L,则c(OH-)=nc mol/L,
pH=﹣lgc(H+)=14+lg(nc)
例:试计算常温下的
①0.005 mol/L H2SO4溶液;
②0.005 mol/L Ba(OH)2 溶液的pH值
解、①∵ c (H+) =0.005×2=0.01
∴ pH = - lg 0.01 = 2
解∵ c(OH-) =0.005×2=0.01
∴ pH = - lg 10-12 = 12
或∵ c (OH-) =0.005×2=0.01
∴ pOH = - lg 0.01 = 2
pH= 14 - 2 = 12
1.在常温下,(1)c(H+)=1.0×10-3 mol·L-1的某溶液中,
c(OH-)= 。pH为 。
(2)pH=4的盐酸中,c(H+)= , c(H+)水= 。
2.常温下,计算下列溶液的pH。
(1)1.0×10-3 mol·L-1的盐酸的pH为 。
(2)5.0×10-4 mol·L-1的H2SO4溶液的pH为 。
(3)将8 g NaOH固体溶于水得到2 L溶液,其pH为 。
(4)a mol·L-1的Ba(OH)2溶液的pH为 。
1.0×10-11 mol·L-1 3
2)1.0×10-4 mol·L-1 1.0×10-10 mol·L-1
3
3
13
15-lg5+lga
3.某温度下,纯水中c(H+)=1.0 ×10-6 mol/L。该温度时,0.01mol/L的HCl溶液中,pH=________;
0.01mol/L的NaOH溶液中,pH=________。
2
10
【提示】计算溶液的pH时,一定要注意溶液的温度。
③弱酸HA溶液(浓度为c mol·L-1,电离常数为Ka)
HA H+ + A-
Ka=
c(H+)·c(A-)
c(HA)
c(H+)=
mol·L-1
pH=-lg c(H+)= _________
- lg(Ka·c)
1
2
④弱酸BOH溶液(浓度为c mol·L-1,电离常数为Kb)
BOH B+ + OH-
Kb=
c(B+)·c(OH-)
c(BOH)
c(OH-)=
mol·L-1
c(H+)=
Kw
c(OH-)
=_________mol·L-1
(Kb·c)
Kw
pH=-lg c(H+)=
14+ lg(Kb·c)
1
2
本课归纳总结
溶液的酸碱性
判断依据 c(H+) 和c(OH-)的相对大小
表示方法
pH=-lg c(H+)
pH的测定
PH的计算
