1.3.2 氧化剂和还原剂-高一化学人教版必修第一册同步课件(共16张PPT)
文档属性
| 名称 | 1.3.2 氧化剂和还原剂-高一化学人教版必修第一册同步课件(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 16:47:26 | ||
图片预览






文档简介
(共16张PPT)
第 三 节 氧 化 还 原 反 应
第2课时 氧化剂和还原剂
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
1.通过具体实例识别氧化剂和还原剂。
2.理解氧化反应、还原反应、氧化剂、还原剂、氧化性、还原性的概念。
知识回顾
氧化还原反应 氧化反应 还原反应
有元素化合价升降的反应
有电子转移的反应
失去电子的反应
得到电子的反应
元素化合价降低的反应
元素化合价升高的反应
交流讨论
MnO2 + 4HCl (浓) = MnCl2+Cl2↑+2H2O
△
+4 -1 +2 0
化合价升高, 失电子,被氧化
化合价降低,得电子,被还原
氧化剂
还原剂
氧化产物
还原产物
MnO2
HCl
MnCl2
Cl2
知识梳理
二、氧化剂和还原剂
还原剂:在氧化还原反应中,所含的某种元素的化合价升高的反应物。
1.定义
氧化剂:在氧化还原反应中,所含的某种元素的化合价降低的反应物。
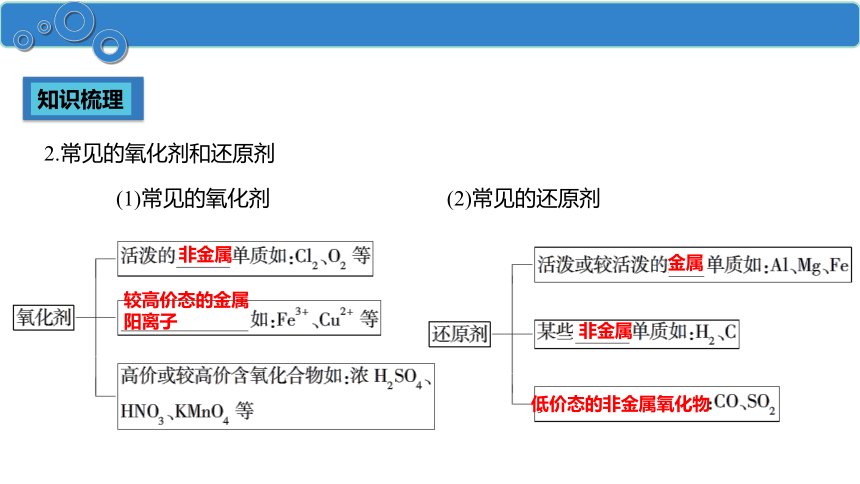
(1)常见的氧化剂
2.常见的氧化剂和还原剂
(2)常见的还原剂
知识梳理
非金属
较高价态的金属阳离子
金属
非金属
低价态的非金属氧化物
(2)与元素价态的关系
3.氧化性和还原性
(1)概念
氧化性:氧化剂所表现出的得电子的性质。
还原性:还原剂所表现出的失电子的性质。
元素处于最高价态时只有氧化性;
元素处于最低价态时只有还原性;
元素处于中间价态时既有氧化性,也有还原性。
知识梳理
1.根据反应方程式来比较:
氧化性:
氧化剂﹥氧化产物
还原性:
还原剂﹥还原产物
三、物质氧化性与还原性的比较
知识梳理
交流讨论
【典题例证】有A、B、C、D四种物质,已知它们能发生下列反应:
①A2++B=== B2++A ②A2++C===C2++A
③B2++C=== C2++B ④C2++D===D2++C
由此可推知,各物质的氧化性、还原性强弱顺序正确的是( )
A.氧化性:A2+>B2+>C2+>D2+
B.氧化性:D2+>C2+>B2+>A2+
C.还原性:A>B>C>D
D.还原性:D>C>B>A
AD
2.根据金属活动顺序:
(3)元素处于中间价态,则既有氧化性又有还原性
(2)元素处于低价态具有还原性,价态越低,还原性越强
(1)元素处于高价态具有氧化性,价态越高, 氧化性越强
3.根据元素的化合价来判断:
从左到右,单质的还原性逐渐减弱;对应的阳离子的氧化性逐渐增强。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
对生产、生活的影响
问题解决
四、生产、生活中的氧化还原反应
正面影响
负面影响
金属的冶炼
燃料的燃烧
电镀
绿色植物的光合作用
易燃物的自燃
食物的腐败
钢铁的锈蚀
归纳总结
失电子或偏离
化合价升高
被氧化
还原剂
得电子或偏向
化合价降低
被还原
本质
特征
变化
反应物
还原剂
氧化剂
氧化剂
例题讲解
1.在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是_________________,只有还原性的是_________________,既有氧化性又有还原性的是______________。
Fe2+、S
Fe3+、Mg2+、H+
S2-、I-
解析:粒子的氧化性和还原性可从元素的化合价中进行分析:含有的元素的化合价处于最高价,粒子只具有氧化性;含有的元素的化合价处于最低价,粒子只具有还原性,含有的元素的化合价处于元素的中间价态时,粒子既具有氧化性,又具有还原性。
C
例题讲解
解析:由金属活动性顺序可知Cu2+、Mg2+、Ag+、H+的氧化性由强到弱的顺序为:Ag+>Cu2+>H+>Mg2+,故混合液与锌粉反应时,首先置换出Ag。
2.在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
D
例题讲解
解析:根据反应①可知氧化性:X2+>Y2+;根据反应②可知氧化性:Y2+>W2+;根据反应③可知氧化性:W2+>Z2+。综上四种阳离子中氧化性最弱的是Z2+。
3.已知下列三个离子反应方程式如下:
①X2++Y===X+Y2+
②Y2++W===W2++Y
③W2++Z===Z2++W
则氧化性最弱的粒子是( )
A.X2+ B.Y2+ C.W2+ D.Z2+
本节内容结束
第 三 节 氧 化 还 原 反 应
第2课时 氧化剂和还原剂
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
1.通过具体实例识别氧化剂和还原剂。
2.理解氧化反应、还原反应、氧化剂、还原剂、氧化性、还原性的概念。
知识回顾
氧化还原反应 氧化反应 还原反应
有元素化合价升降的反应
有电子转移的反应
失去电子的反应
得到电子的反应
元素化合价降低的反应
元素化合价升高的反应
交流讨论
MnO2 + 4HCl (浓) = MnCl2+Cl2↑+2H2O
△
+4 -1 +2 0
化合价升高, 失电子,被氧化
化合价降低,得电子,被还原
氧化剂
还原剂
氧化产物
还原产物
MnO2
HCl
MnCl2
Cl2
知识梳理
二、氧化剂和还原剂
还原剂:在氧化还原反应中,所含的某种元素的化合价升高的反应物。
1.定义
氧化剂:在氧化还原反应中,所含的某种元素的化合价降低的反应物。
(1)常见的氧化剂
2.常见的氧化剂和还原剂
(2)常见的还原剂
知识梳理
非金属
较高价态的金属阳离子
金属
非金属
低价态的非金属氧化物
(2)与元素价态的关系
3.氧化性和还原性
(1)概念
氧化性:氧化剂所表现出的得电子的性质。
还原性:还原剂所表现出的失电子的性质。
元素处于最高价态时只有氧化性;
元素处于最低价态时只有还原性;
元素处于中间价态时既有氧化性,也有还原性。
知识梳理
1.根据反应方程式来比较:
氧化性:
氧化剂﹥氧化产物
还原性:
还原剂﹥还原产物
三、物质氧化性与还原性的比较
知识梳理
交流讨论
【典题例证】有A、B、C、D四种物质,已知它们能发生下列反应:
①A2++B=== B2++A ②A2++C===C2++A
③B2++C=== C2++B ④C2++D===D2++C
由此可推知,各物质的氧化性、还原性强弱顺序正确的是( )
A.氧化性:A2+>B2+>C2+>D2+
B.氧化性:D2+>C2+>B2+>A2+
C.还原性:A>B>C>D
D.还原性:D>C>B>A
AD
2.根据金属活动顺序:
(3)元素处于中间价态,则既有氧化性又有还原性
(2)元素处于低价态具有还原性,价态越低,还原性越强
(1)元素处于高价态具有氧化性,价态越高, 氧化性越强
3.根据元素的化合价来判断:
从左到右,单质的还原性逐渐减弱;对应的阳离子的氧化性逐渐增强。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
对生产、生活的影响
问题解决
四、生产、生活中的氧化还原反应
正面影响
负面影响
金属的冶炼
燃料的燃烧
电镀
绿色植物的光合作用
易燃物的自燃
食物的腐败
钢铁的锈蚀
归纳总结
失电子或偏离
化合价升高
被氧化
还原剂
得电子或偏向
化合价降低
被还原
本质
特征
变化
反应物
还原剂
氧化剂
氧化剂
例题讲解
1.在S2-、Fe2+、Fe3+、Mg2+、S、I-、H+中,只有氧化性的是_________________,只有还原性的是_________________,既有氧化性又有还原性的是______________。
Fe2+、S
Fe3+、Mg2+、H+
S2-、I-
解析:粒子的氧化性和还原性可从元素的化合价中进行分析:含有的元素的化合价处于最高价,粒子只具有氧化性;含有的元素的化合价处于最低价,粒子只具有还原性,含有的元素的化合价处于元素的中间价态时,粒子既具有氧化性,又具有还原性。
C
例题讲解
解析:由金属活动性顺序可知Cu2+、Mg2+、Ag+、H+的氧化性由强到弱的顺序为:Ag+>Cu2+>H+>Mg2+,故混合液与锌粉反应时,首先置换出Ag。
2.在含有Cu(NO3)2、Mg(NO3)2、AgNO3的溶液中加入适量锌粉,首先置换出的是( )
A.Mg B.Cu C.Ag D.H2
D
例题讲解
解析:根据反应①可知氧化性:X2+>Y2+;根据反应②可知氧化性:Y2+>W2+;根据反应③可知氧化性:W2+>Z2+。综上四种阳离子中氧化性最弱的是Z2+。
3.已知下列三个离子反应方程式如下:
①X2++Y===X+Y2+
②Y2++W===W2++Y
③W2++Z===Z2++W
则氧化性最弱的粒子是( )
A.X2+ B.Y2+ C.W2+ D.Z2+
本节内容结束
