1.3.1 氧化还原反应-高一化学人教版必修第一册同步课件(共23张PPT)
文档属性
| 名称 | 1.3.1 氧化还原反应-高一化学人教版必修第一册同步课件(共23张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
第 三 节 氧化还原反应
第1课时 氧化还原反应
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
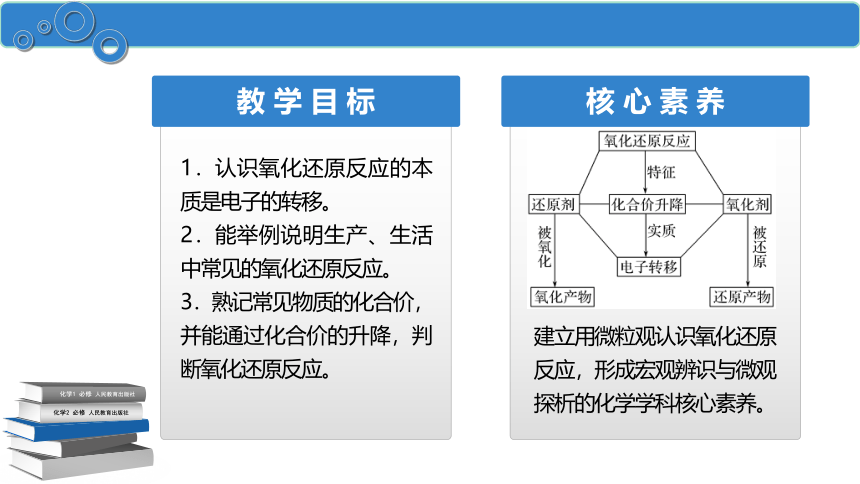
教 学 目 标
核 心 素 养
1.认识氧化还原反应的本质是电子的转移。
2.能举例说明生产、生活中常见的氧化还原反应。
3.熟记常见物质的化合价,并能通过化合价的升降,判断氧化还原反应。
建立用微粒观认识氧化还原反应,形成宏观辨识与微观探析的化学学科核心素养。
问题设计
苹果“锈”了
铁锁锈了
美国高中教材《化学概念与应用》对还原反应(reduction reaction)是这样描述的:早期科学家因金属矿石中与金属结合的氧被移除了,金属矿石因此被还原成金属单质,称还原反应(有减轻、减少之意)。
问题设计
铁矿石
铸铁
Fe2O3 Fe
交流讨论
氧化反应和还原反应是同时进行的,这样的反应称为氧化还原反应。
氧化
还原
从得氧失氧角度分析氧化还原反应
Fe2O3 + 3CO 2Fe + 3CO2
高温
Fe2O3 Fe,发生的是 反应
CO CO2,发生的是 反应
完成下列反应的方程式,并思考问题:
2.标出以上反应中各元素的化合价,你能发现什么规律?
1.判断哪些物质发生氧化反应、那些发生还原反应?
(1)一氧化碳还原氧化铜
(2)氢气还原氧化铜
(3)碳与水高温下的反应
交流讨论
一、氧化还原反应
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:
1. 氧化还原反应
凡是有元素化合价升降的化学反应
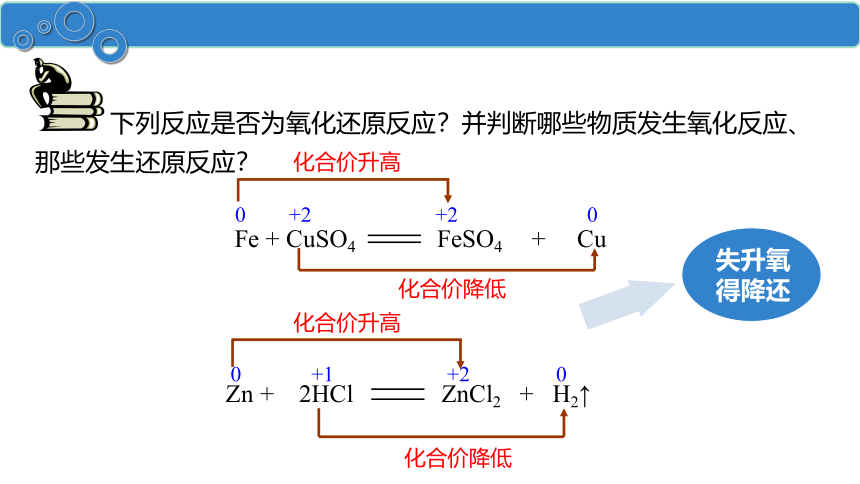
下列反应是否为氧化还原反应?并判断哪些物质发生氧化反应、那些发生还原反应?
0 +2 +2 0
化合价升高
化合价降低
0 +1 +2 0
化合价升高
化合价降低
Fe + CuSO4 FeSO4 + Cu
Zn + 2HCl ZnCl2 + H2↑
失升氧
得降还
√
√
√
×
×
×
×
判断下列反应是否是氧化还原反应:
1. 2H2 + O2 2H2O
2. CaO + H2O Ca(OH)2
3. 2KMnO4 K2MnO4 + MnO2 + O2↑
4. CaCO3 CO2↑ + CaO
5. Fe + H2SO4 FeSO4 + H2↑
6. Cu + 2AgNO3 Cu(NO3)2 + 2Ag
7. Ba(OH)2 + H2SO4 BaSO4↓+ 2H2O
8. CaCl2 + Na2CO3 CaCO3↓ + 2NaCl
点燃
△
△
√
交流讨论
氧化还原反应中元素化合价变化的原因:
1.该反应中发生反应的微粒是什么?
2.NaCl中存在的微粒是什么?
3.它们是如何转化的?
交流讨论
Na+ Cl-
电子的得失
Na
Cl
+11
2
8
1
2
8
7
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
交流讨论
失去2×e-电子,化合价升高,被氧化
2Na + Cl2 ==== 2NaCl
点燃
0 0 +1 -1
得到2×e-电子,化合价降低,被还原
失去电子
得到电子
失电子
Na元素化合价升高
发生氧化反应
得电子
Cl元素化合价降低
发生还原反应
被氧化
被还原
H Cl
H Cl
+1
共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
-1
交流讨论
问题解决
电子
电子
氧化反应
失去电子(电子对偏离)
化合价升高
还原反应
得到电子(电子对偏向)
化合价降低
氧化还原的实质是电子的转移
一、氧化还原反应
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:
1. 氧化还原反应
凡是有元素化合价升降的化学反应
2. 氧化还原反应的实质
电子的转移(电子的得失和电子对的偏移)
问题解决
氧化还原反应与四种基本反应类型的关系:
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
问题解决
交叉分类法
非氧化还原反应
氧化还原反应
复分解反应
化合反应
分解反应
置换反应
生活化学
氧化还原反应无处不在
例题讲解
解析:只有C项中元素的化合价发生变化。
1.下列反应属于氧化还原反应的是( )
C
A.CaCO3+2HCl === CaCl2+H2O+CO2↑
B.2NaHCO3 === Na2CO3+H2O+CO2↑
C.Cl2+2NaOH === NaCl+NaClO+H2O
D.NaBr+AgNO3 === AgBr↓+NaNO3
2. 下列变化中,属于还原反应的是( )
D
例题讲解
解析:物质发生还原反应时,所含元素的化合价将降低。Cl-→Cl2,化合价由-1价升高为0价,发生氧化反应;FeCl2→FeCl3,铁元素化合价由+2→+3,发生氧化反应;C→CO2,碳元素化合价由0→+4,发生氧化反应;KMnO4→MnO2,锰元素化合价由+7→+4,发生还原反应。
A.Cl-→Cl2 B.FeCl2→FeCl3
C.C→CO2 D.KMnO4→MnO2
3.下列说法正确的是( )
A.化合价升高的反应是还原反应
B.氧化还原反应一定有氧元素参加
C.氧化反应与还原反应同时发生
D.反应物要么发生氧化反应,要么发生还原反应
例题讲解
解析:元素化合价升高的反应为氧化反应;只要有元素化合价升降(或电子转移)的反应就是氧化还原反应,与是否有氧元素参加无关;氧化反应与还原反应一定同时发生;反应物中有些物质可能既不发生氧化反应也不发生还原反应,如反应HCl+NaOH===NaCl+H2O,为非氧化还原反应,HCl和NaOH既没有发生氧化反应也没有发生还原反应,但在Cl2+H2O HCl+HClO中,Cl2既发生氧化反应又发生还原反应。
C
例题讲解
4.已知CaH2中Ca为+2 价,对于CaH2+2H2O===Ca(OH)2
+2H2↑,下列说法正确的是( )
A.H2都是还原产物
B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原
D.氧化产物与还原产物的质量比为1∶1
解析:反应中元素化合价的变化如下: CaH2+2H2O===Ca(OH)2+2H2 ↑,可知CaH2中H-失去电子,氢元素被氧化;H2O中的H+得到电子,氢元素被还原;H2既是氧化产物又是还原产物,氧化产物与还原产物的质量比为1∶1,D正确。
+1
-1
D
本节内容结束
第 三 节 氧化还原反应
第1课时 氧化还原反应
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.认识氧化还原反应的本质是电子的转移。
2.能举例说明生产、生活中常见的氧化还原反应。
3.熟记常见物质的化合价,并能通过化合价的升降,判断氧化还原反应。
建立用微粒观认识氧化还原反应,形成宏观辨识与微观探析的化学学科核心素养。
问题设计
苹果“锈”了
铁锁锈了
美国高中教材《化学概念与应用》对还原反应(reduction reaction)是这样描述的:早期科学家因金属矿石中与金属结合的氧被移除了,金属矿石因此被还原成金属单质,称还原反应(有减轻、减少之意)。
问题设计
铁矿石
铸铁
Fe2O3 Fe
交流讨论
氧化反应和还原反应是同时进行的,这样的反应称为氧化还原反应。
氧化
还原
从得氧失氧角度分析氧化还原反应
Fe2O3 + 3CO 2Fe + 3CO2
高温
Fe2O3 Fe,发生的是 反应
CO CO2,发生的是 反应
完成下列反应的方程式,并思考问题:
2.标出以上反应中各元素的化合价,你能发现什么规律?
1.判断哪些物质发生氧化反应、那些发生还原反应?
(1)一氧化碳还原氧化铜
(2)氢气还原氧化铜
(3)碳与水高温下的反应
交流讨论
一、氧化还原反应
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:
1. 氧化还原反应
凡是有元素化合价升降的化学反应
下列反应是否为氧化还原反应?并判断哪些物质发生氧化反应、那些发生还原反应?
0 +2 +2 0
化合价升高
化合价降低
0 +1 +2 0
化合价升高
化合价降低
Fe + CuSO4 FeSO4 + Cu
Zn + 2HCl ZnCl2 + H2↑
失升氧
得降还
√
√
√
×
×
×
×
判断下列反应是否是氧化还原反应:
1. 2H2 + O2 2H2O
2. CaO + H2O Ca(OH)2
3. 2KMnO4 K2MnO4 + MnO2 + O2↑
4. CaCO3 CO2↑ + CaO
5. Fe + H2SO4 FeSO4 + H2↑
6. Cu + 2AgNO3 Cu(NO3)2 + 2Ag
7. Ba(OH)2 + H2SO4 BaSO4↓+ 2H2O
8. CaCl2 + Na2CO3 CaCO3↓ + 2NaCl
点燃
△
△
√
交流讨论
氧化还原反应中元素化合价变化的原因:
1.该反应中发生反应的微粒是什么?
2.NaCl中存在的微粒是什么?
3.它们是如何转化的?
交流讨论
Na+ Cl-
电子的得失
Na
Cl
+11
2
8
1
2
8
7
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
交流讨论
失去2×e-电子,化合价升高,被氧化
2Na + Cl2 ==== 2NaCl
点燃
0 0 +1 -1
得到2×e-电子,化合价降低,被还原
失去电子
得到电子
失电子
Na元素化合价升高
发生氧化反应
得电子
Cl元素化合价降低
发生还原反应
被氧化
被还原
H Cl
H Cl
+1
共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
-1
交流讨论
问题解决
电子
电子
氧化反应
失去电子(电子对偏离)
化合价升高
还原反应
得到电子(电子对偏向)
化合价降低
氧化还原的实质是电子的转移
一、氧化还原反应
氧化反应:物质所含元素化合价升高的反应
还原反应:物质所含元素化合价降低的反应
氧化还原反应:
1. 氧化还原反应
凡是有元素化合价升降的化学反应
2. 氧化还原反应的实质
电子的转移(电子的得失和电子对的偏移)
问题解决
氧化还原反应与四种基本反应类型的关系:
置换反应
复分解反应
化合反应
分解反应
化学反应
氧化还原反应
非氧化还原反应
问题解决
交叉分类法
非氧化还原反应
氧化还原反应
复分解反应
化合反应
分解反应
置换反应
生活化学
氧化还原反应无处不在
例题讲解
解析:只有C项中元素的化合价发生变化。
1.下列反应属于氧化还原反应的是( )
C
A.CaCO3+2HCl === CaCl2+H2O+CO2↑
B.2NaHCO3 === Na2CO3+H2O+CO2↑
C.Cl2+2NaOH === NaCl+NaClO+H2O
D.NaBr+AgNO3 === AgBr↓+NaNO3
2. 下列变化中,属于还原反应的是( )
D
例题讲解
解析:物质发生还原反应时,所含元素的化合价将降低。Cl-→Cl2,化合价由-1价升高为0价,发生氧化反应;FeCl2→FeCl3,铁元素化合价由+2→+3,发生氧化反应;C→CO2,碳元素化合价由0→+4,发生氧化反应;KMnO4→MnO2,锰元素化合价由+7→+4,发生还原反应。
A.Cl-→Cl2 B.FeCl2→FeCl3
C.C→CO2 D.KMnO4→MnO2
3.下列说法正确的是( )
A.化合价升高的反应是还原反应
B.氧化还原反应一定有氧元素参加
C.氧化反应与还原反应同时发生
D.反应物要么发生氧化反应,要么发生还原反应
例题讲解
解析:元素化合价升高的反应为氧化反应;只要有元素化合价升降(或电子转移)的反应就是氧化还原反应,与是否有氧元素参加无关;氧化反应与还原反应一定同时发生;反应物中有些物质可能既不发生氧化反应也不发生还原反应,如反应HCl+NaOH===NaCl+H2O,为非氧化还原反应,HCl和NaOH既没有发生氧化反应也没有发生还原反应,但在Cl2+H2O HCl+HClO中,Cl2既发生氧化反应又发生还原反应。
C
例题讲解
4.已知CaH2中Ca为+2 价,对于CaH2+2H2O===Ca(OH)2
+2H2↑,下列说法正确的是( )
A.H2都是还原产物
B.H2都是氧化产物
C.CaH2中的氢元素既被氧化又被还原
D.氧化产物与还原产物的质量比为1∶1
解析:反应中元素化合价的变化如下: CaH2+2H2O===Ca(OH)2+2H2 ↑,可知CaH2中H-失去电子,氢元素被氧化;H2O中的H+得到电子,氢元素被还原;H2既是氧化产物又是还原产物,氧化产物与还原产物的质量比为1∶1,D正确。
+1
-1
D
本节内容结束
