化学人教版(2019)选择性必修1 2.2化学平衡(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2化学平衡(共33张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 916.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 16:51:38 | ||
图片预览









文档简介
(共33张PPT)
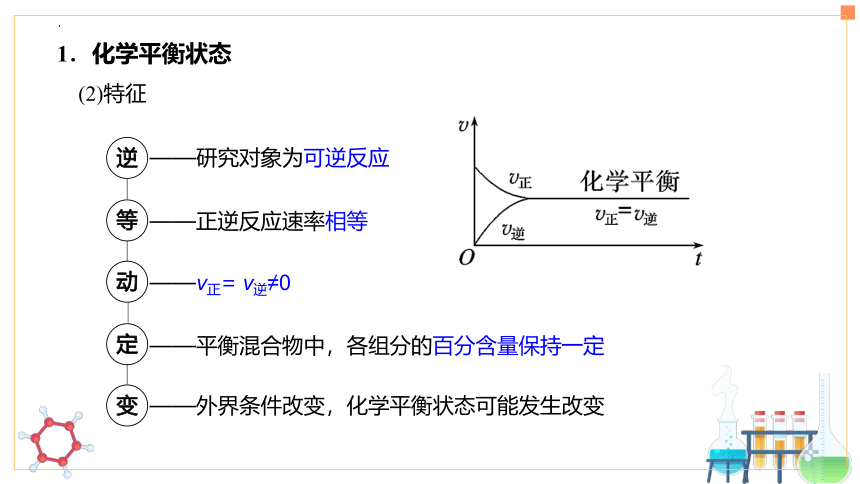
一定条件下的可逆反应中,当v正=v逆时,c(反应物)和c(生成物)均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。
1.化学平衡状态
(1)含义
1.化学平衡状态
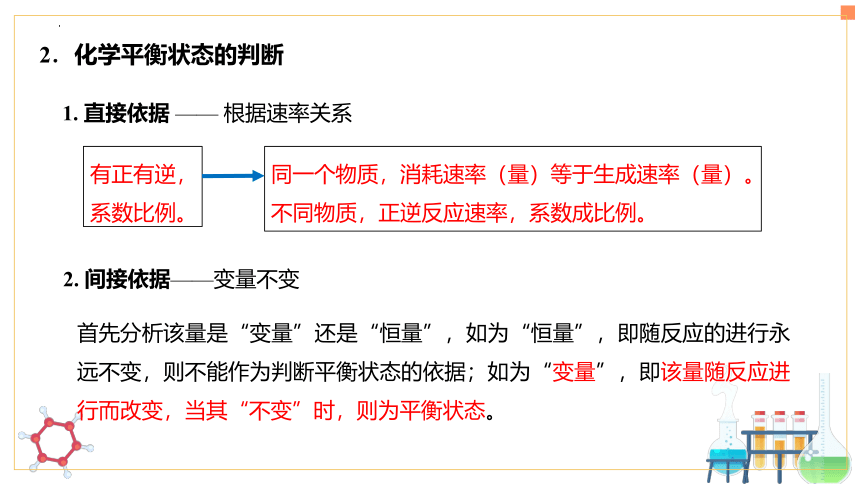
(2)特征
逆
等
动
定
变
——研究对象为可逆反应
——v正= v逆≠0
——正逆反应速率相等
——平衡混合物中,各组分的百分含量保持一定
——外界条件改变,化学平衡状态可能发生改变
例1.在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法正确的是
A.生成SO3 2 mol
B.SO2和SO3共2 mol
C.放出197 kJ热量
D.含氧原子共8 mol
√
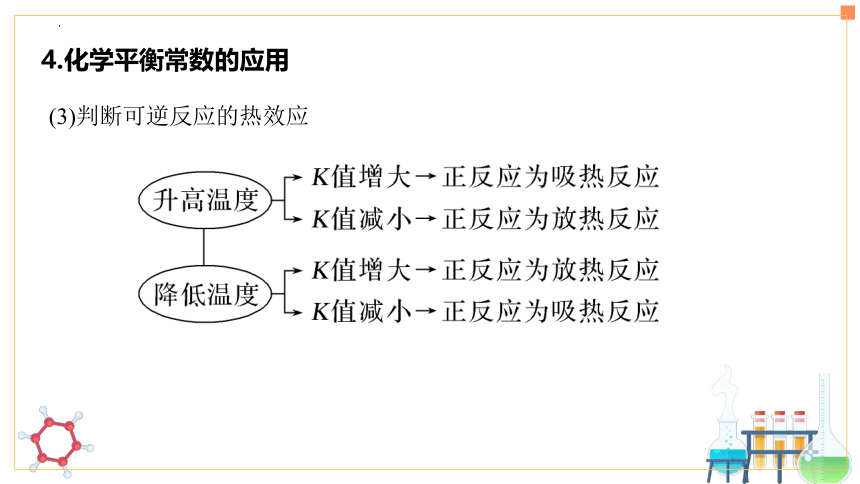
1. 直接依据 —— 根据速率关系
2. 间接依据——变量不变
2.化学平衡状态的判断
有正有逆,系数比例。
同一个物质,消耗速率(量)等于生成速率(量)。
不同物质,正逆反应速率,系数成比例。
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
例2.在一定温度下的恒容容器中,当下列物理量不再发生变化时:
①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的浓度之比等于化学计量数之比;⑦某种气体的百分含量
能说明以下反应达到平衡状态的是:
(1) 2SO2(g)+O2(g)2SO3(g) __________。
(2)I2(g)+H2(g) 2HI(g) ______。
(3)2NO2(g) N2O4(g) ____________。
(4)C(s)+CO2(g) 2CO(g) ___________。
(5) NH2COONH4(s) 2NH3(g)+CO2(g) ________。
(6) 5CO(g)+I2O5(s) 5CO2(g)+I2(s) ________。
①③④⑦
⑤⑦
①③④⑤⑦
①②③④⑦
①②③
②④⑦
3.化学平衡常数
(1)概念:在一定温度下,当一个可逆反应达到平衡状态时,生成物的浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,简称平衡常数,用符号K表示。
特点:
符号:K
K 的数值只与温度有关
任意时刻,浓度商Q=
平衡状态时,K=Q=
①在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,都为浓度商,而化学平衡常数,则是在一定温度下可逆反应达到平衡时的浓度商。
②当Q=K时,表明该反应已达到化学平衡状态。
浓度商与平衡常数有什么区别?
(2)表达式:
mA(g)+nB(g) pC(g)+qD(g)
3.化学平衡常数
例3.(1)已知在600 ℃时,写出以下三个反应的平衡常数表达式:
反应①:CO(g)+CuO(s) CO2(g)+Cu(s) K1=_______
反应②:H2(g)+CuO(s) Cu(s)+H2O(g) K2=_______
反应③:CO(g)+H2O(g) CO2(g)+H2(g) K3=_____________
(2)反应④2CO(g)+2CuO(s) 2CO2(g)+2Cu(s)的平衡常数K4与K1的关系是__________。
(3)反应③的K3与K1、K2的关系是________。
归纳总结
(1)K与化学计量数等倍扩大或缩小成幂指数关系。
(2)对于给定的化学反应,正、逆反应的平衡常数互为倒数。
(3)若两反应的平衡常数分别为K1、K2,则:
①若两反应相加,则总反应的平衡常数K=K1·K2。
②若两反应相减,则总反应的平衡常数K= 。
4.化学平衡常数的应用
(1)判断反应进行的程度
K 越大,反应进行的程度越大,转化率越大。
(3)判断可逆反应的热效应
4.化学平衡常数的应用
——“三段式”法
c(初)/(mol·L-1)
Δc/(mol·L-1)
c(平)/(mol·L-1)
(1)巧设未知数:根据题目要求灵活设立
(2)确定三个量:确定平衡体系中各物质的起始量、变化量、平衡量并列出三段式
关
键
找到达平衡状态时的转化量和平衡量
c2-
x
c1-x
c1 c2 0 0
mA(g)+nB(g) pC(g)+qD(g)
(3)解决问题:明确“始” “变” “平”三个量的具体数值,根据相应关系进行计算
5.化学平衡常数的相关计算
例4. 一定温度下,将0.050 mol SO2(g)和0.030 mol O2(g)注入体积为1.0 L的密闭反应器,发生反应2SO2(g)+O2(g) 2SO3(g),达到平衡后,测得SO3的平衡浓度为0.044 mol·L-1。
(1)计算SO2和O2的平衡转化率。
(2)计算该温度下的平衡常数K。
88% 73%
例5.我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称
DMF]制备三甲胺[N(CH3)3]:
8
(2)向体积相等的Ⅰ、Ⅱ两个恒容密闭容器中分别充入1 mol DMF(g)和2 mol H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
①容器Ⅰ中为________(填“绝热”或“恒温”)过程。判断的依据是_________________________________________。
②在容器Ⅱ中,0~12 min内H2分压变化速率为________ kPa·min-1。
③n点时反应的平衡常数Kp=________(kPa)-1。(提示:用分压代替相应物质的平衡浓度计算的平衡常数为Kp,分压等于总压×物质的量分数)
绝热
容器Ⅰ中的压强比容器Ⅱ中的压强大
1
0.562 5
A
一定条件下,化学反应速率与反应物浓度之间存在一定的函数关系,但这种关系只有通过实验测得。
对于基元反应 aA +bB= cC
v =k ca (A) c b(B)
其中 k称为速率常数;
它表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,通常反应速率常数越大,反应进行得越快。不同反应有不同的速率常数。
6.反应速率方程
适用范围: ①基元反应
② 对于非基元反应,其速率方程的浓度的次方与反应方程的计量数无确定关系,需要由实验测得。
例:在298K时,实验测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时的速率提出了浓度与反应速率的关系式:
v =k c(H2O2) c(HI)
6.反应速率方程
对于一般的化学反应: mA +nB=pC +qD,通过实验可以确定其反应速率与反应物浓度之间的关系:
v =k cx (A) c y(B)
这个方程被称为化学反应速率方程。
①式中c(A),c(B)分别为反应物A和B的浓度
② x, y 可以是正整数、零、分数、负数。
一个化学反应的浓度跟速率的关系式由实验测得,不能随意根据反应的化学方程式直接写出。
总结:
例8.[2021新高考八省(市)联考河北化学,双选题]一定条件下,反应H2(g)+Br2(g) 2HBr(g)的速率方程为v= kcα(H2)cβ(Br2)cγ(HBr),某温度下,该反应在不同浓度下的反应速率如下表:
根据表中的测定结果,下列结论错误的是 ( )
A.表中x的值为4
B.α、β、γ的值分别为1、2、-1
C.反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大
D.在反应体系中保持其他物质浓度不变,增大HBr(g)的浓度,会使反应速率降低
c(H2)/(mol·L-1) c(Br2)/(mol·L-1) c(HBr)/(mol·L-1) 反应速率
0.1 0.1 2 v
0.1 0.4 2 8v
0.2 0.4 2 16v
0.4 0.1 4 2v
0.2 0.1 x 4v
AB
对于基元反应aA(g)+bB(g) cC(g)+dD(g)
平衡常数K= =
7.速率常数与化学平衡常数的关系
v正=k正·ca(A)·cb(B),
v逆=k逆·cc(C)·cd(D),
反应达到平衡时v正=v逆,故K= 。
例9.T1温度时在容积为2 L的恒容密闭容器中发生反应:2NO(g)+O2(g)
2NO2(g) ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数,只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 1 0.6 0.4 0.2 0.2 0.2
n(O2)/mol 0.6 0.4 0.3 0.2 0.2 0.2
160
(2)若将容器的温度改变为T2时,其k正=k逆,则T2______(填“>”“<”或“=”)T1。
>
8.影响化学平衡的因素
浓度
压强
温度
外界条件改变后,化学平衡就一定移动吗?
②υ正 >υ逆:
平衡向正反应方向移动
③υ正 <υ逆:
平衡向逆反应方向移动
①υ正 =υ逆:
平衡不移动
如果改变影响平衡的一个条件(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动,该结论就是勒夏特列原理。
其他条件不变时:
减小反应物的浓度,平衡向逆反应(反应物浓度增大)方向移动;
增大反应物的浓度,平衡向正反应(反应物浓度减小)方向移动。
浓度
问题1:根据浓度对化学平衡的影响,请以时间为横坐标,化学反应速率为纵坐标,画出反应物浓度增大或减小对化学平衡移动影响的v-t图像。
v (正)
v (逆)
v'正=v'逆
v正=v逆
增大反应物浓度
v (逆)
v (正)
v'正=v'逆
减小反应物浓度
问题2:画出生成物浓度增大或减小对化学平衡移动影响的v-t图像。
v (逆)
v (正)
v'正=v'逆
增大生成物浓度
v (正)
v (逆)
v'正=v'逆
减小生成物浓度
在其他条件不变的情况下:
升高温度,平衡向吸热反应方向移动;
降低温度,平衡向放热反应方向移动。
温度
问题3:根据温度对化学平衡的影响,画出温度的变化对化学平衡移动影响的v-t图像。
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
升高温度
v (逆)
v (正)
v'正=v'逆
降低温度
v正=v逆
问题3:根据温度对化学平衡的影响,画出温度的变化对化学平衡移动影响的v-t图像。
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
升高温度
v (逆)
v (正)
v'正=v'逆
降低温度
v正=v逆
问题5:对于可 m A(g) + n B(g) p C(g) + q D(g),请画出不同情况下压强对化学平衡移动影响的v-t图像。
① m+n > p+q
v (正)
v (逆)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
压强
根据压强对平衡状态的影响:其他条件不变时,
减小压强,平衡向气体分子数增多的方向移动;
增大压强,平衡向气体分子数减小的方向移动。
增大压强
减小压强
② m+n < p+q
v (逆)
v (正)
v'正=v'逆
v (正)
v (逆)
v'正=v'逆
增大压强
减小压强
③ m+n = p+q
v'正=v'逆
v'正=v'逆
增大压强
减小压强
B
A
一定条件下的可逆反应中,当v正=v逆时,c(反应物)和c(生成物)均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。
1.化学平衡状态
(1)含义
1.化学平衡状态
(2)特征
逆
等
动
定
变
——研究对象为可逆反应
——v正= v逆≠0
——正逆反应速率相等
——平衡混合物中,各组分的百分含量保持一定
——外界条件改变,化学平衡状态可能发生改变
例1.在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法正确的是
A.生成SO3 2 mol
B.SO2和SO3共2 mol
C.放出197 kJ热量
D.含氧原子共8 mol
√
1. 直接依据 —— 根据速率关系
2. 间接依据——变量不变
2.化学平衡状态的判断
有正有逆,系数比例。
同一个物质,消耗速率(量)等于生成速率(量)。
不同物质,正逆反应速率,系数成比例。
首先分析该量是“变量”还是“恒量”,如为“恒量”,即随反应的进行永远不变,则不能作为判断平衡状态的依据;如为“变量”,即该量随反应进行而改变,当其“不变”时,则为平衡状态。
例2.在一定温度下的恒容容器中,当下列物理量不再发生变化时:
①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的浓度之比等于化学计量数之比;⑦某种气体的百分含量
能说明以下反应达到平衡状态的是:
(1) 2SO2(g)+O2(g)2SO3(g) __________。
(2)I2(g)+H2(g) 2HI(g) ______。
(3)2NO2(g) N2O4(g) ____________。
(4)C(s)+CO2(g) 2CO(g) ___________。
(5) NH2COONH4(s) 2NH3(g)+CO2(g) ________。
(6) 5CO(g)+I2O5(s) 5CO2(g)+I2(s) ________。
①③④⑦
⑤⑦
①③④⑤⑦
①②③④⑦
①②③
②④⑦
3.化学平衡常数
(1)概念:在一定温度下,当一个可逆反应达到平衡状态时,生成物的浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,简称平衡常数,用符号K表示。
特点:
符号:K
K 的数值只与温度有关
任意时刻,浓度商Q=
平衡状态时,K=Q=
①在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,都为浓度商,而化学平衡常数,则是在一定温度下可逆反应达到平衡时的浓度商。
②当Q=K时,表明该反应已达到化学平衡状态。
浓度商与平衡常数有什么区别?
(2)表达式:
mA(g)+nB(g) pC(g)+qD(g)
3.化学平衡常数
例3.(1)已知在600 ℃时,写出以下三个反应的平衡常数表达式:
反应①:CO(g)+CuO(s) CO2(g)+Cu(s) K1=_______
反应②:H2(g)+CuO(s) Cu(s)+H2O(g) K2=_______
反应③:CO(g)+H2O(g) CO2(g)+H2(g) K3=_____________
(2)反应④2CO(g)+2CuO(s) 2CO2(g)+2Cu(s)的平衡常数K4与K1的关系是__________。
(3)反应③的K3与K1、K2的关系是________。
归纳总结
(1)K与化学计量数等倍扩大或缩小成幂指数关系。
(2)对于给定的化学反应,正、逆反应的平衡常数互为倒数。
(3)若两反应的平衡常数分别为K1、K2,则:
①若两反应相加,则总反应的平衡常数K=K1·K2。
②若两反应相减,则总反应的平衡常数K= 。
4.化学平衡常数的应用
(1)判断反应进行的程度
K 越大,反应进行的程度越大,转化率越大。
(3)判断可逆反应的热效应
4.化学平衡常数的应用
——“三段式”法
c(初)/(mol·L-1)
Δc/(mol·L-1)
c(平)/(mol·L-1)
(1)巧设未知数:根据题目要求灵活设立
(2)确定三个量:确定平衡体系中各物质的起始量、变化量、平衡量并列出三段式
关
键
找到达平衡状态时的转化量和平衡量
c2-
x
c1-x
c1 c2 0 0
mA(g)+nB(g) pC(g)+qD(g)
(3)解决问题:明确“始” “变” “平”三个量的具体数值,根据相应关系进行计算
5.化学平衡常数的相关计算
例4. 一定温度下,将0.050 mol SO2(g)和0.030 mol O2(g)注入体积为1.0 L的密闭反应器,发生反应2SO2(g)+O2(g) 2SO3(g),达到平衡后,测得SO3的平衡浓度为0.044 mol·L-1。
(1)计算SO2和O2的平衡转化率。
(2)计算该温度下的平衡常数K。
88% 73%
例5.我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称
DMF]制备三甲胺[N(CH3)3]:
8
(2)向体积相等的Ⅰ、Ⅱ两个恒容密闭容器中分别充入1 mol DMF(g)和2 mol H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
①容器Ⅰ中为________(填“绝热”或“恒温”)过程。判断的依据是_________________________________________。
②在容器Ⅱ中,0~12 min内H2分压变化速率为________ kPa·min-1。
③n点时反应的平衡常数Kp=________(kPa)-1。(提示:用分压代替相应物质的平衡浓度计算的平衡常数为Kp,分压等于总压×物质的量分数)
绝热
容器Ⅰ中的压强比容器Ⅱ中的压强大
1
0.562 5
A
一定条件下,化学反应速率与反应物浓度之间存在一定的函数关系,但这种关系只有通过实验测得。
对于基元反应 aA +bB= cC
v =k ca (A) c b(B)
其中 k称为速率常数;
它表示单位浓度下的化学反应速率,与浓度无关,但受温度、催化剂、固体表面性质等因素的影响,通常反应速率常数越大,反应进行得越快。不同反应有不同的速率常数。
6.反应速率方程
适用范围: ①基元反应
② 对于非基元反应,其速率方程的浓度的次方与反应方程的计量数无确定关系,需要由实验测得。
例:在298K时,实验测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时的速率提出了浓度与反应速率的关系式:
v =k c(H2O2) c(HI)
6.反应速率方程
对于一般的化学反应: mA +nB=pC +qD,通过实验可以确定其反应速率与反应物浓度之间的关系:
v =k cx (A) c y(B)
这个方程被称为化学反应速率方程。
①式中c(A),c(B)分别为反应物A和B的浓度
② x, y 可以是正整数、零、分数、负数。
一个化学反应的浓度跟速率的关系式由实验测得,不能随意根据反应的化学方程式直接写出。
总结:
例8.[2021新高考八省(市)联考河北化学,双选题]一定条件下,反应H2(g)+Br2(g) 2HBr(g)的速率方程为v= kcα(H2)cβ(Br2)cγ(HBr),某温度下,该反应在不同浓度下的反应速率如下表:
根据表中的测定结果,下列结论错误的是 ( )
A.表中x的值为4
B.α、β、γ的值分别为1、2、-1
C.反应体系的三种物质中,Br2(g)的浓度对反应速率影响最大
D.在反应体系中保持其他物质浓度不变,增大HBr(g)的浓度,会使反应速率降低
c(H2)/(mol·L-1) c(Br2)/(mol·L-1) c(HBr)/(mol·L-1) 反应速率
0.1 0.1 2 v
0.1 0.4 2 8v
0.2 0.4 2 16v
0.4 0.1 4 2v
0.2 0.1 x 4v
AB
对于基元反应aA(g)+bB(g) cC(g)+dD(g)
平衡常数K= =
7.速率常数与化学平衡常数的关系
v正=k正·ca(A)·cb(B),
v逆=k逆·cc(C)·cd(D),
反应达到平衡时v正=v逆,故K= 。
例9.T1温度时在容积为2 L的恒容密闭容器中发生反应:2NO(g)+O2(g)
2NO2(g) ΔH<0。实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)·c(O2),v逆=v(NO2) 消耗=k逆c2(NO2),k正、k逆为速率常数,只受温度影响。不同时刻测得容器中n(NO)、n(O2)如表:
时间/s 0 1 2 3 4 5
n(NO)/mol 1 0.6 0.4 0.2 0.2 0.2
n(O2)/mol 0.6 0.4 0.3 0.2 0.2 0.2
160
(2)若将容器的温度改变为T2时,其k正=k逆,则T2______(填“>”“<”或“=”)T1。
>
8.影响化学平衡的因素
浓度
压强
温度
外界条件改变后,化学平衡就一定移动吗?
②υ正 >υ逆:
平衡向正反应方向移动
③υ正 <υ逆:
平衡向逆反应方向移动
①υ正 =υ逆:
平衡不移动
如果改变影响平衡的一个条件(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动,该结论就是勒夏特列原理。
其他条件不变时:
减小反应物的浓度,平衡向逆反应(反应物浓度增大)方向移动;
增大反应物的浓度,平衡向正反应(反应物浓度减小)方向移动。
浓度
问题1:根据浓度对化学平衡的影响,请以时间为横坐标,化学反应速率为纵坐标,画出反应物浓度增大或减小对化学平衡移动影响的v-t图像。
v (正)
v (逆)
v'正=v'逆
v正=v逆
增大反应物浓度
v (逆)
v (正)
v'正=v'逆
减小反应物浓度
问题2:画出生成物浓度增大或减小对化学平衡移动影响的v-t图像。
v (逆)
v (正)
v'正=v'逆
增大生成物浓度
v (正)
v (逆)
v'正=v'逆
减小生成物浓度
在其他条件不变的情况下:
升高温度,平衡向吸热反应方向移动;
降低温度,平衡向放热反应方向移动。
温度
问题3:根据温度对化学平衡的影响,画出温度的变化对化学平衡移动影响的v-t图像。
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
升高温度
v (逆)
v (正)
v'正=v'逆
降低温度
v正=v逆
问题3:根据温度对化学平衡的影响,画出温度的变化对化学平衡移动影响的v-t图像。
正反应是吸热反应
v (正)
v (逆)
v'正=v'逆
v正=v逆
升高温度
v (逆)
v (正)
v'正=v'逆
降低温度
v正=v逆
问题5:对于可 m A(g) + n B(g) p C(g) + q D(g),请画出不同情况下压强对化学平衡移动影响的v-t图像。
① m+n > p+q
v (正)
v (逆)
v'正=v'逆
v (逆)
v (正)
v'正=v'逆
压强
根据压强对平衡状态的影响:其他条件不变时,
减小压强,平衡向气体分子数增多的方向移动;
增大压强,平衡向气体分子数减小的方向移动。
增大压强
减小压强
② m+n < p+q
v (逆)
v (正)
v'正=v'逆
v (正)
v (逆)
v'正=v'逆
增大压强
减小压强
③ m+n = p+q
v'正=v'逆
v'正=v'逆
增大压强
减小压强
B
A
