2.3.1物质的量、化合价 课件(共41张PPT)2023-2024学年九年级化学第一学期同步备课系列(沪教版·上海)
文档属性
| 名称 | 2.3.1物质的量、化合价 课件(共41张PPT)2023-2024学年九年级化学第一学期同步备课系列(沪教版·上海) |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 00:00:00 | ||
图片预览











文档简介
(共41张PPT)
2.3.1物质的量、化合价
第2章 浩瀚的大气
教师
xxx
沪教版(上海) 九年级第一学期
物质的量
化合价、原子团
摩尔质量
01
03
02
CONTANTS
目 录
物质的量
01
建立模式
感受日常生活中常用的“集合体”
名称 个体计量量词 常用计量量词 常用计量形式
电视机
餐巾纸
大米
台
张
粒
袋
包、盒
台
个体
集合体
集合体
较小时
较大时
微粒
个
化学上,如何计量微粒数量?
1克水有_____滴
1滴水中大约有___________个水分子
十六万亿亿
20
1.67×1021
我一口气能喝6×1023个水分子!
你信吗?
分子、原子很小,一滴水中含有的水分子数值大到所有中国人(14亿),每人每分钟数100个,日夜不停,2万多年才能数完。
1____鞋
1____球
双
打
一个世纪表示_________。
双、打、世纪等都是集合的形式
2
12
100年
1双表示_____个
1打表示_____个
常用的量词
国际单位制中7个基本物理量:
长度 单位: m 质量 单位:kg
时间 单位: s 电流 单位: A
热力学温度 单位: K 发光强度 单位:cd
物质的量 单位:mol
物质的量
物质的量:专用名词,是一个 整体,不能简化或添加。
1.概念:物质的量——表示一定数目微粒集合体的物理量。
2.符号:n 单位:摩尔,简称:摩 符号:mol
3.使用范围:摩尔适用于微观粒子,不能用于宏观物体。
注意:使用摩尔时,必须指明粒子的种类,可以是分子、原子等微观粒子; 使用摩尔时必须指明微观粒子的名称或化学式 。
如:1mol氢分子 2mol CO2 0.3mol铁
宏观物质
1打 12个 铅笔
1箱 16瓶 啤酒
1盒 100枚 别针
1双 2支 筷子
微观物质
1mol _____个 分子(或原子等)
1摩尔是多少?
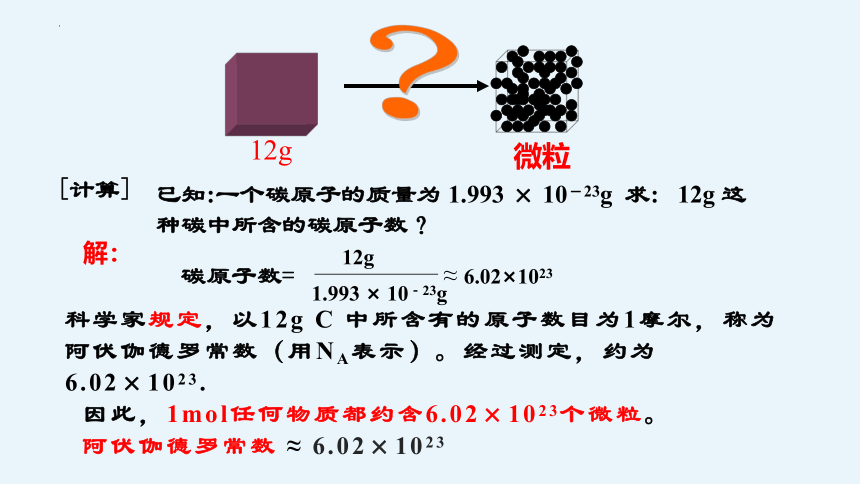
12g
微粒
?
已知:一个碳原子的质量为 1.993 × 10-23g 求: 12g 这种碳中所含的碳原子数?
[计算]
解:
≈ 6.02×1023
12g
1.993 × 10-23g
碳原子数=
科学家规定,以12g C 中所含有的原子数目为1摩尔,称为阿伏伽德罗常数(用NA表示)。经过测定,约为6.02×1023.
因此,1mol任何物质都约含6.02×1023个微粒。
阿伏伽德罗常数 ≈ 6.02×1023
1mol的任何物质都约含6.02×1023 个微粒
构成微粒
所有物质
注意:1)指代所有物质,无论是气体还是液体或者固体,
或者说是由分子还是原子构成。
2)要注明微粒的种类。
3)是个近似值
1摩尔氦气中有6.02X1023个氦原子
1摩尔水中有6.02X1023个水分子
3、用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
1、“物质的量”是一个物理量的全称,是一个专有名词;物 质的量不能当成物质的数量或质量来理解。
2、摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
4、 物质的量的数值可以是整数,也可以是小数。
[注意]
关于物质的量的几点说明
(1)摩尔是七个物理量之一。
(2)物质的量就是物质的质量。
(3) 1摩尔面条。
(4)1mol氢
错误。物质的量 是七个基本物理量之一
错误。物质的量和质量都是基本物理量,二者不能混淆!
错误。物质的量只适用于微观粒子,不能用来说明
宏观物质
错误。没有指出是分子、原子或离子
【讨论】
下面叙述是否正确
摩尔质量
02
1molH2O
约含有6.02×1023个水分子,
质量是18g
1molAl
约含有6.02×1023 个铝原子,
质量是27g
思考
1mol物质的质量到底有多大?
粒子符号 物质的式量 每个粒子的质量(g/个) 1摩物质质量(g)
C 12 1.993X10-23
Fe 56 9.032X10-23
H2SO4 98 1.628X10-22
H2O 18 2.990X10-23
Na+ 23 3.821X10-23
OH- 17 2.824X10-23
12
56
98
18
23
17
实践体验
(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
结论
1mol任何微粒的质量以克为单位时,在数值上等于该微粒的式量(相对原子质量或相对分子质量)。
讨论
分析以上计算结果可得出什么规律?
摩尔质量
摩尔质量
概念:
1mol物质的量的物质所具有的质量叫做摩尔质量
符号:M 常用单位:g/mol 、kg/mol
理解:
A、 1mol物质
B、数值上等于物质的相对原子(分子)质量
分子
原子
离子
H2SO4的摩尔质量为 、
1molH2SO4的质量是: 、
课堂练习
98g/mol
98g
1molH2SO4的相对分子质量质量是: 、
98
相对原子质量
相对分子质量
1mol物质的质量
摩尔质量
单位
数值
相
同
1
g
g·mol-1
三者之间的区别与联系
3molH2O的质量_____
2molH2O的质量_____
1molH2O的质量_____
18g
36g
54g
nmolH2O的质量____
18ng
n
M
m
=
课堂练习
H2O的摩尔质量为18g·mol-1
化合价、原子团
03
物 质 HCl H2O NaCl Fe2O3
原子个数比
2:1
1:1
1:1
2:3
化合物有固定的组成,形成化合物的元素有固定的原子个数比。
化合价——元素的原子在形成化合物时所表现出来的一种性质
化合价的规律:
1、化合价有正、有负;
2、在化合物里,正负化合价的代数和为零;
3、同种元素在不同的化合物中可显不同的化合价;
4、金属元素和非金属元素化合时,金属元素显正价,非金属元素显负价;
5、在单质里,元素的化合价为0。
化学上用“化合价”来表示不同原子或离子之间相互结合的数目关系。
但是化合价≠原子个数比
化合价有正价和负价
化合价的概念
化合价的表示方法
写在元素符号的正上方。 “+”、“—” 符号在前,数值在后。 “1”不能省略。
H2O
+ 4
C O2
- 2
+1
- 2
原子团的化合价
Ca(OH)2 CaCO3 Cu(NO3)2 BaSO4 Fe(OH)3
在这些化学式中有一些带电的原子团,如OH- 、 CO32- 、NO3 - 、SO42-,它们也叫做根。带电的原子团常作为一个整体出现,原子团也有化合价。
OH-
CO32-
NO3 -
SO42-
OH-
常见元素的化合价
金属元素 元素 符号 常见的化合价 非金属 元素 元素符号 常见的
化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氧 O -2
钙 Ca +2 氯 Cl -1、+1、+5、+7
镁 Mg +2 溴 Br -1、+1、+5、+7
钡 Ba +2 碘 I -1、+1、+5、+7
锌 Zn +2 氮 N -3、+3、+2、+4、+5
铝 Al +3 磷 P -3、+3、+5
铜 Cu +1、+2 硫 S -2、+4、+6
铁 Fe +2、+3 碳 C +2、+4
锰 Mn +2、+4、+6、+7 硅 Si +4
原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。
原子团 化学式 化合价 原子团 化学式 化合价
氢氧根 OH- -1 硝酸根 NO3- -1
碳酸根 CO32- -2 硫酸根 SO42- -2
铵根 NH4+ +1 高锰酸根 MnO4- -1
氯酸根 ClO3- -1 锰酸根 MnO42- -2
注意:
①原子团不能单独存在;
②带电荷的原子团也是离子。
常见原子团的化合价
一价氢氯钾钠银 二价氧钡钙镁锌
三铝四硅五价磷 一二铜,二三铁
二四碳,三五氮 二四六硫都齐全
负价元素系非金 金属元素都为正
铜汞二价最常见 正价负价要分清
单质元素价为零 化合物和为零
一些常见元素化合价口诀
负一硝酸氢氧根 负二硫酸碳酸根
负三记住磷酸根 正一价的是铵根
化合价的意义
Mg
+2
镁元素的化合价为+2价
说出下列符号中2的含义
2O 2O2 O2- 2O2- O CO2
-2
-2
MgO
+2
在氧化镁中镁元素的化合价为+2价
①金属元素通常显正价,非金属元素通常显负价。
NaCl H2O CaCl2 AlCl3 KCl MgCl2
+1
-1
+1
+1
-1
-1
-1
-1
-2
+2
+2
+3
②在化合物里氢通常显+1价,氧通常显-2价。
③许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价。
④在任何化合物里,正负化合价的代数和为零。
FeCl2 FeCl3 HCl H2S CO2 CO SiO2
+1
+1
-1
-1
-2
-2
-2
+2
+4
+2
+4
+3
-1
-2
SO2 SO3 P2O5 AgNO3 ZnSO4 NH4NO3
Na2CO3 BaCl2 ZnSO4 NaOH CuSO4
+1
-2
-2
-2
-1
-2
+2
+5
+6
+4
+1
+1
-2
-2
-2
+2
+2
+2
-1
-1
-3
+5
化合价的一般规律
例1 以水为例,H是+1价,O是-2价。
(1)、根据化合价写化学式
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
H2O
H O
H O
+1 -2
H2O
+ 1 -2
P O
+5 -2
两种元素化合价绝对值的最小公倍数: 10
P原子数:
验证: (+5)×2 + (-2)×5=0
【解】
O原子数:
答:这种磷的氧化物的化学式P2O5 。
例2已知某种磷的氧化物中磷为+5价 ,氧为-2价 ,写出这种磷的氧化物的化学式。
(2)根据化学式求化合价
试确定硫酸钾( K2SO4 )中硫元素的化合价
K2SO4
+6
-2
+1
1、先写出化学式,标出已知元素的化合价。
2、设未知数 。设K2SO4中S的化合价为X
3、列等式并求解。(+1)×2+X+(-2)×3=0
2.下列化学用语中,既能表示一种物质,还能表示一种元素的是( )
A.Na B.H C.Cl2 D.2N
A
1.我国很早就使用朱砂作为红色颜料。朱砂的主要成分是硫化汞(Hg),硫化汞中Hg的化合价为+2,则S的化合价是( )
A.﹣1 B.﹣2 C.+1 D.+2
B
3.冬季天气寒冷,流感多发,奥司他韦(C16H28N2O4)可抑制流感病毒在人体内的传播。下列对奥司他韦的说法正确的是( )
A.奥司他韦由碳、氢、氮、氧四种原子构成
B.一个奥司他韦分子中含有一个氮分子
C.奥司他韦中氢元素和氮元素的质量分数相等
D.奥司他韦中C、H、N、O元素的质量比为16:28:2:4
C
4.蔗糖(C12H22O11)是主要的食品甜味剂,下列关于蔗糖的说法正确的是( )
A.蔗糖中碳元素的质量分数最大
B.蔗糖分子由12个碳原子22个氢原子11个氧原子构成
C.蔗糖中碳、氢、氧元素的质量比为12:22:11
D.蔗糖的相对分子质量是342
D
5.化肥对提高农作物的产量具有重要作用。硝酸铵(NH4NO3)是一种常见的氨肥。请计算:
(1)硝酸铵中氮元素的质量分数为 ;
(2)100g该硝酸铵中氮元素的质量为________;
(3)若硝酸铵中含有28g氮元素,则硝酸铵的质量为 g。
35g
35%
80g
6.为使食品在较长的时间内保持色、香、味和口感,人们常在食品或食品包装中加入化学防腐剂苯甲酸,化学式为C6H5COOH。回答下列问题:
(1)苯甲酸由______种元素组成(填数字);
(2)一个苯甲酸分子中含有______个原子;
(3)苯甲酸的相对分子量为______;
(4)苯甲酸中碳元素、氢、氧元素的质量比为______(填最简整数比);
(5)苯甲酸中氧元素的质量分数为______(精确到0.1%);
(6)24.4g的苯甲酸中含氢元素的质量为______g。
【答案】(1)3(2)15(3)122(4)42:3:16(5)26.2%(6)1.2
感谢观看
2.3.1物质的量、化合价
第2章 浩瀚的大气
教师
xxx
沪教版(上海) 九年级第一学期
物质的量
化合价、原子团
摩尔质量
01
03
02
CONTANTS
目 录
物质的量
01
建立模式
感受日常生活中常用的“集合体”
名称 个体计量量词 常用计量量词 常用计量形式
电视机
餐巾纸
大米
台
张
粒
袋
包、盒
台
个体
集合体
集合体
较小时
较大时
微粒
个
化学上,如何计量微粒数量?
1克水有_____滴
1滴水中大约有___________个水分子
十六万亿亿
20
1.67×1021
我一口气能喝6×1023个水分子!
你信吗?
分子、原子很小,一滴水中含有的水分子数值大到所有中国人(14亿),每人每分钟数100个,日夜不停,2万多年才能数完。
1____鞋
1____球
双
打
一个世纪表示_________。
双、打、世纪等都是集合的形式
2
12
100年
1双表示_____个
1打表示_____个
常用的量词
国际单位制中7个基本物理量:
长度 单位: m 质量 单位:kg
时间 单位: s 电流 单位: A
热力学温度 单位: K 发光强度 单位:cd
物质的量 单位:mol
物质的量
物质的量:专用名词,是一个 整体,不能简化或添加。
1.概念:物质的量——表示一定数目微粒集合体的物理量。
2.符号:n 单位:摩尔,简称:摩 符号:mol
3.使用范围:摩尔适用于微观粒子,不能用于宏观物体。
注意:使用摩尔时,必须指明粒子的种类,可以是分子、原子等微观粒子; 使用摩尔时必须指明微观粒子的名称或化学式 。
如:1mol氢分子 2mol CO2 0.3mol铁
宏观物质
1打 12个 铅笔
1箱 16瓶 啤酒
1盒 100枚 别针
1双 2支 筷子
微观物质
1mol _____个 分子(或原子等)
1摩尔是多少?
12g
微粒
?
已知:一个碳原子的质量为 1.993 × 10-23g 求: 12g 这种碳中所含的碳原子数?
[计算]
解:
≈ 6.02×1023
12g
1.993 × 10-23g
碳原子数=
科学家规定,以12g C 中所含有的原子数目为1摩尔,称为阿伏伽德罗常数(用NA表示)。经过测定,约为6.02×1023.
因此,1mol任何物质都约含6.02×1023个微粒。
阿伏伽德罗常数 ≈ 6.02×1023
1mol的任何物质都约含6.02×1023 个微粒
构成微粒
所有物质
注意:1)指代所有物质,无论是气体还是液体或者固体,
或者说是由分子还是原子构成。
2)要注明微粒的种类。
3)是个近似值
1摩尔氦气中有6.02X1023个氦原子
1摩尔水中有6.02X1023个水分子
3、用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
1、“物质的量”是一个物理量的全称,是一个专有名词;物 质的量不能当成物质的数量或质量来理解。
2、摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
4、 物质的量的数值可以是整数,也可以是小数。
[注意]
关于物质的量的几点说明
(1)摩尔是七个物理量之一。
(2)物质的量就是物质的质量。
(3) 1摩尔面条。
(4)1mol氢
错误。物质的量 是七个基本物理量之一
错误。物质的量和质量都是基本物理量,二者不能混淆!
错误。物质的量只适用于微观粒子,不能用来说明
宏观物质
错误。没有指出是分子、原子或离子
【讨论】
下面叙述是否正确
摩尔质量
02
1molH2O
约含有6.02×1023个水分子,
质量是18g
1molAl
约含有6.02×1023 个铝原子,
质量是27g
思考
1mol物质的质量到底有多大?
粒子符号 物质的式量 每个粒子的质量(g/个) 1摩物质质量(g)
C 12 1.993X10-23
Fe 56 9.032X10-23
H2SO4 98 1.628X10-22
H2O 18 2.990X10-23
Na+ 23 3.821X10-23
OH- 17 2.824X10-23
12
56
98
18
23
17
实践体验
(1)1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
(2) 1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
(3) 1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
结论
1mol任何微粒的质量以克为单位时,在数值上等于该微粒的式量(相对原子质量或相对分子质量)。
讨论
分析以上计算结果可得出什么规律?
摩尔质量
摩尔质量
概念:
1mol物质的量的物质所具有的质量叫做摩尔质量
符号:M 常用单位:g/mol 、kg/mol
理解:
A、 1mol物质
B、数值上等于物质的相对原子(分子)质量
分子
原子
离子
H2SO4的摩尔质量为 、
1molH2SO4的质量是: 、
课堂练习
98g/mol
98g
1molH2SO4的相对分子质量质量是: 、
98
相对原子质量
相对分子质量
1mol物质的质量
摩尔质量
单位
数值
相
同
1
g
g·mol-1
三者之间的区别与联系
3molH2O的质量_____
2molH2O的质量_____
1molH2O的质量_____
18g
36g
54g
nmolH2O的质量____
18ng
n
M
m
=
课堂练习
H2O的摩尔质量为18g·mol-1
化合价、原子团
03
物 质 HCl H2O NaCl Fe2O3
原子个数比
2:1
1:1
1:1
2:3
化合物有固定的组成,形成化合物的元素有固定的原子个数比。
化合价——元素的原子在形成化合物时所表现出来的一种性质
化合价的规律:
1、化合价有正、有负;
2、在化合物里,正负化合价的代数和为零;
3、同种元素在不同的化合物中可显不同的化合价;
4、金属元素和非金属元素化合时,金属元素显正价,非金属元素显负价;
5、在单质里,元素的化合价为0。
化学上用“化合价”来表示不同原子或离子之间相互结合的数目关系。
但是化合价≠原子个数比
化合价有正价和负价
化合价的概念
化合价的表示方法
写在元素符号的正上方。 “+”、“—” 符号在前,数值在后。 “1”不能省略。
H2O
+ 4
C O2
- 2
+1
- 2
原子团的化合价
Ca(OH)2 CaCO3 Cu(NO3)2 BaSO4 Fe(OH)3
在这些化学式中有一些带电的原子团,如OH- 、 CO32- 、NO3 - 、SO42-,它们也叫做根。带电的原子团常作为一个整体出现,原子团也有化合价。
OH-
CO32-
NO3 -
SO42-
OH-
常见元素的化合价
金属元素 元素 符号 常见的化合价 非金属 元素 元素符号 常见的
化合价
钾 K +1 氢 H +1
钠 Na +1 氟 F -1
银 Ag +1 氧 O -2
钙 Ca +2 氯 Cl -1、+1、+5、+7
镁 Mg +2 溴 Br -1、+1、+5、+7
钡 Ba +2 碘 I -1、+1、+5、+7
锌 Zn +2 氮 N -3、+3、+2、+4、+5
铝 Al +3 磷 P -3、+3、+5
铜 Cu +1、+2 硫 S -2、+4、+6
铁 Fe +2、+3 碳 C +2、+4
锰 Mn +2、+4、+6、+7 硅 Si +4
原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。
原子团 化学式 化合价 原子团 化学式 化合价
氢氧根 OH- -1 硝酸根 NO3- -1
碳酸根 CO32- -2 硫酸根 SO42- -2
铵根 NH4+ +1 高锰酸根 MnO4- -1
氯酸根 ClO3- -1 锰酸根 MnO42- -2
注意:
①原子团不能单独存在;
②带电荷的原子团也是离子。
常见原子团的化合价
一价氢氯钾钠银 二价氧钡钙镁锌
三铝四硅五价磷 一二铜,二三铁
二四碳,三五氮 二四六硫都齐全
负价元素系非金 金属元素都为正
铜汞二价最常见 正价负价要分清
单质元素价为零 化合物和为零
一些常见元素化合价口诀
负一硝酸氢氧根 负二硫酸碳酸根
负三记住磷酸根 正一价的是铵根
化合价的意义
Mg
+2
镁元素的化合价为+2价
说出下列符号中2的含义
2O 2O2 O2- 2O2- O CO2
-2
-2
MgO
+2
在氧化镁中镁元素的化合价为+2价
①金属元素通常显正价,非金属元素通常显负价。
NaCl H2O CaCl2 AlCl3 KCl MgCl2
+1
-1
+1
+1
-1
-1
-1
-1
-2
+2
+2
+3
②在化合物里氢通常显+1价,氧通常显-2价。
③许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价。
④在任何化合物里,正负化合价的代数和为零。
FeCl2 FeCl3 HCl H2S CO2 CO SiO2
+1
+1
-1
-1
-2
-2
-2
+2
+4
+2
+4
+3
-1
-2
SO2 SO3 P2O5 AgNO3 ZnSO4 NH4NO3
Na2CO3 BaCl2 ZnSO4 NaOH CuSO4
+1
-2
-2
-2
-1
-2
+2
+5
+6
+4
+1
+1
-2
-2
-2
+2
+2
+2
-1
-1
-3
+5
化合价的一般规律
例1 以水为例,H是+1价,O是-2价。
(1)、根据化合价写化学式
(1)先写元素符号(正前负后)
(2)标出各元素的化合价(正上)
(3)把化合价数值化为最简
(4)把化简后的数字交叉写出(求最小公倍数)
H2O
H O
H O
+1 -2
H2O
+ 1 -2
P O
+5 -2
两种元素化合价绝对值的最小公倍数: 10
P原子数:
验证: (+5)×2 + (-2)×5=0
【解】
O原子数:
答:这种磷的氧化物的化学式P2O5 。
例2已知某种磷的氧化物中磷为+5价 ,氧为-2价 ,写出这种磷的氧化物的化学式。
(2)根据化学式求化合价
试确定硫酸钾( K2SO4 )中硫元素的化合价
K2SO4
+6
-2
+1
1、先写出化学式,标出已知元素的化合价。
2、设未知数 。设K2SO4中S的化合价为X
3、列等式并求解。(+1)×2+X+(-2)×3=0
2.下列化学用语中,既能表示一种物质,还能表示一种元素的是( )
A.Na B.H C.Cl2 D.2N
A
1.我国很早就使用朱砂作为红色颜料。朱砂的主要成分是硫化汞(Hg),硫化汞中Hg的化合价为+2,则S的化合价是( )
A.﹣1 B.﹣2 C.+1 D.+2
B
3.冬季天气寒冷,流感多发,奥司他韦(C16H28N2O4)可抑制流感病毒在人体内的传播。下列对奥司他韦的说法正确的是( )
A.奥司他韦由碳、氢、氮、氧四种原子构成
B.一个奥司他韦分子中含有一个氮分子
C.奥司他韦中氢元素和氮元素的质量分数相等
D.奥司他韦中C、H、N、O元素的质量比为16:28:2:4
C
4.蔗糖(C12H22O11)是主要的食品甜味剂,下列关于蔗糖的说法正确的是( )
A.蔗糖中碳元素的质量分数最大
B.蔗糖分子由12个碳原子22个氢原子11个氧原子构成
C.蔗糖中碳、氢、氧元素的质量比为12:22:11
D.蔗糖的相对分子质量是342
D
5.化肥对提高农作物的产量具有重要作用。硝酸铵(NH4NO3)是一种常见的氨肥。请计算:
(1)硝酸铵中氮元素的质量分数为 ;
(2)100g该硝酸铵中氮元素的质量为________;
(3)若硝酸铵中含有28g氮元素,则硝酸铵的质量为 g。
35g
35%
80g
6.为使食品在较长的时间内保持色、香、味和口感,人们常在食品或食品包装中加入化学防腐剂苯甲酸,化学式为C6H5COOH。回答下列问题:
(1)苯甲酸由______种元素组成(填数字);
(2)一个苯甲酸分子中含有______个原子;
(3)苯甲酸的相对分子量为______;
(4)苯甲酸中碳元素、氢、氧元素的质量比为______(填最简整数比);
(5)苯甲酸中氧元素的质量分数为______(精确到0.1%);
(6)24.4g的苯甲酸中含氢元素的质量为______g。
【答案】(1)3(2)15(3)122(4)42:3:16(5)26.2%(6)1.2
感谢观看
