化学人教版(2019)选择性必修1 3.4.1沉淀溶解平衡(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.1沉淀溶解平衡(共27张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 41.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
1、认识难溶电解质在水溶液中存在沉淀溶解平衡。
2、能通过实验证明难溶电解质沉淀溶解平衡的存在,进一步发展粒子观、平衡观。
难溶电解质沉淀溶解平衡的原理。
难溶电解质沉淀溶解平衡的原理。
你眼中的沉淀,我眼中是诗和远方
Ag+和Cl-恰好完全反应生成AgCl沉淀后,此时溶液中还有Ag+和Cl-?
活动一、镁与水的反应
探究活动
1、实验现象是什么,并写出上述反应的化学方程式。
Mg+2H2O Mg(OH)2+H2↑
溶液显碱性
难溶电解质氢氧化镁也能溶解产生OH-
Mg(OH)2(s) Mg2+(aq) +2OH-(aq)
2、溶液为什么会变红?
3、生成的氢氧化镁是难溶物,为什么溶液还会变红?
难溶并非不溶
有气泡产生,溶液变红
探究活动
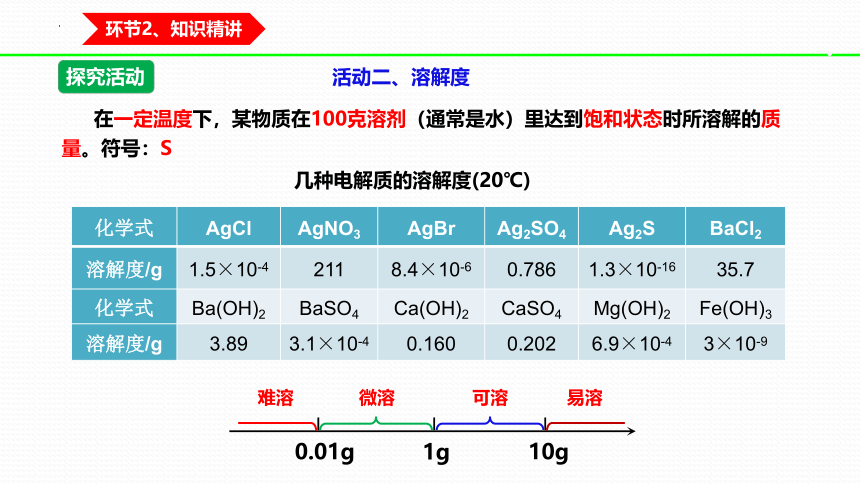
在一定温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量。符号:S
10g
1g
0.01g
难溶
微溶
可溶
易溶
活动二、溶解度
几种电解质的溶解度(20℃)
化学式 AgCl AgNO3 AgBr Ag2SO4 Ag2S BaCl2
溶解度/g 1.5×10-4 211 8.4×10-6 0.786 1.3×10-16 35.7
化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89 3.1×10-4 0.160 0.202 6.9×10-4 3×10-9
探究活动
化学式 AgCl Ag2S
溶解度/g 1.5×10-4 1.3×10-16
c(AgCl)=
n(AgCl)
V(溶液)
m(AgCl)
M(AgCl)
m(溶液)
ρ(溶液)
难溶并非不溶
n(AgCl)=
V(溶液)=
1.5×10-4g
143.5g/mol
100g
1g/mL
≈1×10-6mol
=100mL
c(AgCl) ≈
1×10-6mol
100mL
≈1×10-5mol/L
c(Ag2S) ≈1×10-17mol/L
1、计算20℃时,AgCl、Ag2S饱和溶液中溶质的物质的量浓度(溶液的密度近似看作1g/cm3)。
探究活动
根据上表所提供的溶解度数据,以及你对化学反应限度、化学平衡原理的认识,讨论以下问题:
1、通常我们所说的难溶物在水中是否完全不能溶解?
思考与讨论
2、生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+和Cl-?
通常所说的难溶物是指在常温下,其溶解度小于0.01 g,并不是在水中完全不能溶解。
生成AgCl沉淀的离子反应是指进行到一定限度,并不能完全进行到底,此时溶液中还有Ag+和Cl-。
观察饱和食盐水中加入浓盐酸的现象
探究活动
现象:
NaCl饱和溶液中析出固体
原因:
在NaCl的饱和溶液中,存在溶解平衡
NaCl(s) Na+(aq)+Cl-(aq)
加浓盐酸Cl- 的浓度增加,平衡向左移,NaCl析出。
存在溶解平衡
饱和硫酸铜溶液中加入硫酸铜晶体
探究活动
存在溶解平衡
现象:
不规则的硫酸铜晶体变规则了。
原因:
硫酸铜晶体不断溶液并析出,存在溶解平衡。
杠杆依旧保持平衡,硫酸铜晶体的质量没有改变。
可溶的电解质溶液的饱和溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
思考与讨论
溶解
沉淀
当v溶解=v沉淀时,得到饱和AgCl溶液,建立溶解平衡。
存在溶解平衡
向AgCl固体中加入水
在水分子作用下,少量Ag+与Cl-脱离AgCl的表面进入水中。
溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出。
溶解:
沉淀:
探究活动
一、沉淀溶解平衡
2、沉淀溶解平衡的建立
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
1、概念
在一定温度下,当难溶电解质溶解和沉淀的速率相等时,形成电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持不变,这种平衡称为沉淀溶解平衡。
3、特点
一、沉淀溶解平衡
逆、等、动、定、变
4、表达方法
注意:与电离平衡的表示方法不同
如:Al(OH)3为例
AgCl(s) Ag+(aq) + Cl-(aq)
Al(OH)3(s) Al3+(aq) + 3OH-(aq)
Al(OH)3 Al3++ 3OH-
溶解平衡:
电离平衡:
例1、书写碘化银、氢氧化镁溶解平衡方程式
AgI(s) Ag+(aq) + I-(aq)
Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)
例2、请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
BaSO4(s) Ba2+(aq) + SO42- (aq)
CaCO3(s) Ca2+(aq) + CO32- (aq)
Ag2S(s) 2Ag2+(aq) +S2-(aq)
时间/s
电导率( s/cm)
a
b
c
d
e
f
g
10
20
30
40
500
1000
0
CaCO3溶于水后电导率的变化示意图
1、将CaCO3溶于水后,溶液的电导率增大,说明什么?
2、一段时间后,电导率为什么保持不变?
存在溶解平衡
CaCO3(s) Ca2+(aq) + CO32-(aq)
思考与讨论
3、在c点加入10mL蒸馏水,电导率为什么先减小后增大?一段时间后,为什么又保持不变?电导率保持不变时,CaCO3的溶解停止了吗?
4、在e点加入10mL蒸馏水,为什么会重复出现上述现象?
时间/s
电导率( s/cm)
a
b
c
d
e
f
g
10
20
30
40
500
1000
0
CaCO3溶于水后电导率的变化示意图
CaCO3(s) Ca2+(aq) + CO32-(aq)
存在溶解平衡
思考与讨论
二、沉淀溶解平衡的影响因素——符合勒夏特列原理
1、本身的性质
2、外界条件
②温度
升温,多数平衡向溶解方向移动。
(气体,Ca(OH)2除外,溶解度随温度升高降低)
①浓度
加水,平衡向溶解方向移动;
加相同离子,平衡向沉淀方向移动。
加消耗离子的物质:平衡向溶解方向移动
体系变化 条件 c(Ag+) c(Cl-) m(AgCl) 移动方向
升温
加水
加AgNO3
通HCl
加少量氨水
增大
减小
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
减小
不变
不变
正向
正向
正向
逆向
逆向
例3、25℃下,AgCl固体的饱和溶液中存在下列沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)。当改变条件,完成下列空格:
例4、把氢氧化钙放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),改变下列条件,对Ca(OH)2(s)的物质的量有什么影响?
A、Na2S溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液
E、升高温度 F、加入碳酸钠固体
沉淀溶解平衡
存在固体即存在沉淀溶解平衡
4、含等物质的量的AgNO3与NaCl的溶液混合后,恰好完全生成AgCl沉淀,溶液中不存在Ag+和Cl-( )
2、难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀仍然同时进行着,只是v(溶解)=v(沉淀)( )
5、当溶液中某离子浓度小于1×10-5 mol·L-1时,可视为该离子沉淀完全( )
1、由于BaSO4难溶,所以将BaSO4加入水中,溶液中无Ba2+和SO42- ( )
3、Ca(OH)2溶解放热,所以Ca(OH)2(s) Ca2+(aq) + 2OH-(aq),升高温度溶解平衡逆向移动( )
√
√
√
×
×
练习1、下列说法是否正确。
练习2、难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是( )
A、沉淀的速率和溶解的速率相等
B、难溶电解质在水中形成饱和溶液
C、再加入难溶电解质,溶液中各离子的浓度不变
D、难溶电解质溶解形成的阴、阳离子的浓度相等
D
练习3、(双选)下列说法正确的是( )
A、往NaCl饱和溶液中滴加浓盐酸,NaCl的溶解度减小
B、升高温度,物质的溶解度都会增大
C、在饱和NaCl溶液中存在溶解平衡
D、在任何溶液中都存在溶解平衡
AC
练习4、氯化银在水中存在溶解平衡:AgCl(s) Ag+(aq) + Cl-(aq)。在相同温度下,将足量氯化银分别放人相同体积的下列溶液中,Ag+的浓度最小的是( )
A、0.1 mol/L 盐酸 B、蒸馏水
C、0.1 mol/L AlCl3溶液 D、0.1 mol/LMgCl2 溶液
C
练习5、在一定温度下, Mg(OH)2 固体在水溶液中达到沉淀溶解平衡Mg(OH)2(s) Mg2+(aq) +2OH-(aq) ,要使Mg(OH)2 固体减少而c(Mg2+)不变,可采取的措施是( )
A、加MgSO4固体 B、加盐酸
C、加NaOH固体 D、加水
D
①100mL硝酸钠溶液;
②100mL 0.1mol/L的食盐水;
③100mL 0.1mol/L的AlCl3溶液。
三种溶液中的c(Ag+)由大到小的顺序是:
①②③
练习6、AgCl(s) Ag+(aq)+Cl-(aq) 一定温度下, 把AgCl分别加入下列溶液:
1、认识难溶电解质在水溶液中存在沉淀溶解平衡。
2、能通过实验证明难溶电解质沉淀溶解平衡的存在,进一步发展粒子观、平衡观。
难溶电解质沉淀溶解平衡的原理。
难溶电解质沉淀溶解平衡的原理。
你眼中的沉淀,我眼中是诗和远方
Ag+和Cl-恰好完全反应生成AgCl沉淀后,此时溶液中还有Ag+和Cl-?
活动一、镁与水的反应
探究活动
1、实验现象是什么,并写出上述反应的化学方程式。
Mg+2H2O Mg(OH)2+H2↑
溶液显碱性
难溶电解质氢氧化镁也能溶解产生OH-
Mg(OH)2(s) Mg2+(aq) +2OH-(aq)
2、溶液为什么会变红?
3、生成的氢氧化镁是难溶物,为什么溶液还会变红?
难溶并非不溶
有气泡产生,溶液变红
探究活动
在一定温度下,某物质在100克溶剂(通常是水)里达到饱和状态时所溶解的质量。符号:S
10g
1g
0.01g
难溶
微溶
可溶
易溶
活动二、溶解度
几种电解质的溶解度(20℃)
化学式 AgCl AgNO3 AgBr Ag2SO4 Ag2S BaCl2
溶解度/g 1.5×10-4 211 8.4×10-6 0.786 1.3×10-16 35.7
化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89 3.1×10-4 0.160 0.202 6.9×10-4 3×10-9
探究活动
化学式 AgCl Ag2S
溶解度/g 1.5×10-4 1.3×10-16
c(AgCl)=
n(AgCl)
V(溶液)
m(AgCl)
M(AgCl)
m(溶液)
ρ(溶液)
难溶并非不溶
n(AgCl)=
V(溶液)=
1.5×10-4g
143.5g/mol
100g
1g/mL
≈1×10-6mol
=100mL
c(AgCl) ≈
1×10-6mol
100mL
≈1×10-5mol/L
c(Ag2S) ≈1×10-17mol/L
1、计算20℃时,AgCl、Ag2S饱和溶液中溶质的物质的量浓度(溶液的密度近似看作1g/cm3)。
探究活动
根据上表所提供的溶解度数据,以及你对化学反应限度、化学平衡原理的认识,讨论以下问题:
1、通常我们所说的难溶物在水中是否完全不能溶解?
思考与讨论
2、生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+和Cl-?
通常所说的难溶物是指在常温下,其溶解度小于0.01 g,并不是在水中完全不能溶解。
生成AgCl沉淀的离子反应是指进行到一定限度,并不能完全进行到底,此时溶液中还有Ag+和Cl-。
观察饱和食盐水中加入浓盐酸的现象
探究活动
现象:
NaCl饱和溶液中析出固体
原因:
在NaCl的饱和溶液中,存在溶解平衡
NaCl(s) Na+(aq)+Cl-(aq)
加浓盐酸Cl- 的浓度增加,平衡向左移,NaCl析出。
存在溶解平衡
饱和硫酸铜溶液中加入硫酸铜晶体
探究活动
存在溶解平衡
现象:
不规则的硫酸铜晶体变规则了。
原因:
硫酸铜晶体不断溶液并析出,存在溶解平衡。
杠杆依旧保持平衡,硫酸铜晶体的质量没有改变。
可溶的电解质溶液的饱和溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
思考与讨论
溶解
沉淀
当v溶解=v沉淀时,得到饱和AgCl溶液,建立溶解平衡。
存在溶解平衡
向AgCl固体中加入水
在水分子作用下,少量Ag+与Cl-脱离AgCl的表面进入水中。
溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出。
溶解:
沉淀:
探究活动
一、沉淀溶解平衡
2、沉淀溶解平衡的建立
溶解速率
沉淀速率
时间
速率
沉淀溶解平衡
1、概念
在一定温度下,当难溶电解质溶解和沉淀的速率相等时,形成电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持不变,这种平衡称为沉淀溶解平衡。
3、特点
一、沉淀溶解平衡
逆、等、动、定、变
4、表达方法
注意:与电离平衡的表示方法不同
如:Al(OH)3为例
AgCl(s) Ag+(aq) + Cl-(aq)
Al(OH)3(s) Al3+(aq) + 3OH-(aq)
Al(OH)3 Al3++ 3OH-
溶解平衡:
电离平衡:
例1、书写碘化银、氢氧化镁溶解平衡方程式
AgI(s) Ag+(aq) + I-(aq)
Mg(OH)2(s) Mg2+(aq) + 2OH-(aq)
例2、请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
BaSO4(s) Ba2+(aq) + SO42- (aq)
CaCO3(s) Ca2+(aq) + CO32- (aq)
Ag2S(s) 2Ag2+(aq) +S2-(aq)
时间/s
电导率( s/cm)
a
b
c
d
e
f
g
10
20
30
40
500
1000
0
CaCO3溶于水后电导率的变化示意图
1、将CaCO3溶于水后,溶液的电导率增大,说明什么?
2、一段时间后,电导率为什么保持不变?
存在溶解平衡
CaCO3(s) Ca2+(aq) + CO32-(aq)
思考与讨论
3、在c点加入10mL蒸馏水,电导率为什么先减小后增大?一段时间后,为什么又保持不变?电导率保持不变时,CaCO3的溶解停止了吗?
4、在e点加入10mL蒸馏水,为什么会重复出现上述现象?
时间/s
电导率( s/cm)
a
b
c
d
e
f
g
10
20
30
40
500
1000
0
CaCO3溶于水后电导率的变化示意图
CaCO3(s) Ca2+(aq) + CO32-(aq)
存在溶解平衡
思考与讨论
二、沉淀溶解平衡的影响因素——符合勒夏特列原理
1、本身的性质
2、外界条件
②温度
升温,多数平衡向溶解方向移动。
(气体,Ca(OH)2除外,溶解度随温度升高降低)
①浓度
加水,平衡向溶解方向移动;
加相同离子,平衡向沉淀方向移动。
加消耗离子的物质:平衡向溶解方向移动
体系变化 条件 c(Ag+) c(Cl-) m(AgCl) 移动方向
升温
加水
加AgNO3
通HCl
加少量氨水
增大
减小
增大
增大
增大
增大
增大
增大
减小
减小
减小
减小
减小
不变
不变
正向
正向
正向
逆向
逆向
例3、25℃下,AgCl固体的饱和溶液中存在下列沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq)。当改变条件,完成下列空格:
例4、把氢氧化钙放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),改变下列条件,对Ca(OH)2(s)的物质的量有什么影响?
A、Na2S溶液 B、AlCl3溶液
C、NaOH溶液 D、CaCl2溶液
E、升高温度 F、加入碳酸钠固体
沉淀溶解平衡
存在固体即存在沉淀溶解平衡
4、含等物质的量的AgNO3与NaCl的溶液混合后,恰好完全生成AgCl沉淀,溶液中不存在Ag+和Cl-( )
2、难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀仍然同时进行着,只是v(溶解)=v(沉淀)( )
5、当溶液中某离子浓度小于1×10-5 mol·L-1时,可视为该离子沉淀完全( )
1、由于BaSO4难溶,所以将BaSO4加入水中,溶液中无Ba2+和SO42- ( )
3、Ca(OH)2溶解放热,所以Ca(OH)2(s) Ca2+(aq) + 2OH-(aq),升高温度溶解平衡逆向移动( )
√
√
√
×
×
练习1、下列说法是否正确。
练习2、难溶电解质在水中达到沉淀溶解平衡时,下列说法中错误的是( )
A、沉淀的速率和溶解的速率相等
B、难溶电解质在水中形成饱和溶液
C、再加入难溶电解质,溶液中各离子的浓度不变
D、难溶电解质溶解形成的阴、阳离子的浓度相等
D
练习3、(双选)下列说法正确的是( )
A、往NaCl饱和溶液中滴加浓盐酸,NaCl的溶解度减小
B、升高温度,物质的溶解度都会增大
C、在饱和NaCl溶液中存在溶解平衡
D、在任何溶液中都存在溶解平衡
AC
练习4、氯化银在水中存在溶解平衡:AgCl(s) Ag+(aq) + Cl-(aq)。在相同温度下,将足量氯化银分别放人相同体积的下列溶液中,Ag+的浓度最小的是( )
A、0.1 mol/L 盐酸 B、蒸馏水
C、0.1 mol/L AlCl3溶液 D、0.1 mol/LMgCl2 溶液
C
练习5、在一定温度下, Mg(OH)2 固体在水溶液中达到沉淀溶解平衡Mg(OH)2(s) Mg2+(aq) +2OH-(aq) ,要使Mg(OH)2 固体减少而c(Mg2+)不变,可采取的措施是( )
A、加MgSO4固体 B、加盐酸
C、加NaOH固体 D、加水
D
①100mL硝酸钠溶液;
②100mL 0.1mol/L的食盐水;
③100mL 0.1mol/L的AlCl3溶液。
三种溶液中的c(Ag+)由大到小的顺序是:
①②③
练习6、AgCl(s) Ag+(aq)+Cl-(aq) 一定温度下, 把AgCl分别加入下列溶液:
