化学人教版(2019)选择性必修1 3.4.2沉淀溶解平衡常数(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.2沉淀溶解平衡常数(共28张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 16:56:40 | ||
图片预览







文档简介
(共28张PPT)
1、掌握沉淀溶解平衡常数Ksp及意义。
2、学会通过比较Q与Ksp的大小判断难溶电解质的沉淀与溶解,学会从定量角度分析沉淀的生成与转化。
沉淀溶解平衡常数Ksp及意义。
沉淀溶解平衡常数Ksp的应用。
平衡建立
平衡特征
影响因素
存在沉淀即存在平衡
逆、动、等、定、变
本身性质和浓度、温度
沉淀溶解平衡
如何定量表示沉淀溶解平衡的溶解程度大小
溶度积常数
1、定义
2、表达式
对于反应 MmAn(s) mMn+(aq) + nAm-(aq)
Ksp =(Mn+) · (Am-)
一、溶度积常数
在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数,叫做溶度积常数,简称溶度积(Ksp)。
固体物质不出现
平衡时刻:
例1、写出难溶物BaSO4、Fe(OH)3、Ag2CrO4、Ag2S沉淀溶解平衡方程式和溶度积表达式。
Ksp = c(Ba2+)·c(SO42-)
BaSO4(s) Ba2+(aq) + SO42-(aq)
Fe(OH)3(s) Fe3+(aq) + 3OH-(aq)
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
Ksp = c(Fe3+)·c3(OH-)
Ksp = c2(Ag+)·c(S2-)
Ag2S(s) 2Ag+(aq) + S2-(aq)
Ksp = c2(Ag+)·c(CrO42-)
3、影响因素
4、Ksp的意义
一、溶度积常数
Ksp只与难溶电解质的性质和温度有关。
Ksp反映了难溶电解质在水中的溶解能力。
T↑,Ksp↑ ; 但Ca(OH)2 相反
Ksp和溶解度有什么关系?
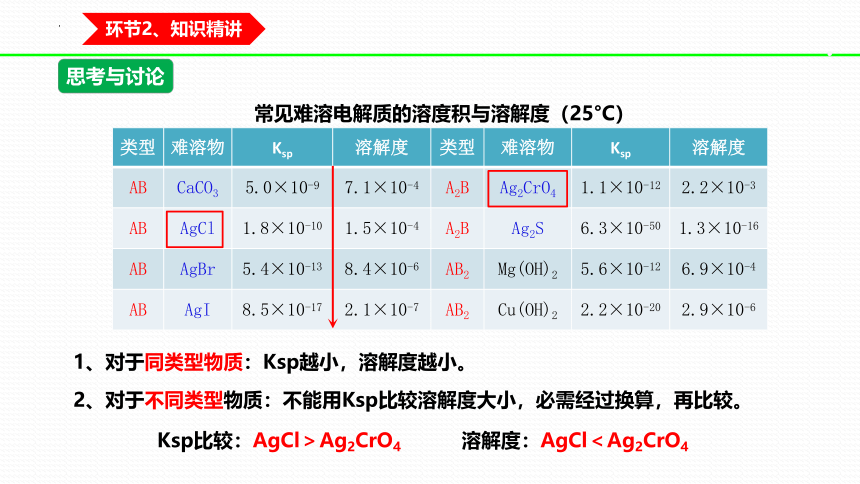
类型 难溶物 Ksp 溶解度 类型 难溶物 Ksp 溶解度
AB CaCO3 5.0×10-9 7.1×10-4 A2B Ag2CrO4 1.1×10-12 2.2×10-3
AB AgCl 1.8×10-10 1.5×10-4 A2B Ag2S 6.3×10-50 1.3×10-16
AB AgBr 5.4×10-13 8.4×10-6 AB2 Mg(OH)2 5.6×10-12 6.9×10-4
AB AgI 8.5×10-17 2.1×10-7 AB2 Cu(OH)2 2.2×10-20 2.9×10-6
常见难溶电解质的溶度积与溶解度(25°C)
2、对于不同类型物质:不能用Ksp比较溶解度大小,必需经过换算,再比较。
1、对于同类型物质:Ksp越小,溶解度越小。
溶解度:AgCl<Ag2CrO4
Ksp比较:AgCl>Ag2CrO4
思考与讨论
例2、Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
体系变化 条件 平衡移动方向 平衡后c(Mg2+) 平衡后c(OH-) Ksp
升高温度
加水稀释
加Mg(OH)2(s)
加MgCl2(s)
通入HCl
向右 增大 增大 增大
向右 不变 不变 不变
不移动 不变 不变 不变
向左 增大 减小 不变
向右 增大 减小 不变
Q>Ksp,溶液过饱和,有沉淀析出。
Q=Ksp,溶液刚饱和,沉淀与溶解处于平衡状态。
Q< Ksp,溶液未饱和,无沉淀析出。
AnBm(s) nAm+(aq) + mBn-(aq)
2、溶度积规则
1、离子积
Q =(Mn+) · (Am-)
二、溶度积常数的应用
Q为同温下,任意时刻离子浓度
题型1、离子是否沉淀完全(或调节到某pH值下,求溶液中离子浓度)
例1、已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=______________________。
pH=13.0,则c(H+)=1×10-13 mol/L,c(OH-)=1×10-1 mol/L。
二、溶度积常数的应用
5.6×10-10 mol/L
存在沉淀即存在平衡,就用Ksp
解析:
Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.6×10-12
则c(Mg2+)=
Ksp[Mg(OH)2]
c2(OH-)
=5.6×10-10 mol/L
例2、取5 mL 0.002 mol·L-1 BaCl2与等体积的 0.02 mol·L-1 Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+)<10-5mol·L-1]?
已知:Ksp[BaSO4]=1.0×10-10
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
1 1
5 mL×0.002 mol·L-1 5 mL×0.02 mol·L-1
解析:
由上可知,Na2SO4过量。
所得溶液中的c(SO42-)=
n(SO42-)
V(溶液)
=9×10-3 mol/L。
根据BaSO4的Ksp可得,c(Ba2+) =
Ksp[BaSO4]
c(SO42-)
≈1×10-8 mol/L
c(Ba2+) <1×10-5 mol/L,则Ba2+已经沉淀完全。
是
类型二、离子沉淀完全时,所需pH的计算
例3、用废电池的锌皮制作七水合硫酸锌,需去除锌皮中少量杂质铁,其方法是:加入稀硫酸和双氧水溶解,铁变为 ,加碱调节pH为 ,铁刚好完全沉淀。继续加碱调节pH为 ,锌开始沉淀(假定Zn2+浓度为0.1 mol/L)。若上述过程不加双氧水的后果是 ,原因是_____________________________
____________________。
(离子浓度小于1×10-5 mol/L时,即可认为该离子沉淀完全。)
已知:Ksp[Fe(OH)3]=1×10-39 ,Ksp[Zn(OH)2]=1×10-17,Ksp[Fe(OH)2]=1×10-17。
Ksp[Zn(OH)2]和Ksp[Fe(OH)2]
二、溶度积常数的应用
Fe3+
2.7
6
Fe2+和Zn2+不能同时除尽
很相近。
c(OH-)=
c(H+)=
Ksp[Fe(OH)3]= c (Fe3+)× c3(OH-)
Ksp[Fe(OH)3]
c(Fe3+)
3
1×10-39
1×10-5
3
=
×10-11 mol/L
1
10
3
=
解析:
pH=-lgc(H+)=2.7
≈2.1×10-3 mol/L
=
1×10-14
×10-11
1
10
3
Kw
c(OH-)
溶液中存在AgI和AgCl的溶解平衡,同一饱和溶液中c(Ag+)相同。
类型三、同一饱和溶液中,离子浓度的计算
例4、上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为________________。
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
二、溶度积常数的应用
4.7×10-7
c(I-)
c(Cl-)
解析:
c(I-)
c(Cl-)
因为滴加AgNO3溶液时,I-比Cl-先生成沉淀,所以当AgCl开始沉淀时,I-已经沉淀完全。
=4.7×10-7
=
Ksp(AgCl)
Ksp(AgI)
类型四、不同饱和溶液中,离子浓度的计算
例5、已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A、AgCl>AgI>Ag2CrO4 B、AgCl>Ag2CrO4>AgI
C、Ag2CrO4>AgCl>AgI D、Ag2CrO4>AgI>AgCl
二、溶度积常数的应用
解析:
AgCl(s) Ag+(aq)+Cl-(aq)
c(Ag+)=
Ksp[AgCl]
1.8×10-5
=
≈1.3×10-5 mol/L
饱和溶液中c(Ag+)=c(Cl-)
例5、已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A、AgCl>AgI>Ag2CrO4 B、AgCl>Ag2CrO4>AgI
C、Ag2CrO4>AgCl>AgI D、Ag2CrO4>AgI>AgCl
同理可得:
AgI饱和溶液中c(Ag+)≈1.2×10-8 mol/L
Ksp = c2(Ag+)·c(CrO42-)
x2
=x2 ·
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
x
x2
x=
2Ksp[Ag2CrO4]
3
=1.0×10-4 mol/L
Ag2CrO4饱和溶液中c(Ag+) =1.0×10-4 mol/L
C
类型五、同一溶液中,哪种离子先沉淀
例6、在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____________沉淀(填化学式)。
已知25℃ Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
二、溶度积常数的应用
Cu(OH)2
Mg(OH)2、Cu(OH)2沉淀生成时,所需OH-浓度哪个小,哪个先沉淀。
解析:
Mg(OH)2沉淀生成时,所需的OH-浓度为c(OH-)=
Ksp[Mg(OH)2]
c(Mg2+)
3
c(OH-) ≈1.3×10-5 mol/L
Cu(OH)2沉淀生成时,所需的OH-浓度为c(OH-)≈4.7×10-10 mol/L
类型六、溶液中哪种沉淀析出
例7、在25℃下,某1 L溶液中含有Cu2+、Al3+、Fe3+、H+,浓度均为0.1 mol·L-1,向该溶液中加入少量NaOH固体,测得溶液的pH=3,溶液的体积变化忽略不计。试问有哪种沉淀析出_____________(填化学式)。
已知25℃ Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38。
二、溶度积常数的应用
解析:
先计算离子积Q,再和Ksp比较,若Q>Ksp时,有沉淀析出;若Q<Ksp时,没有沉淀析出。
pH=3时,溶液中的c(OH-)=1.0×10-11 mol/L。
Q=c(Fe3+)×c3(OH-)=1×10-34>Ksp[Fe(OH)3],有Fe(OH)3沉淀析出。
Q=c(Al3+)×c3(OH-)=1×10-34<Ksp[Al(OH)3],无Al(OH)3沉淀析出。
Q=c(Cu3+)×c2(OH-)=1×10-23<Ksp[Cu(OH)2],无Cu(OH)2沉淀析出。
例7、在25℃下,某1 L溶液中含有Cu2+、Al3+、Fe3+、H+,浓度均为0.1 mol·L-1,向该溶液中加入少量NaOH固体,测得溶液的pH=3,溶液的体积变化忽略不计。试问有哪种沉淀析出_____________(填化学式)。
已知25℃ Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38。
解析:
Fe(OH)3
类型七、溶解度和Ksp的相互转化关系
例8、25℃,AgCl的溶解度是1.92×10-3g,求AgCl的溶度积。(AgCl的摩尔质量143.5 g/mol)
二、溶度积常数的应用
100 g水的体积约为100 mL,即溶液的体积约为100 mL。
≈1.3×10-5 mol
溶液中n(AgCl)=
m(AgCl)
M(AgCl)
根据溶解度的定义可知,100 g水中溶解1.92×10-3 g AgCl。
解析:
1.92×10-3g
143.5 g/mol
=
≈1.3×10-4 mol/L
溶液中的c(Ag+)=c(Cl-)≈1.3×10-4 mol/L
Ksp(AgCl)=c(Ag+)×c(Cl-)=1.69×10-8
c(AgCl)=
n(AgCl)
V(溶液)
=
1.3×10-5mol
100 mL
例8、25℃,AgCl的溶解度是1.92×10-3g,求AgCl的溶度积。(AgCl的摩尔质量143.5 g/mol)
解析:
例9、硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是( )(双选)
B、C
A、温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B、三个不同温度中,313 K时Ksp(SrSO4)最大
C、283 K时,图中a点对应的溶液是不饱和溶液
D、283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
类型八、数形结合
二、溶度积常数的应用
例10、某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A、加入Na2SO4可以使溶液由a点变到b点
B、通过蒸发可以使溶液由d点变到c点
C、d点无BaSO4沉淀生成
D、a点对应的Ksp大于c点对应的Ksp
C
类型八、数形结合
二、溶度积常数的应用
AnBm(s) nAm+(aq) + mBn-(aq)
Ksp =(Mn+) · (Am-)
1、解题原则:
存在沉淀即存在溶解平衡,存在平衡就用Ksp。
2、解题方法:
Ksp中三个物理量,已知两个量,计算第三个量。
①计算Qc,与Ksp比较判断平衡移动方向。
②计算c(OH-),判断沉淀完全时的pH。
③计算某离子浓度,判断该离子是否完全沉淀。
④同溶液中沉淀溶解平衡,离子浓度之比等于Ksp之比。
练习1、AgCl的Ksp=1.80×10-10,将0.001 mol/L NaCl和0.001 mol/L AgNO3 溶液等体积混合,是否有AgCl 沉淀生成
练习2、若将等体积的4.0mol/L的AgNO3溶液和4.0 mol/L的K2CrO4溶液混合,是否能析出Ag2CrO4沉淀?
已知Ksp(Ag2CrO4)= 2.0
练习4、已知硫化亚铁、硫化铜、硫化锌的溶度积分别为:3.7×10-19 、8.5×10-45 、1.2×10-23向等浓度FeCl2、CuSO4、ZnSO4中滴加0.01mol/L Na2S溶液时Fe2+、Zn2 +、Cu2+沉淀的先后顺序是:__________________。
练习3、实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?
[已知Fe(OH)3的Ksp为2.6×10-39]
练习5、已知Ksp[Cu(OH)2]=2.010-20
①某CuSO4溶液里,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,则应向溶液里加入NaOH溶液使c()至少为_________________。
②要使0.2mol/L CuSO4溶液中Cu2+沉淀较为完全(使Cu2+降至原来千分之一),应调整溶液的pH,使溶液的pH至少为________________。
1、掌握沉淀溶解平衡常数Ksp及意义。
2、学会通过比较Q与Ksp的大小判断难溶电解质的沉淀与溶解,学会从定量角度分析沉淀的生成与转化。
沉淀溶解平衡常数Ksp及意义。
沉淀溶解平衡常数Ksp的应用。
平衡建立
平衡特征
影响因素
存在沉淀即存在平衡
逆、动、等、定、变
本身性质和浓度、温度
沉淀溶解平衡
如何定量表示沉淀溶解平衡的溶解程度大小
溶度积常数
1、定义
2、表达式
对于反应 MmAn(s) mMn+(aq) + nAm-(aq)
Ksp =(Mn+) · (Am-)
一、溶度积常数
在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数,叫做溶度积常数,简称溶度积(Ksp)。
固体物质不出现
平衡时刻:
例1、写出难溶物BaSO4、Fe(OH)3、Ag2CrO4、Ag2S沉淀溶解平衡方程式和溶度积表达式。
Ksp = c(Ba2+)·c(SO42-)
BaSO4(s) Ba2+(aq) + SO42-(aq)
Fe(OH)3(s) Fe3+(aq) + 3OH-(aq)
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
Ksp = c(Fe3+)·c3(OH-)
Ksp = c2(Ag+)·c(S2-)
Ag2S(s) 2Ag+(aq) + S2-(aq)
Ksp = c2(Ag+)·c(CrO42-)
3、影响因素
4、Ksp的意义
一、溶度积常数
Ksp只与难溶电解质的性质和温度有关。
Ksp反映了难溶电解质在水中的溶解能力。
T↑,Ksp↑ ; 但Ca(OH)2 相反
Ksp和溶解度有什么关系?
类型 难溶物 Ksp 溶解度 类型 难溶物 Ksp 溶解度
AB CaCO3 5.0×10-9 7.1×10-4 A2B Ag2CrO4 1.1×10-12 2.2×10-3
AB AgCl 1.8×10-10 1.5×10-4 A2B Ag2S 6.3×10-50 1.3×10-16
AB AgBr 5.4×10-13 8.4×10-6 AB2 Mg(OH)2 5.6×10-12 6.9×10-4
AB AgI 8.5×10-17 2.1×10-7 AB2 Cu(OH)2 2.2×10-20 2.9×10-6
常见难溶电解质的溶度积与溶解度(25°C)
2、对于不同类型物质:不能用Ksp比较溶解度大小,必需经过换算,再比较。
1、对于同类型物质:Ksp越小,溶解度越小。
溶解度:AgCl<Ag2CrO4
Ksp比较:AgCl>Ag2CrO4
思考与讨论
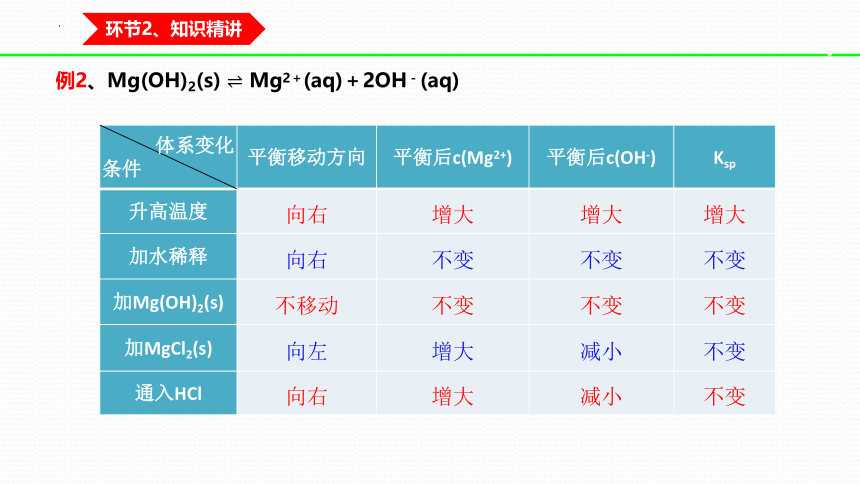
例2、Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
体系变化 条件 平衡移动方向 平衡后c(Mg2+) 平衡后c(OH-) Ksp
升高温度
加水稀释
加Mg(OH)2(s)
加MgCl2(s)
通入HCl
向右 增大 增大 增大
向右 不变 不变 不变
不移动 不变 不变 不变
向左 增大 减小 不变
向右 增大 减小 不变
Q>Ksp,溶液过饱和,有沉淀析出。
Q=Ksp,溶液刚饱和,沉淀与溶解处于平衡状态。
Q< Ksp,溶液未饱和,无沉淀析出。
AnBm(s) nAm+(aq) + mBn-(aq)
2、溶度积规则
1、离子积
Q =(Mn+) · (Am-)
二、溶度积常数的应用
Q为同温下,任意时刻离子浓度
题型1、离子是否沉淀完全(或调节到某pH值下,求溶液中离子浓度)
例1、已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=______________________。
pH=13.0,则c(H+)=1×10-13 mol/L,c(OH-)=1×10-1 mol/L。
二、溶度积常数的应用
5.6×10-10 mol/L
存在沉淀即存在平衡,就用Ksp
解析:
Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.6×10-12
则c(Mg2+)=
Ksp[Mg(OH)2]
c2(OH-)
=5.6×10-10 mol/L
例2、取5 mL 0.002 mol·L-1 BaCl2与等体积的 0.02 mol·L-1 Na2SO4的混合,计算Ba2+是否沉淀完全[即c(Ba2+)<10-5mol·L-1]?
已知:Ksp[BaSO4]=1.0×10-10
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
1 1
5 mL×0.002 mol·L-1 5 mL×0.02 mol·L-1
解析:
由上可知,Na2SO4过量。
所得溶液中的c(SO42-)=
n(SO42-)
V(溶液)
=9×10-3 mol/L。
根据BaSO4的Ksp可得,c(Ba2+) =
Ksp[BaSO4]
c(SO42-)
≈1×10-8 mol/L
c(Ba2+) <1×10-5 mol/L,则Ba2+已经沉淀完全。
是
类型二、离子沉淀完全时,所需pH的计算
例3、用废电池的锌皮制作七水合硫酸锌,需去除锌皮中少量杂质铁,其方法是:加入稀硫酸和双氧水溶解,铁变为 ,加碱调节pH为 ,铁刚好完全沉淀。继续加碱调节pH为 ,锌开始沉淀(假定Zn2+浓度为0.1 mol/L)。若上述过程不加双氧水的后果是 ,原因是_____________________________
____________________。
(离子浓度小于1×10-5 mol/L时,即可认为该离子沉淀完全。)
已知:Ksp[Fe(OH)3]=1×10-39 ,Ksp[Zn(OH)2]=1×10-17,Ksp[Fe(OH)2]=1×10-17。
Ksp[Zn(OH)2]和Ksp[Fe(OH)2]
二、溶度积常数的应用
Fe3+
2.7
6
Fe2+和Zn2+不能同时除尽
很相近。
c(OH-)=
c(H+)=
Ksp[Fe(OH)3]= c (Fe3+)× c3(OH-)
Ksp[Fe(OH)3]
c(Fe3+)
3
1×10-39
1×10-5
3
=
×10-11 mol/L
1
10
3
=
解析:
pH=-lgc(H+)=2.7
≈2.1×10-3 mol/L
=
1×10-14
×10-11
1
10
3
Kw
c(OH-)
溶液中存在AgI和AgCl的溶解平衡,同一饱和溶液中c(Ag+)相同。
类型三、同一饱和溶液中,离子浓度的计算
例4、上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 为________________。
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
二、溶度积常数的应用
4.7×10-7
c(I-)
c(Cl-)
解析:
c(I-)
c(Cl-)
因为滴加AgNO3溶液时,I-比Cl-先生成沉淀,所以当AgCl开始沉淀时,I-已经沉淀完全。
=4.7×10-7
=
Ksp(AgCl)
Ksp(AgI)
类型四、不同饱和溶液中,离子浓度的计算
例5、已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A、AgCl>AgI>Ag2CrO4 B、AgCl>Ag2CrO4>AgI
C、Ag2CrO4>AgCl>AgI D、Ag2CrO4>AgI>AgCl
二、溶度积常数的应用
解析:
AgCl(s) Ag+(aq)+Cl-(aq)
c(Ag+)=
Ksp[AgCl]
1.8×10-5
=
≈1.3×10-5 mol/L
饱和溶液中c(Ag+)=c(Cl-)
例5、已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A、AgCl>AgI>Ag2CrO4 B、AgCl>Ag2CrO4>AgI
C、Ag2CrO4>AgCl>AgI D、Ag2CrO4>AgI>AgCl
同理可得:
AgI饱和溶液中c(Ag+)≈1.2×10-8 mol/L
Ksp = c2(Ag+)·c(CrO42-)
x2
=x2 ·
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
x
x2
x=
2Ksp[Ag2CrO4]
3
=1.0×10-4 mol/L
Ag2CrO4饱和溶液中c(Ag+) =1.0×10-4 mol/L
C
类型五、同一溶液中,哪种离子先沉淀
例6、在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_____________沉淀(填化学式)。
已知25℃ Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
二、溶度积常数的应用
Cu(OH)2
Mg(OH)2、Cu(OH)2沉淀生成时,所需OH-浓度哪个小,哪个先沉淀。
解析:
Mg(OH)2沉淀生成时,所需的OH-浓度为c(OH-)=
Ksp[Mg(OH)2]
c(Mg2+)
3
c(OH-) ≈1.3×10-5 mol/L
Cu(OH)2沉淀生成时,所需的OH-浓度为c(OH-)≈4.7×10-10 mol/L
类型六、溶液中哪种沉淀析出
例7、在25℃下,某1 L溶液中含有Cu2+、Al3+、Fe3+、H+,浓度均为0.1 mol·L-1,向该溶液中加入少量NaOH固体,测得溶液的pH=3,溶液的体积变化忽略不计。试问有哪种沉淀析出_____________(填化学式)。
已知25℃ Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38。
二、溶度积常数的应用
解析:
先计算离子积Q,再和Ksp比较,若Q>Ksp时,有沉淀析出;若Q<Ksp时,没有沉淀析出。
pH=3时,溶液中的c(OH-)=1.0×10-11 mol/L。
Q=c(Fe3+)×c3(OH-)=1×10-34>Ksp[Fe(OH)3],有Fe(OH)3沉淀析出。
Q=c(Al3+)×c3(OH-)=1×10-34<Ksp[Al(OH)3],无Al(OH)3沉淀析出。
Q=c(Cu3+)×c2(OH-)=1×10-23<Ksp[Cu(OH)2],无Cu(OH)2沉淀析出。
例7、在25℃下,某1 L溶液中含有Cu2+、Al3+、Fe3+、H+,浓度均为0.1 mol·L-1,向该溶液中加入少量NaOH固体,测得溶液的pH=3,溶液的体积变化忽略不计。试问有哪种沉淀析出_____________(填化学式)。
已知25℃ Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33,Ksp[Fe(OH)3]=4.0×10-38。
解析:
Fe(OH)3
类型七、溶解度和Ksp的相互转化关系
例8、25℃,AgCl的溶解度是1.92×10-3g,求AgCl的溶度积。(AgCl的摩尔质量143.5 g/mol)
二、溶度积常数的应用
100 g水的体积约为100 mL,即溶液的体积约为100 mL。
≈1.3×10-5 mol
溶液中n(AgCl)=
m(AgCl)
M(AgCl)
根据溶解度的定义可知,100 g水中溶解1.92×10-3 g AgCl。
解析:
1.92×10-3g
143.5 g/mol
=
≈1.3×10-4 mol/L
溶液中的c(Ag+)=c(Cl-)≈1.3×10-4 mol/L
Ksp(AgCl)=c(Ag+)×c(Cl-)=1.69×10-8
c(AgCl)=
n(AgCl)
V(溶液)
=
1.3×10-5mol
100 mL
例8、25℃,AgCl的溶解度是1.92×10-3g,求AgCl的溶度积。(AgCl的摩尔质量143.5 g/mol)
解析:
例9、硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是( )(双选)
B、C
A、温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B、三个不同温度中,313 K时Ksp(SrSO4)最大
C、283 K时,图中a点对应的溶液是不饱和溶液
D、283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
类型八、数形结合
二、溶度积常数的应用
例10、某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A、加入Na2SO4可以使溶液由a点变到b点
B、通过蒸发可以使溶液由d点变到c点
C、d点无BaSO4沉淀生成
D、a点对应的Ksp大于c点对应的Ksp
C
类型八、数形结合
二、溶度积常数的应用
AnBm(s) nAm+(aq) + mBn-(aq)
Ksp =(Mn+) · (Am-)
1、解题原则:
存在沉淀即存在溶解平衡,存在平衡就用Ksp。
2、解题方法:
Ksp中三个物理量,已知两个量,计算第三个量。
①计算Qc,与Ksp比较判断平衡移动方向。
②计算c(OH-),判断沉淀完全时的pH。
③计算某离子浓度,判断该离子是否完全沉淀。
④同溶液中沉淀溶解平衡,离子浓度之比等于Ksp之比。
练习1、AgCl的Ksp=1.80×10-10,将0.001 mol/L NaCl和0.001 mol/L AgNO3 溶液等体积混合,是否有AgCl 沉淀生成
练习2、若将等体积的4.0mol/L的AgNO3溶液和4.0 mol/L的K2CrO4溶液混合,是否能析出Ag2CrO4沉淀?
已知Ksp(Ag2CrO4)= 2.0
练习4、已知硫化亚铁、硫化铜、硫化锌的溶度积分别为:3.7×10-19 、8.5×10-45 、1.2×10-23向等浓度FeCl2、CuSO4、ZnSO4中滴加0.01mol/L Na2S溶液时Fe2+、Zn2 +、Cu2+沉淀的先后顺序是:__________________。
练习3、实验测得某水样中的铁离子的浓度为6×10-6mol·L-1若要使水中的铁离子转化为沉淀,则溶液的pH值至少要控制在多少以上?
[已知Fe(OH)3的Ksp为2.6×10-39]
练习5、已知Ksp[Cu(OH)2]=2.010-20
①某CuSO4溶液里,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,则应向溶液里加入NaOH溶液使c()至少为_________________。
②要使0.2mol/L CuSO4溶液中Cu2+沉淀较为完全(使Cu2+降至原来千分之一),应调整溶液的pH,使溶液的pH至少为________________。
