化学苏教版(2019)必修第一册 1.2.2气体摩尔体积课件(共13张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 1.2.2气体摩尔体积课件(共13张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 419.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:03:19 | ||
图片预览




文档简介
(共13张PPT)
1.2.2 气体摩尔体积
思考:
1、1mol O2分子的个数为_____个,氧原子的个数为______个,质量是_____克。
32克
NA
2NA
2、1molO2分子的体积为多少 升?
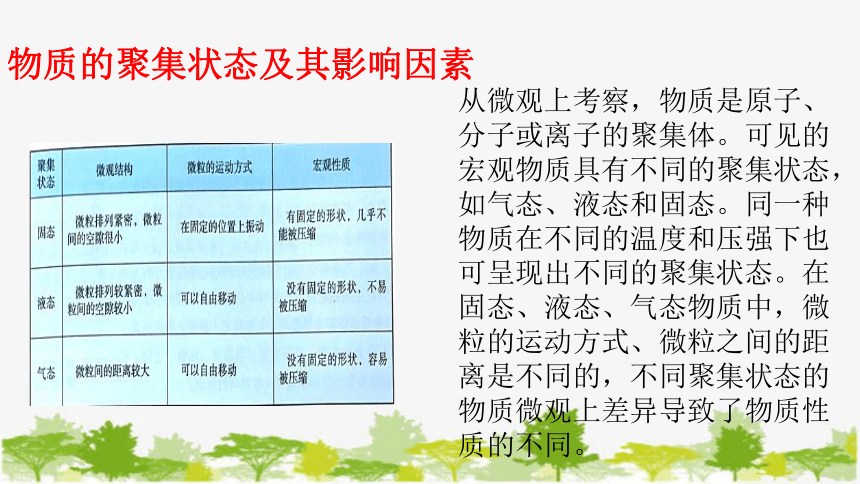
从微观上考察,物质是原子、分子或离子的聚集体。
可见的宏观物质具有不同的聚集状态,如气态、液态和固态。同一种物质在不同的温度和压强下也可呈现出不同的聚集状态。
思考:
生活经验告诉我们:固体具有固定的形状,液体、气体没有固定的形状;气体容易被压缩,而固体、液体不易被压缩。
为什么固态、液态和气态物质的某些性质存在差异?这与物质的微观结构有何联系?
物质的聚集状态及其影响因素
从微观上考察,物质是原子、分子或离子的聚集体。可见的宏观物质具有不同的聚集状态,如气态、液态和固态。同一种物质在不同的温度和压强下也可呈现出不同的聚集状态。在固态、液态、气态物质中,微粒的运动方式、微粒之间的距离是不同的,不同聚集状态的物质微观上差异导致了物质性质的不同。
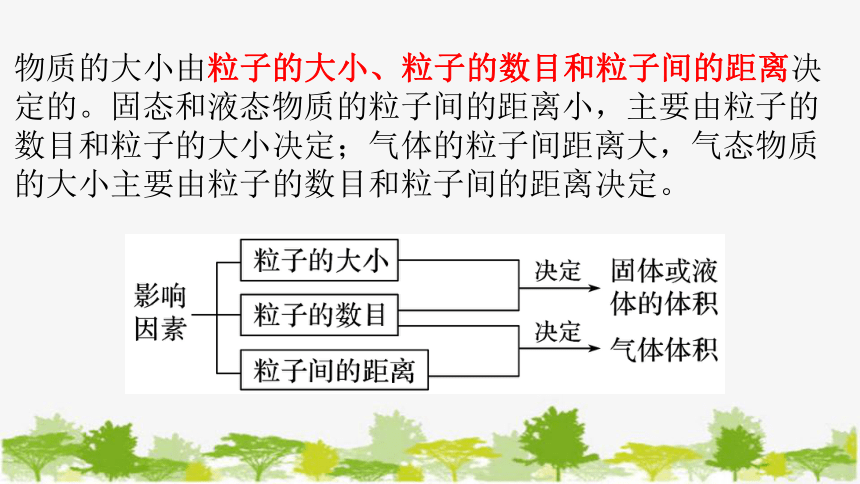
物质的大小由粒子的大小、粒子的数目和粒子间的距离决定的。固态和液态物质的粒子间的距离小,主要由粒子的数目和粒子的大小决定;气体的粒子间距离大,气态物质的大小主要由粒子的数目和粒子间的距离决定。
思考:1mol任何微粒的集合体所含的微粒数目都相同,但1mol不同物质的质量往往不同。那么,1mol不同物质的体积是否相同呢?
10 cm3
7.1 cm3
18 cm3
58.4 cm3
22.4L
22.4L
22.4L
1、在温度和压强一定时,物质的体积与物质所含微粒数目、微粒的大小和微粒之间的距离有关。任何1mol 固态物质或液态物质所含的微粒数相同。微粒之间的距离很小,但微粒的大小不同,所以1mol固态物质或液态物质的体积往往是不同的。
2、任何1mol气态物质所含微粒数相同,虽然微粒的大小不同,但微粒之间的距离要比微粒本身的直径在很多倍,所以1mol气态物质的体积主要取决于气态物质中微粒之间的距离。而这种距离与外界的温度、压强有关。当温度、压强一定时,任何气体(包括混合气体)微粒间的距离基本相同。
气体摩托尔体积
1、定义:
2、符号:
3、单位:
4、公式:
4、标况(0℃,101KPa):
5、影响因素:
单位物质的量的气体所占的体积称为气体摩尔体积。
Vm
L/mol或m3/mol
大量科学实验研究表明,在标准状况(273K,101KPa)下,1mol任何气体物质所占体积约为22.4L。
Vm=22.4L/mol
温度和压强
(1)看所处条件:必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。
(2)看物质状态:必须为气态。如标准状况下水、酒精、四氯化碳等为非气体物质。
(3)看数值单位:单位是L·mol-1,而不是L;数值“22.4”为近似值。
课堂练习1:
0.464g氦气的物质的量为多少?在标准状况下,这些氦气的体积为多少?
课堂练习2:
已知2Na+2H2O=2NaOH+H2↑,把9.2g金属Na投入水中充分反应,在标准状况下能产生多少体积的氢气?
科学实验研究表明:任何具有相同微粒数的气体都具有大致相同的体积。
三、阿伏加德罗定律
1、内容:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子
(1)同温同压下,相同体积的任何气体具有相同的分子数,也有相同的物质的量。
(2)温度、压强一定时,任何具有相同微粒数的气体都具有大致相同的体积。
2、推论:
同温同压下,任何气体的体积比等于物质的量之比,也等于气体的分子数之比。
课堂练习3:
下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等
D
课堂小结:
1.2.2 气体摩尔体积
思考:
1、1mol O2分子的个数为_____个,氧原子的个数为______个,质量是_____克。
32克
NA
2NA
2、1molO2分子的体积为多少 升?
从微观上考察,物质是原子、分子或离子的聚集体。
可见的宏观物质具有不同的聚集状态,如气态、液态和固态。同一种物质在不同的温度和压强下也可呈现出不同的聚集状态。
思考:
生活经验告诉我们:固体具有固定的形状,液体、气体没有固定的形状;气体容易被压缩,而固体、液体不易被压缩。
为什么固态、液态和气态物质的某些性质存在差异?这与物质的微观结构有何联系?
物质的聚集状态及其影响因素
从微观上考察,物质是原子、分子或离子的聚集体。可见的宏观物质具有不同的聚集状态,如气态、液态和固态。同一种物质在不同的温度和压强下也可呈现出不同的聚集状态。在固态、液态、气态物质中,微粒的运动方式、微粒之间的距离是不同的,不同聚集状态的物质微观上差异导致了物质性质的不同。
物质的大小由粒子的大小、粒子的数目和粒子间的距离决定的。固态和液态物质的粒子间的距离小,主要由粒子的数目和粒子的大小决定;气体的粒子间距离大,气态物质的大小主要由粒子的数目和粒子间的距离决定。
思考:1mol任何微粒的集合体所含的微粒数目都相同,但1mol不同物质的质量往往不同。那么,1mol不同物质的体积是否相同呢?
10 cm3
7.1 cm3
18 cm3
58.4 cm3
22.4L
22.4L
22.4L
1、在温度和压强一定时,物质的体积与物质所含微粒数目、微粒的大小和微粒之间的距离有关。任何1mol 固态物质或液态物质所含的微粒数相同。微粒之间的距离很小,但微粒的大小不同,所以1mol固态物质或液态物质的体积往往是不同的。
2、任何1mol气态物质所含微粒数相同,虽然微粒的大小不同,但微粒之间的距离要比微粒本身的直径在很多倍,所以1mol气态物质的体积主要取决于气态物质中微粒之间的距离。而这种距离与外界的温度、压强有关。当温度、压强一定时,任何气体(包括混合气体)微粒间的距离基本相同。
气体摩托尔体积
1、定义:
2、符号:
3、单位:
4、公式:
4、标况(0℃,101KPa):
5、影响因素:
单位物质的量的气体所占的体积称为气体摩尔体积。
Vm
L/mol或m3/mol
大量科学实验研究表明,在标准状况(273K,101KPa)下,1mol任何气体物质所占体积约为22.4L。
Vm=22.4L/mol
温度和压强
(1)看所处条件:必须为标准状况。非标准状况下,1 mol气体的体积不一定是22.4 L。
(2)看物质状态:必须为气态。如标准状况下水、酒精、四氯化碳等为非气体物质。
(3)看数值单位:单位是L·mol-1,而不是L;数值“22.4”为近似值。
课堂练习1:
0.464g氦气的物质的量为多少?在标准状况下,这些氦气的体积为多少?
课堂练习2:
已知2Na+2H2O=2NaOH+H2↑,把9.2g金属Na投入水中充分反应,在标准状况下能产生多少体积的氢气?
科学实验研究表明:任何具有相同微粒数的气体都具有大致相同的体积。
三、阿伏加德罗定律
1、内容:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子
(1)同温同压下,相同体积的任何气体具有相同的分子数,也有相同的物质的量。
(2)温度、压强一定时,任何具有相同微粒数的气体都具有大致相同的体积。
2、推论:
同温同压下,任何气体的体积比等于物质的量之比,也等于气体的分子数之比。
课堂练习3:
下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等
D
课堂小结:
