4.1.4 碱金属元素原子结构与元素的性质 课件(共23张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.4 碱金属元素原子结构与元素的性质 课件(共23张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 30.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:38:04 | ||
图片预览






文档简介
(共23张PPT)
第
四
章
物质结构
元素周期律
第一 节 原子结构与元素周期表
碱金属元素原子结构与元素的性质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解碱金属元素的原子结构特点及原子结构与元素性质的关系。
2.了解碱金属元素性质的相似性和递变性,并能初步运用原子结构理论进行解释。
3.能利用原子结构理论预测陌生元素的性质。
通过碱金属单质的性质的学习培养学生论据推理与模型认知的化学核心素养;运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
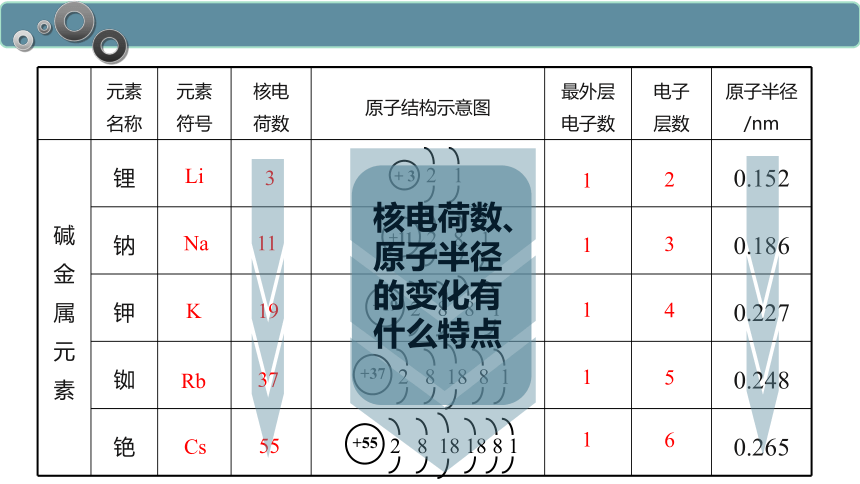
元素 名称 元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子 层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
核电荷数、原子半径的变化有什么特点
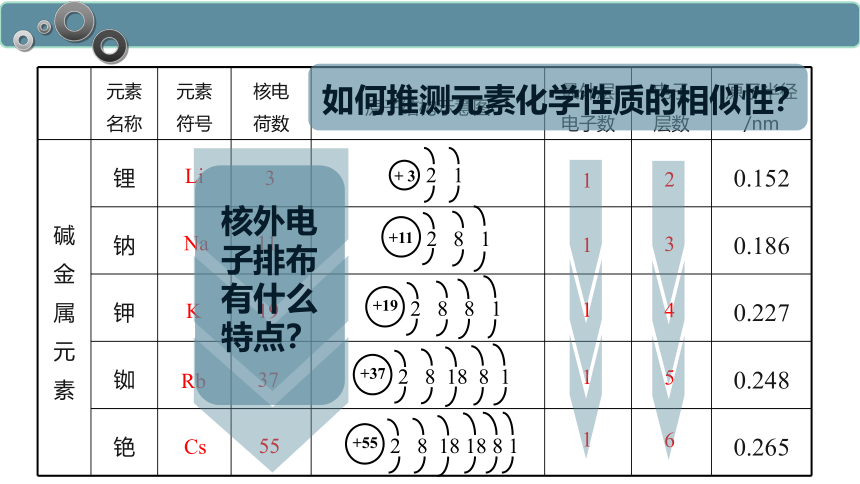
元素 名称 元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子 层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
核外电子排布有什么特点?
如何推测元素化学性质的相似性?
实验探究
一、碱金属化学性质的比较
问题和预测
(1)回忆:金属钠有哪些化学性质?
(2)结合金属锂、钠和钾的原子结构特点,预测锂和钾可能具有哪些与钠相似的化学性质?
钠在空气中燃烧
钠与水的反应
实验探究
碱金属化学性质的比较
实验和观察
实验探究
碱金属化学性质的比较
实验和观察
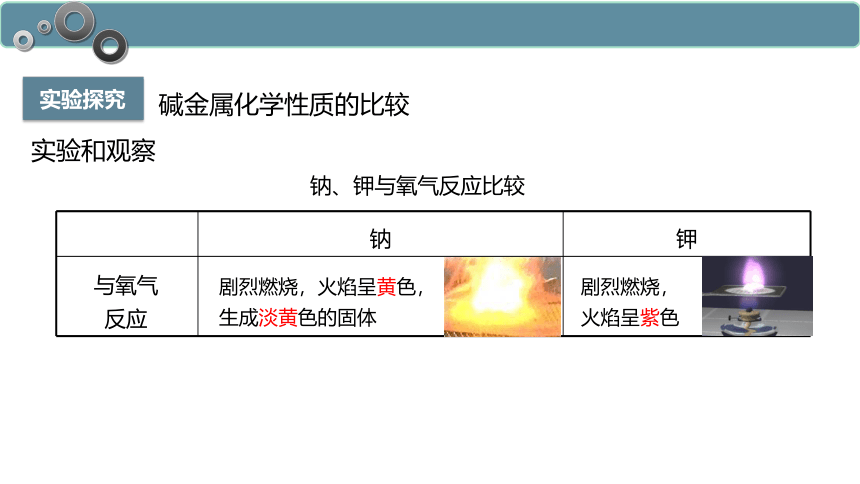
钠 钾
钠、钾与氧气反应比较
剧烈燃烧,火焰呈黄色,
生成淡黄色的固体
剧烈燃烧,
火焰呈紫色
与氧气
反应
实验探究
碱金属化学性质的比较
实验和观察
自主思考
钠 钾
与水反应 在水面上、___成银白色小球、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色小球、在水面上四处 、滴入酚酞溶液呈 色,有轻微爆炸现象
浮
熔
游动
红
钠、钾与水的反应比较
浮
熔
游动
红
碱金属化学性质的比较
实验和观察
自主思考
分析和结论
(1)通过实验、观察,讨论并总结钠、钾有哪些相似的化学性质?与你最初根据原子结构特点进行的预测是否一致?
(2)从实验现象比较钾、钠与水反应的难易程度,由此,你能推断出锂与水反应的难易程度吗?
(3)通过比较碱金属与水反应的难易程度,你能发现与它们的原子结构有什么关系吗?由此,你能推断出碱金属元素化学性质的相似性和递变规律吗?
碱金属化学性质的比较
知识总结
1.碱金属单质化学性质
1.1与氧气反应
碱金属化学性质的比较
结论:从Li到K,和氧气反应越来越剧烈,产物种类越来越多
4Na+O2 = 2Na2O
知识总结
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
1.碱金属单质化学性质
2Li + 2H2O = 2LiOH + H2 ↑ (较慢)
2Na + 2H2O = 2NaOH + H2 ↑ (激烈)
2K + 2H2O = 2KOH + H2 ↑ (很激烈)
2M + 2H2O = 2MOH + H2 ↑
1.2与水反应
碱金属化学性质的比较
(1)碱金属元素的化学性质相似
(2)碱金属元素的化学性质具有递变性
点拨提升
金属性:
(1)其单质与水(或酸)反应置换出氢的难易程度。
(2)最高价氧化物的水化物-----氢氧化物的碱性强弱。
越容易失电子,金属性越强,反之金属性越弱。
碱金属化学性质的比较
1.碱金属单质化学性质
元素原子失电子的性质
金属性强弱的判断:
(3)根据金属活动顺序表进行理论判断
知识总结
单质 颜色和状态 密度/g·cm-3 熔点/℃ 沸点/℃
Li 银白色,柔软 0.534 180.5 1 347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
增大
降低
降低
碱金属化学性质的比较
2.碱金属单质物理性质
点拔提升
名称 相似性 递变性
最外层 电子数 物理 性质 化学 性质 电子 层数 密度 熔点 沸点 元素
性质
锂Li
钠Na
钾K
铷Rb
铯Cs
1
软 白 轻 低 导
强还原性
逐 渐 增 多
呈增大趋势
逐 渐 降 低
逐 渐 降 低
增强
金属性逐渐
碱金属化学性质的比较
3.碱金属元素结构与性质的关系
形成方法
预 测
预测是在已有信息的基础上,依据一定规律和方法对未知事物所进行的一种推测。在化学研究中,可以根据物质的组成、结构和反应规律等,预测元素及其化合物的性质、可能发生的化学反应,并评估所作预测的合理性。
性 质
结 构
位 置
形成方法
★碱金属元素除了单质的性质具有相似性和递变性外,其化合物的性质也具有相似性和递变性。
[思考]根据规律推测:
2Na2O2 + 2CO2 ==2Na2CO3 + O2
△
2NaHCO3 == Na2CO3 + H2O + CO2↑
2K2O2 + 2CO2 ==2K2CO3 + O2
2KHCO3 == K2CO3 + H2O + CO2↑
△
预 测
形成方法
1.下列各组比较不正确的是( )
B
A、锂与水反应不如钠与水反应剧烈
B、还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C、熔、沸点:Li>Na>K
D、碱性:LiOH<NaOH<KOH
×
√
√
√
形成方法
2.下列关于碱金属原子结构和性质叙述中不正确的是( )
A、碱金属原子最外层都只有一个电子, 在化学反应中容易失去
B、都是强还原剂
C、都能在O2里燃烧生成过氧化物
D、都能与水反应生成碱
C
×
√
√
√
Li2O
KO2
ROH
形成方法
3.关于铯及其化合物的以下各种说法中不正确的是( )
A、氢氧化铯是一种强碱,比KOH的碱性强
B、铯与水或酸溶液反应剧烈,都生成氢气
C、Cs的还原性比Na强,故Na+的氧化性强于Cs+
D、Al的金属性大于Cs的金属性
×
√
√
√
D
形成方法
4.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
D
A、钡与水反应不如钠与水反应剧烈
B、钡可以从KCl溶液中置换出钾
C、氧化性:K+>Ba2+>Na+
D、碱性:KOH>Ba(OH)2>NaOH
×
√
×
×
形成方法
碱金属的原子结构及性质
化学性质相似
(1)易失电子,表现强还原性
核电荷数增多
电子层数增多
原子半
径增大
最外层上
只有一个电子
金属性
增强
还原性
增强
失电子能
力增强
原子核对最外层电子的引力减小
Li
K
Cs
(2)化合物中均为+1价
相似性
递变性
本节内容结束
第
四
章
物质结构
元素周期律
第一 节 原子结构与元素周期表
碱金属元素原子结构与元素的性质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解碱金属元素的原子结构特点及原子结构与元素性质的关系。
2.了解碱金属元素性质的相似性和递变性,并能初步运用原子结构理论进行解释。
3.能利用原子结构理论预测陌生元素的性质。
通过碱金属单质的性质的学习培养学生论据推理与模型认知的化学核心素养;运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
元素 名称 元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子 层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
核电荷数、原子半径的变化有什么特点
元素 名称 元素 符号 核电 荷数 原子结构示意图 最外层 电子数 电子 层数 原子半径/nm
碱金属元素 锂 0.152
钠 0.186
钾 0.227
铷 0.248
铯 0.265
Li
Na
K
Rb
Cs
3
11
19
37
55
1
1
1
1
1
2
3
4
5
6
+ 3
2 1
+11
2 8 1
+19
2 8 8 1
+37
2 8 18 8 1
+55
2 8 18 18 8 1
核外电子排布有什么特点?
如何推测元素化学性质的相似性?
实验探究
一、碱金属化学性质的比较
问题和预测
(1)回忆:金属钠有哪些化学性质?
(2)结合金属锂、钠和钾的原子结构特点,预测锂和钾可能具有哪些与钠相似的化学性质?
钠在空气中燃烧
钠与水的反应
实验探究
碱金属化学性质的比较
实验和观察
实验探究
碱金属化学性质的比较
实验和观察
钠 钾
钠、钾与氧气反应比较
剧烈燃烧,火焰呈黄色,
生成淡黄色的固体
剧烈燃烧,
火焰呈紫色
与氧气
反应
实验探究
碱金属化学性质的比较
实验和观察
自主思考
钠 钾
与水反应 在水面上、___成银白色小球、在水面上四处 、滴入酚酞溶液呈 色 在水面上、 成银白色小球、在水面上四处 、滴入酚酞溶液呈 色,有轻微爆炸现象
浮
熔
游动
红
钠、钾与水的反应比较
浮
熔
游动
红
碱金属化学性质的比较
实验和观察
自主思考
分析和结论
(1)通过实验、观察,讨论并总结钠、钾有哪些相似的化学性质?与你最初根据原子结构特点进行的预测是否一致?
(2)从实验现象比较钾、钠与水反应的难易程度,由此,你能推断出锂与水反应的难易程度吗?
(3)通过比较碱金属与水反应的难易程度,你能发现与它们的原子结构有什么关系吗?由此,你能推断出碱金属元素化学性质的相似性和递变规律吗?
碱金属化学性质的比较
知识总结
1.碱金属单质化学性质
1.1与氧气反应
碱金属化学性质的比较
结论:从Li到K,和氧气反应越来越剧烈,产物种类越来越多
4Na+O2 = 2Na2O
知识总结
产物碱性:
LiOH <NaOH <KOH < RbOH < CsOH
逐渐剧烈
1.碱金属单质化学性质
2Li + 2H2O = 2LiOH + H2 ↑ (较慢)
2Na + 2H2O = 2NaOH + H2 ↑ (激烈)
2K + 2H2O = 2KOH + H2 ↑ (很激烈)
2M + 2H2O = 2MOH + H2 ↑
1.2与水反应
碱金属化学性质的比较
(1)碱金属元素的化学性质相似
(2)碱金属元素的化学性质具有递变性
点拨提升
金属性:
(1)其单质与水(或酸)反应置换出氢的难易程度。
(2)最高价氧化物的水化物-----氢氧化物的碱性强弱。
越容易失电子,金属性越强,反之金属性越弱。
碱金属化学性质的比较
1.碱金属单质化学性质
元素原子失电子的性质
金属性强弱的判断:
(3)根据金属活动顺序表进行理论判断
知识总结
单质 颜色和状态 密度/g·cm-3 熔点/℃ 沸点/℃
Li 银白色,柔软 0.534 180.5 1 347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
增大
降低
降低
碱金属化学性质的比较
2.碱金属单质物理性质
点拔提升
名称 相似性 递变性
最外层 电子数 物理 性质 化学 性质 电子 层数 密度 熔点 沸点 元素
性质
锂Li
钠Na
钾K
铷Rb
铯Cs
1
软 白 轻 低 导
强还原性
逐 渐 增 多
呈增大趋势
逐 渐 降 低
逐 渐 降 低
增强
金属性逐渐
碱金属化学性质的比较
3.碱金属元素结构与性质的关系
形成方法
预 测
预测是在已有信息的基础上,依据一定规律和方法对未知事物所进行的一种推测。在化学研究中,可以根据物质的组成、结构和反应规律等,预测元素及其化合物的性质、可能发生的化学反应,并评估所作预测的合理性。
性 质
结 构
位 置
形成方法
★碱金属元素除了单质的性质具有相似性和递变性外,其化合物的性质也具有相似性和递变性。
[思考]根据规律推测:
2Na2O2 + 2CO2 ==2Na2CO3 + O2
△
2NaHCO3 == Na2CO3 + H2O + CO2↑
2K2O2 + 2CO2 ==2K2CO3 + O2
2KHCO3 == K2CO3 + H2O + CO2↑
△
预 测
形成方法
1.下列各组比较不正确的是( )
B
A、锂与水反应不如钠与水反应剧烈
B、还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C、熔、沸点:Li>Na>K
D、碱性:LiOH<NaOH<KOH
×
√
√
√
形成方法
2.下列关于碱金属原子结构和性质叙述中不正确的是( )
A、碱金属原子最外层都只有一个电子, 在化学反应中容易失去
B、都是强还原剂
C、都能在O2里燃烧生成过氧化物
D、都能与水反应生成碱
C
×
√
√
√
Li2O
KO2
ROH
形成方法
3.关于铯及其化合物的以下各种说法中不正确的是( )
A、氢氧化铯是一种强碱,比KOH的碱性强
B、铯与水或酸溶液反应剧烈,都生成氢气
C、Cs的还原性比Na强,故Na+的氧化性强于Cs+
D、Al的金属性大于Cs的金属性
×
√
√
√
D
形成方法
4.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )
D
A、钡与水反应不如钠与水反应剧烈
B、钡可以从KCl溶液中置换出钾
C、氧化性:K+>Ba2+>Na+
D、碱性:KOH>Ba(OH)2>NaOH
×
√
×
×
形成方法
碱金属的原子结构及性质
化学性质相似
(1)易失电子,表现强还原性
核电荷数增多
电子层数增多
原子半
径增大
最外层上
只有一个电子
金属性
增强
还原性
增强
失电子能
力增强
原子核对最外层电子的引力减小
Li
K
Cs
(2)化合物中均为+1价
相似性
递变性
本节内容结束
