4.1.5 卤族元素原子结构与元素的性质课件(共19张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.5 卤族元素原子结构与元素的性质课件(共19张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 23.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:39:05 | ||
图片预览





文档简介
(共19张PPT)
第
四
章
物质结构
元素周期律
第一 节 原子结构与元素周期表
卤族元素原子结构与元素的性质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解卤族元素的原子结构特点及原子结构与元素性质的关系。
2.了解卤族元素性质的相似性和递变性,并能运用原子结构理论进行解释。
3.能利用原子结构理论预测陌生元素的性质。
通过卤族元素单质的性质的学习培养学生论据推理与模型认知的化学核心素养;运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
知识拓展
请观察有关溴的实验现象,描述溴的物理特性
深红棕色液体,常温下唯一呈液态的非金属单质
密度比水大,在水中溶解度不大,溴水呈橙色;易溶于有机溶剂
易挥发,有刺激性气味,有毒,密闭保存,加水液封
知识拓展
紫黑色固体,蒸气呈紫色;
具有升华的性质,可用于分离、提纯碘晶体;
碘(I2)遇淀粉变蓝色。
微溶于水,碘水呈棕黄色,易溶于有机溶剂;
请观察有关碘的实验现象,描述碘的物理特性
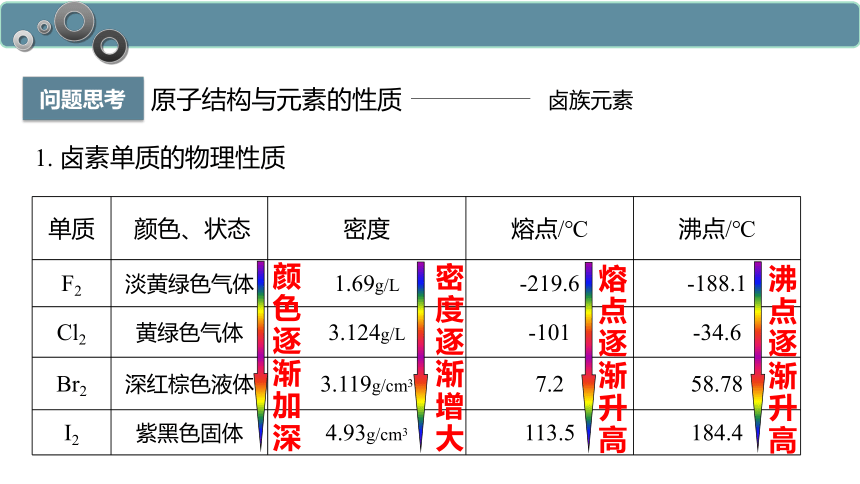
问题思考
1. 卤素单质的物理性质
单质 颜色、状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69g/L -219.6 -188.1
Cl2 黄绿色气体 3.124g/L -101 -34.6
Br2 深红棕色液体 3.119g/cm3 7.2 58.78
I2 紫黑色固体 4.93g/cm3 113.5 184.4
密度逐渐增大
熔点逐渐升高
沸点逐渐升高
颜色逐渐加深
原子结构与元素的性质
卤族元素
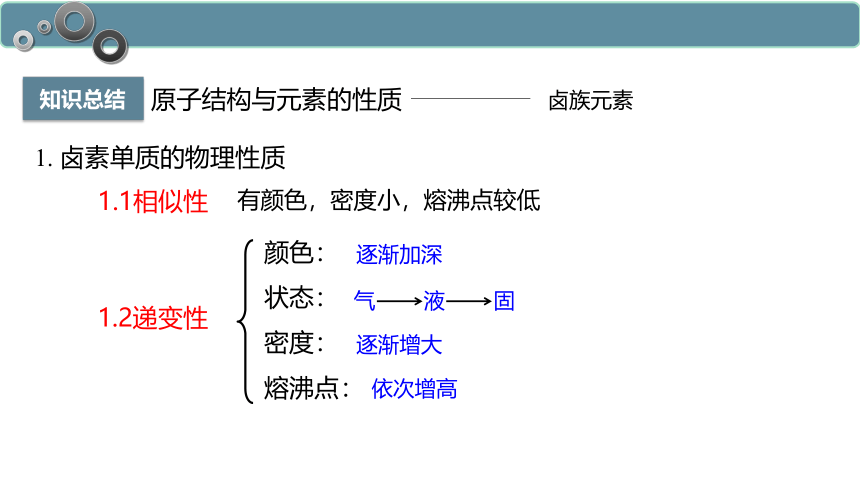
知识总结
有颜色,密度小,熔沸点较低
颜色:
状态:
密度:
熔沸点:
气 液 固
1.1相似性
1.2递变性
原子结构与元素的性质
卤族元素
1. 卤素单质的物理性质
逐渐加深
逐渐增大
依次增高
Cl
F
I
Br
知识提升
相同点
最外层7个电子
易得1个电子
不同点
电子层数递增
(半径依次增大)
原子结构
元素性质
2.卤族元素原子结构
原子得失电子
有非金属性
得电子变难
非金属性变弱
预测性质
单质都有氧化性
氧化性逐渐减弱
原子结构与元素的性质
卤族元素
实验探究
3.1卤素单质与氢气反应
暗处剧烈化合并爆炸;HF很稳定
光照或点燃反应;HCl较稳定
加热500℃ ;HBr不稳定
需不断加热,HI同时分解
■单质氧化性减弱,体现递变性
A条件越来越苛刻
B剧烈程度越来越弱
C产物稳定性变差
■都能跟氢气反应,体现相似性
H2+F2 === 2HF
H2+Cl2 ==== 2HCl
H2+Br2 === 2HBr
H2+I2 2HI
光照或点燃
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
如何设计实验方案证明氯气、溴单质、碘单质的氧化性依次减弱?
3.1卤素单质与氢气反应
实验探究
KBr溶液
氯水
溶液变为黄色
Cl2 + 2KBr = 2KCl +Br2
KI溶液
氯水
溶液变为深黄色
Cl2 + 2KI = 2KCl + I2
氧化性: Cl2>Br2
3.2单质间的置换反应
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
氧化性: Cl2>I2
②如何验证氧化性: Br2>I2 ?
①反应2I-+ Br2= I2+2Br- 能否发生?
预测
知识延伸
逐渐困难
X2 + H2O = HX + HXO(X≠F)
I2 + H2O = HI + HIO
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
2F2 + 2H2O = 4HF + O2 (剧烈反应)
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
3.3卤素单质与水反应
F2能否置换出氯化钠中的氯?
总结提升
1.卤素元素单质化学性质的相似性和递变性
(1)相似性(用X代表卤族元素):
单质X2
化合物→最高价氧化物对应水化物HXO4(除氟外)均为强酸
与氢气反应
与水反应
共性
X2 + H2O = HX + HXO(X为Cl、Br、I)
2F2 + 2H2O = 4HF + O2
特例
H2+X2 = 2HX
原子结构与元素的性质
卤族元素
总结提升
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱、还原性逐渐增强、水溶液的酸性逐渐增强,即:
(2)递变性
酸 性: HF②最高价氧化物对应水化物的酸性逐渐减弱,即:HClO4>HBrO4>HIO4。
原子结构与元素的性质
卤族元素
稳定性:HF>HCl>HBr>HI
还原性:F- < Cl- < Br - < I-
总结提升
①基于原子得电子难易或周期表位置进行理论说明
②基于元素最高价氧化物对应水化物酸性强弱、气态氢化物稳定性等经验性判断
③基于物质间的反应进行实验验证
Ⅰ.与H2化合的难易程度
Ⅱ.单质之间的置换反应
Ⅲ.利用强酸制取弱酸的反应
非金属性的强弱比较
(2)递变性
KBr溶液
氯水
2HClO4 + Na2CO3 === 2NaClO4 + H2O +CO2↑
原子结构与元素的性质
卤族元素
总结提升
2. 从原子结构角度认识卤族元素性质的递变规律
1. 卤素元素单质化学性质的相似性和递变性
原子结构与元素的性质
卤族元素
形成方法
1. 关于卤素X(依次为Cl、Br、I)的下列叙述不正确的是( )
B
A、卤素单质与水反应均可用 X2+H2O===HXO+HX 表示
B、HX都极易溶于水,它们的热稳定性随核电荷数增加而增强
C、卤素单质的颜色随相对分子质量增大而加深
D、相对分子质量小的卤素单质可将相对分子质量大的卤素从它的卤化物溶液里置换出来
形成方法
2. 下列不能说明氯元素的非金属性比硫元素强的事实是( )
A
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
形成方法
3. 砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
A、砹的非金属性在卤素中是最弱的,At-易被氧化
B、砹化氢不稳定,易分解
C、砹化银不溶于水或稀HNO3
D、砹在常温下是白色固体
D
形成方法
卤族元素
F2
Br2
I2
化学性质相似
(1)易得电子,表现强氧化性
核电荷数增多
电子层数增多
原子半
径增大
最外层上
有7个电子
非金属性
减弱
氧化性
减弱
得电子能
力减弱
原子核对最外层电子的引力减小
(2)最低化合价为 -1价
相似性
递变性
本节内容结束
第
四
章
物质结构
元素周期律
第一 节 原子结构与元素周期表
卤族元素原子结构与元素的性质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解卤族元素的原子结构特点及原子结构与元素性质的关系。
2.了解卤族元素性质的相似性和递变性,并能运用原子结构理论进行解释。
3.能利用原子结构理论预测陌生元素的性质。
通过卤族元素单质的性质的学习培养学生论据推理与模型认知的化学核心素养;运用原子结构理论解释元素性质,培养学生宏观辨识与微观探析的化学核心素养。
知识拓展
请观察有关溴的实验现象,描述溴的物理特性
深红棕色液体,常温下唯一呈液态的非金属单质
密度比水大,在水中溶解度不大,溴水呈橙色;易溶于有机溶剂
易挥发,有刺激性气味,有毒,密闭保存,加水液封
知识拓展
紫黑色固体,蒸气呈紫色;
具有升华的性质,可用于分离、提纯碘晶体;
碘(I2)遇淀粉变蓝色。
微溶于水,碘水呈棕黄色,易溶于有机溶剂;
请观察有关碘的实验现象,描述碘的物理特性
问题思考
1. 卤素单质的物理性质
单质 颜色、状态 密度 熔点/℃ 沸点/℃
F2 淡黄绿色气体 1.69g/L -219.6 -188.1
Cl2 黄绿色气体 3.124g/L -101 -34.6
Br2 深红棕色液体 3.119g/cm3 7.2 58.78
I2 紫黑色固体 4.93g/cm3 113.5 184.4
密度逐渐增大
熔点逐渐升高
沸点逐渐升高
颜色逐渐加深
原子结构与元素的性质
卤族元素
知识总结
有颜色,密度小,熔沸点较低
颜色:
状态:
密度:
熔沸点:
气 液 固
1.1相似性
1.2递变性
原子结构与元素的性质
卤族元素
1. 卤素单质的物理性质
逐渐加深
逐渐增大
依次增高
Cl
F
I
Br
知识提升
相同点
最外层7个电子
易得1个电子
不同点
电子层数递增
(半径依次增大)
原子结构
元素性质
2.卤族元素原子结构
原子得失电子
有非金属性
得电子变难
非金属性变弱
预测性质
单质都有氧化性
氧化性逐渐减弱
原子结构与元素的性质
卤族元素
实验探究
3.1卤素单质与氢气反应
暗处剧烈化合并爆炸;HF很稳定
光照或点燃反应;HCl较稳定
加热500℃ ;HBr不稳定
需不断加热,HI同时分解
■单质氧化性减弱,体现递变性
A条件越来越苛刻
B剧烈程度越来越弱
C产物稳定性变差
■都能跟氢气反应,体现相似性
H2+F2 === 2HF
H2+Cl2 ==== 2HCl
H2+Br2 === 2HBr
H2+I2 2HI
光照或点燃
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
如何设计实验方案证明氯气、溴单质、碘单质的氧化性依次减弱?
3.1卤素单质与氢气反应
实验探究
KBr溶液
氯水
溶液变为黄色
Cl2 + 2KBr = 2KCl +Br2
KI溶液
氯水
溶液变为深黄色
Cl2 + 2KI = 2KCl + I2
氧化性: Cl2>Br2
3.2单质间的置换反应
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
氧化性: Cl2>I2
②如何验证氧化性: Br2>I2 ?
①反应2I-+ Br2= I2+2Br- 能否发生?
预测
知识延伸
逐渐困难
X2 + H2O = HX + HXO(X≠F)
I2 + H2O = HI + HIO
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
2F2 + 2H2O = 4HF + O2 (剧烈反应)
3.卤素单质的化学性质
原子结构与元素的性质
卤族元素
3.3卤素单质与水反应
F2能否置换出氯化钠中的氯?
总结提升
1.卤素元素单质化学性质的相似性和递变性
(1)相似性(用X代表卤族元素):
单质X2
化合物→最高价氧化物对应水化物HXO4(除氟外)均为强酸
与氢气反应
与水反应
共性
X2 + H2O = HX + HXO(X为Cl、Br、I)
2F2 + 2H2O = 4HF + O2
特例
H2+X2 = 2HX
原子结构与元素的性质
卤族元素
总结提升
①与H2反应越来越难,对应氢化物的稳定性逐渐减弱、还原性逐渐增强、水溶液的酸性逐渐增强,即:
(2)递变性
酸 性: HF
原子结构与元素的性质
卤族元素
稳定性:HF>HCl>HBr>HI
还原性:F- < Cl- < Br - < I-
总结提升
①基于原子得电子难易或周期表位置进行理论说明
②基于元素最高价氧化物对应水化物酸性强弱、气态氢化物稳定性等经验性判断
③基于物质间的反应进行实验验证
Ⅰ.与H2化合的难易程度
Ⅱ.单质之间的置换反应
Ⅲ.利用强酸制取弱酸的反应
非金属性的强弱比较
(2)递变性
KBr溶液
氯水
2HClO4 + Na2CO3 === 2NaClO4 + H2O +CO2↑
原子结构与元素的性质
卤族元素
总结提升
2. 从原子结构角度认识卤族元素性质的递变规律
1. 卤素元素单质化学性质的相似性和递变性
原子结构与元素的性质
卤族元素
形成方法
1. 关于卤素X(依次为Cl、Br、I)的下列叙述不正确的是( )
B
A、卤素单质与水反应均可用 X2+H2O===HXO+HX 表示
B、HX都极易溶于水,它们的热稳定性随核电荷数增加而增强
C、卤素单质的颜色随相对分子质量增大而加深
D、相对分子质量小的卤素单质可将相对分子质量大的卤素从它的卤化物溶液里置换出来
形成方法
2. 下列不能说明氯元素的非金属性比硫元素强的事实是( )
A
①HCl比H2S稳定
②HClO氧化性比H2SO4强
③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S
⑤Cl原子最外层有7个电子,S原子最外层有6个电子
A.②⑤ B.①② C.①②④ D.①③⑤
形成方法
3. 砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备的性质是( )
A、砹的非金属性在卤素中是最弱的,At-易被氧化
B、砹化氢不稳定,易分解
C、砹化银不溶于水或稀HNO3
D、砹在常温下是白色固体
D
形成方法
卤族元素
F2
Br2
I2
化学性质相似
(1)易得电子,表现强氧化性
核电荷数增多
电子层数增多
原子半
径增大
最外层上
有7个电子
非金属性
减弱
氧化性
减弱
得电子能
力减弱
原子核对最外层电子的引力减小
(2)最低化合价为 -1价
相似性
递变性
本节内容结束
