2.3.1 物质的量 摩尔质量-高一化学人教版必修第一册同步课件(共19张PPT)
文档属性
| 名称 | 2.3.1 物质的量 摩尔质量-高一化学人教版必修第一册同步课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:40:42 | ||
图片预览





文档简介
(共19张PPT)
第二章 海水中的重要元素----钠和氯
第三节 物 质 的 量
物质的量 摩尔质量
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.理解物质的量及其单位
2.理解摩尔质量的概念
3.掌握物质的量与微粒数目、摩尔质量之间的换算
1.通过学生理解物质的量、摩尔质量的概念的理解,培养学生宏观辨识与微观探析的化学核心素养。
2.通过设置有效练习使学生理解物质的量、摩尔质量的应用,培养学习论据推理与模型认知的化学核心素养。
3.通过摩尔质量的计算对学生进行规范化解题格式的训练,强化学生的论据推理与模型认知的化学核心素养。
资料卡片
钻石早在4000多年前就被人类发现,事实上它已在地表蕴藏亿万年。由于它所散发出来的光泽永恒灿烂,在远古法老时代,钻石是贵族独有的珍宝,逐渐被用来象征爱情的坚贞不渝。关于它的传说也美丽得令人心动,希腊人说钻石是星星坠落地面的碎片,也传说它是天神的眼泪。不论是怎样的传说,现在钻石对于我们来说都是一种美丽的代表。你知道钻石的重量单位是什么吗?
思考交流
克拉是宝石的重量单位,1克拉等于0.2 g。在相当长的一个历史时期,各国所用的“克拉”表示的重量略有不同:巴黎 — 0.205 g,伦敦 — 0.20530 g,佛罗伦萨 — 0.197 20 g,马德里— 0.205 39 g,柏林 — 0.20544 g,阿姆斯特丹 — 0.20570 g,里斯本 — 0.20539 g,法兰克福— 0.20577 g,维也纳 — 0.20613 g,威尼斯 — 0.20770 g,印度 — 0.20735 g。
1907年巴黎召开的国际计量委员会第四次大会上,正式通过将标准克拉定为0.200 g。
拿什么来衡量宝石的重量呢?许多民族的祖先不谋而合,都想到用当地常见的植物种子。欧洲许多国家最初是用它们盛产的大麦来作砝码。但是各地区出产的大麦大小不同,重量差异大,用它称宝石,常常发生争端,最后找到一种种子----金合欢树的种子来作统一标准,因希腊人叫这种种子为“克拉”,就把它作为宝石的重量单位。
思考交流
你一口气能喝多少克水?
你知不知道一口气喝下了多少个水分子?
资料
一滴水中所含的水分子数,让全世界65亿人去数,每人每分钟数100个,日夜不停的数,需要5千年才能数完。
想办法在水分子数和水的质量之间找到一个桥梁——集体单位。。
宏 观
(质量)
微 观
(微粒数目)
物质的量
半杯 36g
1.7万亿个水分子
问题探究
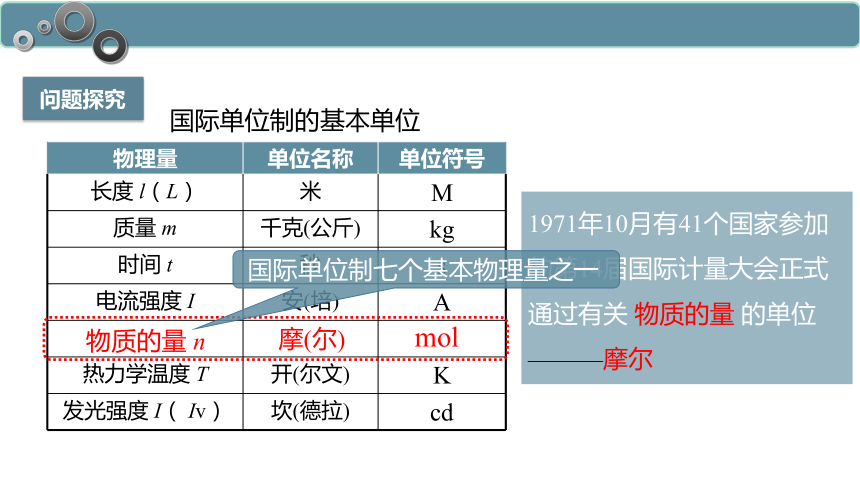
国际单位制的基本单位
物理量 单位名称 单位符号
长度 l(L) 米 M
质量 m 千克(公斤) kg
时间 t 秒 s
电流强度 I 安(培) A
热力学温度 T 开(尔文) K
发光强度 I( Iv) 坎(德拉) cd
物质的量 n
摩(尔)
mol
1971年10月有41个国家参加的第14届国际计量大会正式通过有关 物质的量 的单位
———摩尔
国际单位制七个基本物理量之一
知识点一
单位名称:_______ 符号:_____
1. 符号:____
n
摩尔
mol
2. 定义:表示含有一定数目粒子的集合体
对比:(宏观)
1打铅笔:
1双袜子:
1世纪:
12只
2只
100年
问题:(微观)
1mol某种微粒是多少个呢?
(如:1mol水分子有多少个水分子呢?)
物质的量
知识点一
单位名称:_______ 符号:_____
1. 符号:____
n
摩尔
mol
2. 定义:表示含有一定数目粒子的集合体
3. 使用:
(1)使用“摩尔”作单位时,所指粒子必须十分明确,且仅限于微观粒子。
(2)要用化学式指明微粒种类或其组合。
纠错:2molH,1molH2,1.5molNaOH,3molOH-,1.5molCa(OH)2,0.5mole-
物质的量
重要说明
3. 用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样表示。
1. “物质的量”是一个物理量的全称,是一个专有名词,不能当成物质的数量或质量来理解。
2. 摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
4. 物质的量的数值可以是整数,也可以是小数。
科学史话
意大利物理学家、化学家。1776年8月9日生于都灵的一个贵族家庭。1792年8月9日入都灵大学学习法学,1796年获法学博士,以后从事律师工作。1800~1805年又专门攻读数学和物理学,尔后主要从事物理学、化学研究。1811年,提出分子学说:分子由原子组成,并推出同体积气体在同温同压下含有同数目的分子,又称阿伏加德罗定律。阿伏加德罗对6.02 × 1023这个数据的得出有着重大贡献,故用其名字表示该常数以示纪念,即将6.02 × 1023 mol-1叫做阿伏加德罗常数,用NA表示。
Amedeo Avogadro
1776~1856
阿伏加德罗
知识点二
阿伏伽德罗常数
1. 定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。
2. 符号:NA
NA 6.02×1023 mol-1
?
=
≈
联系: π = 3.14 ???
1mol任何粒子的粒子数
(NA)单位:mol-1
6.02×1023
约为
约为
3. n、N、NA 关系:
n =
NA
N
思考交流
1mol物质的质量是多少?
1mol任何微粒的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量
粒子符号 相对原子(分子)质量 每个粒子的质量(g/个) 该物质含有的粒子数(个) 该物质质量(g)
C 12 1.993×10-23 6.02×1023
Fe 56 9.032×10-23 6.02×1023
H2SO4 98 1.628×10-22 6.02×1023
知识点三
2. 符号:
摩尔质量
1. 概念:
4. 公式:
1mol O2的质量是( )
O2的摩尔质量是( )
O2的相对分子质量是( )
32 g
32
32 g/mol
n =
M
m
3. 单位:
单位物质的量的物质所具有的质量
g· mol-1 或 kg· mol-1
M
理论应用
【解】Na2CO3的相对分子质量106,摩尔质量为106g·mol-1。
答:26.5g Na2CO3的物质的量是0.25mol。
26.5g Na2CO3的物质的量是多少?
形成方法
物质的量
微观粒子
宏观物质
× 6.02×1023
÷M
×M
m
n
N
÷ 6.02×1023
例题讲解
解析:摩尔是物质的量的单位,物质的量为物理量,A错误;0.5 mol H2O中含有原子的物质的量为:0.5mol×3=1.5mol,含有的原子数目为1.5NA,B正确;“64g氧”没有说明是O原子还是氧气分子,无法进行计算,C错误;分子可能由单原子、双原子和多原子组成,因此1 mol物质不一定含有NA个原子;D错误。
1. 下列说法中正确的是( )
A.摩尔是国际单位制中的七个物理量之一
B.0.5 mol H2O中含有的原子数目为1.5NA
C.64 g氧相当于2 mol氧
D.1 mol任何物质都约含有6.02×1023个原子
B
例题讲解
解析:1个氢氧根离子含有10个电子,1 mol OH-所含电子数为10NA,A正确;硫酸钠溶液中的阴离子除了硫酸根,还有氢氧根,故溶液中的阴离子所带的负电荷的数大于2NA个,B错误; 0.05molH2O含有的氢原子数为0.1NA ,C错误;CO和N2的摩尔质量均为28g·mol-1,二者构成的混合气体的摩尔质量也为28g·mol-1,因此14 g由CO和N2组成的混合气体中含有的分子总数0.5NA,D错误。
2. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 1 mol OH-所含电子数为10NA
B. 2 L 0.5 mol·L-1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 0.05molH2O含有的氢原子数为0.05NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
A
例题讲解
解析:钠失去电子的物质的量=0.1 mol×1=0.1 mol,A错误;硫酸与磷酸分子中都有4个氧原子,它们的物质的量相同,含有的氧原子数相同,B正确;氧气和臭氧分子中含有的氧原子数不同,混合气体中二者的含量不同,含有的氧原子数不同,C错误;氧分子(O2)与氖分子(Ne)的物质的量相同,二者所含原子的物质的量之比为2∶1,D错误。
3. NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 0.1 mol钠原子变成钠离子时,失去的电子数为0.2NA
B. 0.2NA个硫酸分子与0.2 mol磷酸含有相同的氧原子数
C. 1 mol 氧气和臭氧的混合气体中含有的氧原子数目为2.5NA
D.NA个氧分子与NA个氖分子所含原子的物质的量之比为1∶1
B
本节内容结束
第二章 海水中的重要元素----钠和氯
第三节 物 质 的 量
物质的量 摩尔质量
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.理解物质的量及其单位
2.理解摩尔质量的概念
3.掌握物质的量与微粒数目、摩尔质量之间的换算
1.通过学生理解物质的量、摩尔质量的概念的理解,培养学生宏观辨识与微观探析的化学核心素养。
2.通过设置有效练习使学生理解物质的量、摩尔质量的应用,培养学习论据推理与模型认知的化学核心素养。
3.通过摩尔质量的计算对学生进行规范化解题格式的训练,强化学生的论据推理与模型认知的化学核心素养。
资料卡片
钻石早在4000多年前就被人类发现,事实上它已在地表蕴藏亿万年。由于它所散发出来的光泽永恒灿烂,在远古法老时代,钻石是贵族独有的珍宝,逐渐被用来象征爱情的坚贞不渝。关于它的传说也美丽得令人心动,希腊人说钻石是星星坠落地面的碎片,也传说它是天神的眼泪。不论是怎样的传说,现在钻石对于我们来说都是一种美丽的代表。你知道钻石的重量单位是什么吗?
思考交流
克拉是宝石的重量单位,1克拉等于0.2 g。在相当长的一个历史时期,各国所用的“克拉”表示的重量略有不同:巴黎 — 0.205 g,伦敦 — 0.20530 g,佛罗伦萨 — 0.197 20 g,马德里— 0.205 39 g,柏林 — 0.20544 g,阿姆斯特丹 — 0.20570 g,里斯本 — 0.20539 g,法兰克福— 0.20577 g,维也纳 — 0.20613 g,威尼斯 — 0.20770 g,印度 — 0.20735 g。
1907年巴黎召开的国际计量委员会第四次大会上,正式通过将标准克拉定为0.200 g。
拿什么来衡量宝石的重量呢?许多民族的祖先不谋而合,都想到用当地常见的植物种子。欧洲许多国家最初是用它们盛产的大麦来作砝码。但是各地区出产的大麦大小不同,重量差异大,用它称宝石,常常发生争端,最后找到一种种子----金合欢树的种子来作统一标准,因希腊人叫这种种子为“克拉”,就把它作为宝石的重量单位。
思考交流
你一口气能喝多少克水?
你知不知道一口气喝下了多少个水分子?
资料
一滴水中所含的水分子数,让全世界65亿人去数,每人每分钟数100个,日夜不停的数,需要5千年才能数完。
想办法在水分子数和水的质量之间找到一个桥梁——集体单位。。
宏 观
(质量)
微 观
(微粒数目)
物质的量
半杯 36g
1.7万亿个水分子
问题探究
国际单位制的基本单位
物理量 单位名称 单位符号
长度 l(L) 米 M
质量 m 千克(公斤) kg
时间 t 秒 s
电流强度 I 安(培) A
热力学温度 T 开(尔文) K
发光强度 I( Iv) 坎(德拉) cd
物质的量 n
摩(尔)
mol
1971年10月有41个国家参加的第14届国际计量大会正式通过有关 物质的量 的单位
———摩尔
国际单位制七个基本物理量之一
知识点一
单位名称:_______ 符号:_____
1. 符号:____
n
摩尔
mol
2. 定义:表示含有一定数目粒子的集合体
对比:(宏观)
1打铅笔:
1双袜子:
1世纪:
12只
2只
100年
问题:(微观)
1mol某种微粒是多少个呢?
(如:1mol水分子有多少个水分子呢?)
物质的量
知识点一
单位名称:_______ 符号:_____
1. 符号:____
n
摩尔
mol
2. 定义:表示含有一定数目粒子的集合体
3. 使用:
(1)使用“摩尔”作单位时,所指粒子必须十分明确,且仅限于微观粒子。
(2)要用化学式指明微粒种类或其组合。
纠错:2molH,1molH2,1.5molNaOH,3molOH-,1.5molCa(OH)2,0.5mole-
物质的量
重要说明
3. 用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样表示。
1. “物质的量”是一个物理量的全称,是一个专有名词,不能当成物质的数量或质量来理解。
2. 摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
4. 物质的量的数值可以是整数,也可以是小数。
科学史话
意大利物理学家、化学家。1776年8月9日生于都灵的一个贵族家庭。1792年8月9日入都灵大学学习法学,1796年获法学博士,以后从事律师工作。1800~1805年又专门攻读数学和物理学,尔后主要从事物理学、化学研究。1811年,提出分子学说:分子由原子组成,并推出同体积气体在同温同压下含有同数目的分子,又称阿伏加德罗定律。阿伏加德罗对6.02 × 1023这个数据的得出有着重大贡献,故用其名字表示该常数以示纪念,即将6.02 × 1023 mol-1叫做阿伏加德罗常数,用NA表示。
Amedeo Avogadro
1776~1856
阿伏加德罗
知识点二
阿伏伽德罗常数
1. 定义:1mol任何粒子的粒子数叫做阿伏加德罗常数。
2. 符号:NA
NA 6.02×1023 mol-1
?
=
≈
联系: π = 3.14 ???
1mol任何粒子的粒子数
(NA)单位:mol-1
6.02×1023
约为
约为
3. n、N、NA 关系:
n =
NA
N
思考交流
1mol物质的质量是多少?
1mol任何微粒的质量以克为单位时,在数值上等于该微粒的相对原子质量或相对分子质量
粒子符号 相对原子(分子)质量 每个粒子的质量(g/个) 该物质含有的粒子数(个) 该物质质量(g)
C 12 1.993×10-23 6.02×1023
Fe 56 9.032×10-23 6.02×1023
H2SO4 98 1.628×10-22 6.02×1023
知识点三
2. 符号:
摩尔质量
1. 概念:
4. 公式:
1mol O2的质量是( )
O2的摩尔质量是( )
O2的相对分子质量是( )
32 g
32
32 g/mol
n =
M
m
3. 单位:
单位物质的量的物质所具有的质量
g· mol-1 或 kg· mol-1
M
理论应用
【解】Na2CO3的相对分子质量106,摩尔质量为106g·mol-1。
答:26.5g Na2CO3的物质的量是0.25mol。
26.5g Na2CO3的物质的量是多少?
形成方法
物质的量
微观粒子
宏观物质
× 6.02×1023
÷M
×M
m
n
N
÷ 6.02×1023
例题讲解
解析:摩尔是物质的量的单位,物质的量为物理量,A错误;0.5 mol H2O中含有原子的物质的量为:0.5mol×3=1.5mol,含有的原子数目为1.5NA,B正确;“64g氧”没有说明是O原子还是氧气分子,无法进行计算,C错误;分子可能由单原子、双原子和多原子组成,因此1 mol物质不一定含有NA个原子;D错误。
1. 下列说法中正确的是( )
A.摩尔是国际单位制中的七个物理量之一
B.0.5 mol H2O中含有的原子数目为1.5NA
C.64 g氧相当于2 mol氧
D.1 mol任何物质都约含有6.02×1023个原子
B
例题讲解
解析:1个氢氧根离子含有10个电子,1 mol OH-所含电子数为10NA,A正确;硫酸钠溶液中的阴离子除了硫酸根,还有氢氧根,故溶液中的阴离子所带的负电荷的数大于2NA个,B错误; 0.05molH2O含有的氢原子数为0.1NA ,C错误;CO和N2的摩尔质量均为28g·mol-1,二者构成的混合气体的摩尔质量也为28g·mol-1,因此14 g由CO和N2组成的混合气体中含有的分子总数0.5NA,D错误。
2. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A. 1 mol OH-所含电子数为10NA
B. 2 L 0.5 mol·L-1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 0.05molH2O含有的氢原子数为0.05NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
A
例题讲解
解析:钠失去电子的物质的量=0.1 mol×1=0.1 mol,A错误;硫酸与磷酸分子中都有4个氧原子,它们的物质的量相同,含有的氧原子数相同,B正确;氧气和臭氧分子中含有的氧原子数不同,混合气体中二者的含量不同,含有的氧原子数不同,C错误;氧分子(O2)与氖分子(Ne)的物质的量相同,二者所含原子的物质的量之比为2∶1,D错误。
3. NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 0.1 mol钠原子变成钠离子时,失去的电子数为0.2NA
B. 0.2NA个硫酸分子与0.2 mol磷酸含有相同的氧原子数
C. 1 mol 氧气和臭氧的混合气体中含有的氧原子数目为2.5NA
D.NA个氧分子与NA个氖分子所含原子的物质的量之比为1∶1
B
本节内容结束
