2.3.4 一定物质的量浓度溶液的配制-高一化学人教版必修第一册同步课件(共18张PPT)
文档属性
| 名称 | 2.3.4 一定物质的量浓度溶液的配制-高一化学人教版必修第一册同步课件(共18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:41:20 | ||
图片预览






文档简介
(共18张PPT)
第二章 海水中的重要元素----钠和氯
第三节 物 质 的 量
一定物质的量浓度溶液的配制
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
通过医学报告单中浓度的表示方法进行物质的量浓度的概念的学习,通过习题对概念进行理解和掌握,形成论据推理和模型认知的化学核心素养;通过讲解让学生了解配制一定物质的量浓度溶液的过程并完成实验及对实验的评价,形成科学探究与创新意识的化学核心素养。
1.理解物质的量浓度的概念,掌握有关物质的量的相关计算
2.会一定物质的量浓度溶液的配制并对实验进行评价
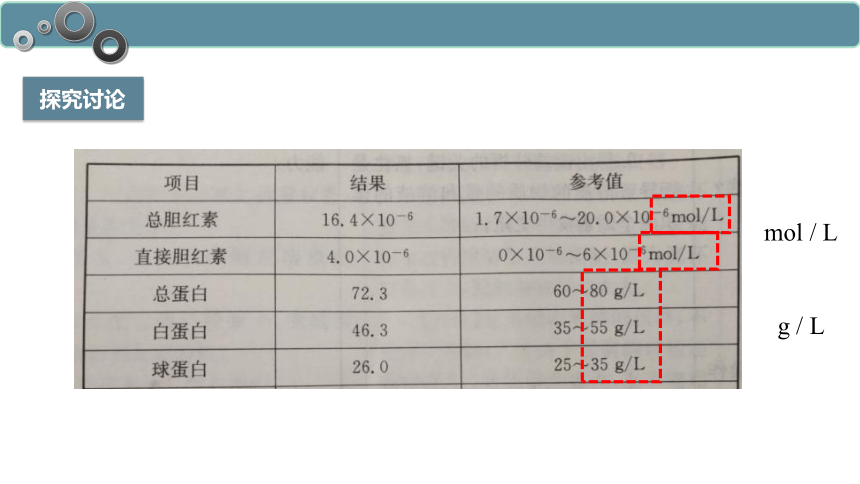
探究讨论
g / L
mol / L
知识点一
1. 定义:单位体积的溶液里所含溶质B的物质的量
2. 符号:cB
3. 单位:mol·L-1(或mol/L)
4. 表达式:cB=
物质的量浓度
思考讨论
1. 如果将1 mol NaCl溶于1 L水中所得溶液的物质的量浓度是1 mol·L-1吗?
2. 1 L 含58.5 g NaCl的溶液的物质的量浓度是不是1 mol·L-1?
3. 从1 mol·L-1NaOH溶液中取出100 mL,取出的溶液中NaOH的物质的量浓度是多少?哪些量变了,哪些量没变?
4. 若两种不同溶质的溶液,体积相同,浓度也相同,溶质的物质的量如何?质量如何?例如:1 L 1 mol·L-1的氯化钠溶液与同体积同浓度的盐酸。
物质的量浓度
概念理解
1. 溶质是用物质的量而不是用质量表示。
2. 是溶液的体积,并非溶剂的体积。
3. 单位:mol/L或mol·L-1。
4. 从某溶液取出任意体积的溶液,其物质的量浓度都相同,但所含溶质的物质的量因体积不同而不同。(溶液是均一、稳定的)
物质的量浓度
知识应用
配制500 mL 0.1 mol·L-1 NaOH溶液需要NaOH的质量是多少?
解:500 mL 0.1 mol·L-1 NaOH溶液中NaOH的物质的量为:
n(NaOH)=c(NaOH)·V〔NaOH (aq)〕
= 0.1 mol·L-1×0.5 L=0.05 mol
0.05 mol NaOH的质量为:
m(NaOH)= n(NaOH)·M(NaOH)
=0.05 mol×40 g·mol-1
=2 g
答:需要NaOH的质量是2g。
物质的量浓度
知识应用
1. 用40 g NaOH配成2 L溶液,其物质的量浓度为__________ mol·L-1。
2. 58.5 g NaCl配成500 mL溶液,其物质的量浓度_________ mol·L-1。
3. 2 mol NaOH配成200 mL溶液,其物质的量浓度为________ mol·L-1。
4. 物质的量浓度为2 mol·L-1的硫酸溶液250 mL,含H2SO4的物质的量为
________mol。
物质的量浓度
知识点一
问题探究
cB
=
nB
V
溶质物质的量
溶液体积的标定
nB
=
mB
M
------------------------
mol/L
电子天平
0.0001g
天平
0.1g
配制溶液浓度精确度的决定因素有哪些?
固体
nB
量筒
0.1mL
浓溶液
容量瓶
=cBV
(1)容量瓶的结构与规格
知识点二
容量瓶
④用途
①结构
②标志
③规格
温度
容量
100 mL、250 mL、500 mL、1 000 mL
刻度线
配制一定物质的量浓度的溶液
细颈、梨形、平底玻璃容器,带磨口玻璃塞
思考应用
(2)容量瓶的选择与使用
①容量瓶是配制物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
②使用前要检验容量瓶是否漏水:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
③使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
知识点三
配制100 mL 1.00 mol·L-1 氯化钠溶液
(2)
(3)
(4)
(5)
(6)
(7)
(1)
知识点三
1. 主要仪器
托盘天平、烧杯、量筒、玻璃棒、胶头滴管、
100ml容量瓶
2. 实验步骤
①计算
②称量
③溶解冷却
⑤ 洗涤
⑥定容
⑦摇匀
⑧装瓶
一定物质的量浓度的溶液的配制
摇匀后发现液面低于刻线,能否补充水?
④移液
算称量取步骤清,溶解转移再定容;
室温洗涤莫忘记,摇匀贴签移瓶中。
速
记
口
诀
思考应用
3. 误差分析
原理依据: c = ── = ──
n
V
m
MV
a 称量或量取
称量
量取
称量物放错(右物左码):
↓
砝码
生锈:m
c
↑
缺块:
c
m ,
↓
↓
c
仰视:
m ,
↑
↑
c
俯视:
m
m ,
↓
c
↓
↓
↑
b 转移:不小心将溶液溅出
m ,
↓
c
↓
c
c 洗涤时:
忘记洗涤或未把洗涤液倒入容量瓶
m ,
↓
↓
思考应用
d 定容时
仰视:
俯视:
V ,
↑
c
↓
↑
c
↓
↓
V ,
超了刻度线,用吸管吸出一部分
m ,
c
↓
e 转移时未冷却:
热胀冷缩原理,冷却后溶液体积减小
V ,
c
↓
↑
f 摇匀后液面下降,又加水至刻度线:
V ,
c
↓
↑
属正常现象,不应再加水
g 洗涤容量瓶后,未干燥,瓶中有少量的蒸馏水:
对浓度无影响
思考应用
下列配制的溶液物质的量浓度偏高的是( )
A、配制盐酸溶液用量筒量取盐酸时俯视刻度线
B、配制盐酸溶液定容时,仰视容量瓶刻度线
C、称量11.7gNaCl配制0.2mol/LNaCl溶液1000mL,砝码错放在左盘
D、NaOH溶解后未经冷却即注入容量瓶至刻度线。
D
正常读数看成偏大,少取了溶质,m减少,c偏低
实质称到的质量是10.3g,m偏小,c偏小
热胀冷缩的原理,未冷却,V膨胀,导致加水量减少,c偏高
正常读数看成偏小,多加了蒸馏水,V偏大,c偏低
形成方法
一定物质的量浓度的溶液的配制
1. 容量瓶使用的注意事项
2. 实验所需仪器
3. 步骤
4. 影响浓度的主要因素
本节内容结束
第二章 海水中的重要元素----钠和氯
第三节 物 质 的 量
一定物质的量浓度溶液的配制
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
通过医学报告单中浓度的表示方法进行物质的量浓度的概念的学习,通过习题对概念进行理解和掌握,形成论据推理和模型认知的化学核心素养;通过讲解让学生了解配制一定物质的量浓度溶液的过程并完成实验及对实验的评价,形成科学探究与创新意识的化学核心素养。
1.理解物质的量浓度的概念,掌握有关物质的量的相关计算
2.会一定物质的量浓度溶液的配制并对实验进行评价
探究讨论
g / L
mol / L
知识点一
1. 定义:单位体积的溶液里所含溶质B的物质的量
2. 符号:cB
3. 单位:mol·L-1(或mol/L)
4. 表达式:cB=
物质的量浓度
思考讨论
1. 如果将1 mol NaCl溶于1 L水中所得溶液的物质的量浓度是1 mol·L-1吗?
2. 1 L 含58.5 g NaCl的溶液的物质的量浓度是不是1 mol·L-1?
3. 从1 mol·L-1NaOH溶液中取出100 mL,取出的溶液中NaOH的物质的量浓度是多少?哪些量变了,哪些量没变?
4. 若两种不同溶质的溶液,体积相同,浓度也相同,溶质的物质的量如何?质量如何?例如:1 L 1 mol·L-1的氯化钠溶液与同体积同浓度的盐酸。
物质的量浓度
概念理解
1. 溶质是用物质的量而不是用质量表示。
2. 是溶液的体积,并非溶剂的体积。
3. 单位:mol/L或mol·L-1。
4. 从某溶液取出任意体积的溶液,其物质的量浓度都相同,但所含溶质的物质的量因体积不同而不同。(溶液是均一、稳定的)
物质的量浓度
知识应用
配制500 mL 0.1 mol·L-1 NaOH溶液需要NaOH的质量是多少?
解:500 mL 0.1 mol·L-1 NaOH溶液中NaOH的物质的量为:
n(NaOH)=c(NaOH)·V〔NaOH (aq)〕
= 0.1 mol·L-1×0.5 L=0.05 mol
0.05 mol NaOH的质量为:
m(NaOH)= n(NaOH)·M(NaOH)
=0.05 mol×40 g·mol-1
=2 g
答:需要NaOH的质量是2g。
物质的量浓度
知识应用
1. 用40 g NaOH配成2 L溶液,其物质的量浓度为__________ mol·L-1。
2. 58.5 g NaCl配成500 mL溶液,其物质的量浓度_________ mol·L-1。
3. 2 mol NaOH配成200 mL溶液,其物质的量浓度为________ mol·L-1。
4. 物质的量浓度为2 mol·L-1的硫酸溶液250 mL,含H2SO4的物质的量为
________mol。
物质的量浓度
知识点一
问题探究
cB
=
nB
V
溶质物质的量
溶液体积的标定
nB
=
mB
M
------------------------
mol/L
电子天平
0.0001g
天平
0.1g
配制溶液浓度精确度的决定因素有哪些?
固体
nB
量筒
0.1mL
浓溶液
容量瓶
=cBV
(1)容量瓶的结构与规格
知识点二
容量瓶
④用途
①结构
②标志
③规格
温度
容量
100 mL、250 mL、500 mL、1 000 mL
刻度线
配制一定物质的量浓度的溶液
细颈、梨形、平底玻璃容器,带磨口玻璃塞
思考应用
(2)容量瓶的选择与使用
①容量瓶是配制物质的量浓度溶液的专用仪器,选择容量瓶应遵循“大而近”的原则:所配溶液的体积等于或略小于容量瓶的容积。
②使用前要检验容量瓶是否漏水:加水→塞瓶塞→倒立→查漏→正立,瓶塞旋转180°→倒立→查漏。
③使用容量瓶注意“五不”:不能溶解固体;不能稀释浓溶液;不能加热;不能作反应容器;不能长期贮存溶液。
知识点三
配制100 mL 1.00 mol·L-1 氯化钠溶液
(2)
(3)
(4)
(5)
(6)
(7)
(1)
知识点三
1. 主要仪器
托盘天平、烧杯、量筒、玻璃棒、胶头滴管、
100ml容量瓶
2. 实验步骤
①计算
②称量
③溶解冷却
⑤ 洗涤
⑥定容
⑦摇匀
⑧装瓶
一定物质的量浓度的溶液的配制
摇匀后发现液面低于刻线,能否补充水?
④移液
算称量取步骤清,溶解转移再定容;
室温洗涤莫忘记,摇匀贴签移瓶中。
速
记
口
诀
思考应用
3. 误差分析
原理依据: c = ── = ──
n
V
m
MV
a 称量或量取
称量
量取
称量物放错(右物左码):
↓
砝码
生锈:m
c
↑
缺块:
c
m ,
↓
↓
c
仰视:
m ,
↑
↑
c
俯视:
m
m ,
↓
c
↓
↓
↑
b 转移:不小心将溶液溅出
m ,
↓
c
↓
c
c 洗涤时:
忘记洗涤或未把洗涤液倒入容量瓶
m ,
↓
↓
思考应用
d 定容时
仰视:
俯视:
V ,
↑
c
↓
↑
c
↓
↓
V ,
超了刻度线,用吸管吸出一部分
m ,
c
↓
e 转移时未冷却:
热胀冷缩原理,冷却后溶液体积减小
V ,
c
↓
↑
f 摇匀后液面下降,又加水至刻度线:
V ,
c
↓
↑
属正常现象,不应再加水
g 洗涤容量瓶后,未干燥,瓶中有少量的蒸馏水:
对浓度无影响
思考应用
下列配制的溶液物质的量浓度偏高的是( )
A、配制盐酸溶液用量筒量取盐酸时俯视刻度线
B、配制盐酸溶液定容时,仰视容量瓶刻度线
C、称量11.7gNaCl配制0.2mol/LNaCl溶液1000mL,砝码错放在左盘
D、NaOH溶解后未经冷却即注入容量瓶至刻度线。
D
正常读数看成偏大,少取了溶质,m减少,c偏低
实质称到的质量是10.3g,m偏小,c偏小
热胀冷缩的原理,未冷却,V膨胀,导致加水量减少,c偏高
正常读数看成偏小,多加了蒸馏水,V偏大,c偏低
形成方法
一定物质的量浓度的溶液的配制
1. 容量瓶使用的注意事项
2. 实验所需仪器
3. 步骤
4. 影响浓度的主要因素
本节内容结束
